Иммунологическое исследование при пародонтите
Опубликовано: 17.04.2024
В первую очередь, автореферат "Современные иммунологические аспекты в патогенезе заболеваний пародонта" будет интересен специалистам в области стоматологии, а также широкому кругу читателей, кто интересуется современными тенденциями в исследованиях и научными взглядами в лечении пародонтита.
Что особо хотелось отметить - это возраст исследуемых. Средний возраст - всего 38 (!) ле т. Заболевания пародонта "молодеют", причем процент наблюдаемых мужчин составил около 30 процентов, женщин - чуть менее 70 процентов. Пародонтит становится серьезнейшей проблемой, затрагивающей 99-100 процентов взрослого населения России.
Работа выполнена в Государственном бюджетном образовательном учреждении высшего профессионального образования «Московский медико-стоматологический университет имени А.И.Евдокимова» Министерства здравоохранения Российской Федерации (ГБОУ ВПО МГМСУ имени А.И.Евдокимова Минздрава России).
Научные консультанты:
- Янушевич Олег Олегович , Заслуженный врач РФ, Лауреат премии Правительства Российской Федерации в области науки и техники, доктор медицинских наук, профессор
- Гуревич Константин Георгиевич , доктор медицинских наук, профессор
Официальными оппонентами в диссертации выступили:
- Аванесов Анатолий Михайлович , доктор медицинских наук, профессор, заведующий кафедрой общей и клинической стоматологии медицинского института Федерального государственного автономного образовательного учреждения высшего образования «Российский университет дружбы народов».
- Иванова Елена Владимировна , доктор медицинских наук, доцент кафедры терапевтической стоматологии Государственного бюджетного образовательного учреждения дополнительного профессионального образования «Российская медицинская академия последипломного образования» Минздрава РФ.
- Панченко Леонид Фёдорович , доктор медицинских наук, профессор, заслуженный деятель науки РФ, академик РАН, заведующий лабораторией биохимии филиала ФГБУ «Федеральный медицинский исследовательский центр психиатрии и наркологии им. В.П. Сербского» Минздрава РФ.
С моей диссертацией в полном объеме можно ознакомиться в библиотеке ГБОУ ВПО МГМСУ имени А.И. Евдокимова МЗ РФ по адресу 127206, Москва, ул. Вучетича, д.10а
Актуальность проводимого исследования
Согласно последним исследованиям ВОЗ, более 90% населения старше 40 лет страдает заболеваниями пародонта: в Российской Федерации у взрослого населения распространенность заболеваний пародонта достигает 99- 100% . Лечение заболеваний пародонта до настоящего времени остается сложной и не до конца решенной медицинской проблемой. Функциональные расстройства зубочелюстной системы, обусловленные потерей зубов от заболеваний пародонта, развиваются в 5 раз чаще, чем при осложнениях кариеса (Грудянов А.И, 2009). Более того, воспалительные заболевания пародонта осложняются психологическими факторами, и проблема становится не только медицинской, но и социальной (Дмитриева Л.А, 2001).
Известно, что развитие заболеваний пародонта определяется сложным взаимодействием иммунной системы и патогенов, переоценка роли каждого из которых может привести к предвзятым выводам (Pollreisz A, Huang Y, Roth GA, et all, 2010).
Эти знания необходимы для развития иммуномодулирующих стратегий при лечении пародонтита , а также для максимальной защиты и минимизации разрушений тканей пародонта. В рамках расширенной парадигмы Th1/Th2/Th17, вероятно, можно будет объяснить, чем обуславливается защитная или деструктивная реакция в пародонте отдельных клеток, и тогда вероятно, появится возможность разработать адекватные терапевтические вмешательства, максимизирующие защитные и минимизирующие деструктивные функции T-клеток при заболеваниях пародонта.
Цель исследования
Изучение иммунологических аспектов хронического генерализованного пародонтита для разработки персонифицированного подхода к лечению и оценке прогноза течения заболевания.
Задачи исследования
- Выявить факторы риска развития хронического генерализованного пародонтита
- Провести индексную оценку состояния полости рта при пародонтите до и после лечения
- Выявить факторы, связанные с неэффективностью лечения пародонтита
- Исследовать показатели клеточного иммунитета при пародонтите.
- Изучить содержание цитокинов в десневой жидкости и плазме крови у пациентов с пародонтитом
- Определить уровень антител к P.gingivalis у здоровых лиц и больных пародонтитом
- Провести оценку состояния иммуно-интерфероновой системы при пародонтите
- Исследовать особенности дифференцировки лимфоцитов при заболеваниях пародонта
- Изучить влияние лечения на иммунологические показатели
Научная новизна полученных результатов исследования
- Показано , что развитие и неэффективность лечения хронического генерализованного пародонтита сопряжены с наличием модифицируемых и немодицицируемых факторов риска. Среди немодифицируемых основными являются: женский пол, возраст. Основными модифицируемыми факторами риска являются: нерациональное питание, гиподинамия, курение, ожирение.
- Показано , что при пародонтите изменяются показатели клеточного звена иммунитета.
- Выявлено , что содержание TNFα, IL-18, IL-17 и IFNγ в десневой жидкости и плазме крови больных пародонтитом выше, чем у контрольных лиц.
- Доказано , что содержание IL-4 и IL-10 в десневой жидкости и плазме крови при пародонтите ниже, чем у практически здоровых лиц. В десневой жидкости и плазе крови наблюдается дисбаланс цитокинов остеокластогенеза. У 5% клинически здоровых лиц определены значимые титры IgA и IgM к P.gingivalis. Данные антитела выявлены у 100% больных пародонтитом. У 1 / 10 больных отсутствует выработка IgG к P.gingivalis.
- Обнаружено , что эффективность иммунного ответа на P.gingivalis, определяемая по выработке антител, связана с социально-демографическими, поведенческими и клиническими факторами.
- Выявлено три типа изменений системы интерферона при пародонтите: а) резкое снижение продукции IFNα и IFNγ, повышение уровень сывороточного IFN, б) снижение уровней сывороточного IFN, существенное снижение продукции IFNα и IFNγ на фоне повышения спонтанного синтеза IFN, в) снижение продукции IFNα и IFNγ, повышением уровня сывороточного IFN.
- Доказано , что при пародонтите снижается экспрессия CD14 и повышается экспрессия CD16 и CD45RA на лимфоцитах периферической крови.
- При пародонтите выявлено два основных типа изменений со стороны лимфоцитов: а) снижение числа цитототоксических Т-лимфоцитов (CD3 + CD8 + ), увеличение CD3 - CD8 + клеток (73,2% пациентов), б) повышение числа В-лимфоцитов и NK-клеток, выраженное снижение уровня Т-лимфоцитов (15,4% пациентов). При увеличении числа NK- клеток у 100% пациентов наблюдаются признаки резорбции костной ткани, а последующее лечение в 2/3 случаев будет неэффективным.
Какие научные положения были вынесены на защиту моей докторской диссертации
- Развитие и неэффективность лечения хронического генерализованного пародонтита сопряжены с наличием модифицируемых и немодифицируемых факторов риска.
- При пародонтите изменяются показатели клеточного звена иммунитета.
- Пародонтит сопряжен с дисбалансом про- и противо-воспалительных цитокинов как в десневой жидкости, так и в крови.
- Эффективность иммунного ответа на P.gingivalis, определяемая по выработке антител, связана с социально-демографическими, поведенческими и клиническими факторами.
- При хроническом пародонтите наблюдается три типа изменений системы интерферона и два основных типа изменений со стороны лимфоцитов.
Теоретическая и практическая значимость полученных результатов
- Разработана методология персонифицированной оценки течения пародонтита.
- Показана высокая иммунологическая эффективность лечения хронического генерализованного пародонтита методом root planing, которая позволяет добиться клинического улучшения состояния больного в 81% случаев через 6 месяцев . Данный метод также имеет положительное влияние на изучаемые показатели иммунной системы.
- Выявлены факторы, приводящие к снижению эффективности лечения хронического генерализованного пародонтита. К немодифицируемым относятся возраст и женский пол. К модифицируемым относятся курение, питание, низкая двигательная активность. Воздействие на них может повысить эффективность лечения пародонтита.
- Наиболее информативным методом изучения иммунного статуса при пародонтите является исследование малых субпопуляций лимфоцитов.
- Интерфероновый статус и уровень антител к P.gingivalis обладают прогностической информативностью в отношении течения хронического генерализованного пародонтита.
- Результаты работы послужили основанием для информационно-методического письма главного внештатного специалиста стоматолога МЗ РФ от 04.03.2015 года, главного внештатного стоматолога здравоохранения Ростовской области от 16.02.2015 года.
Внедрение результатов исследования
Результаты исследования послужили основанием для написания информационно-методических писем главного внештатного специалиста стоматолога МЗ РФ и главного внештатного стоматолога здравоохранения Ростовской области. Результаты используются в работе Министерства здравоохранения Республика Мордовия, в клинике ГБОУ ВПО КДМК МГМСУ им. А.И. Евдокимова МЗ РФ, ГБОУ ВПО Ростовский государственный медицинский университет МЗ РФ, поликлиническом отделении ФГБУ «РНИИАиП» МЗ РФ, ГАУ Ростовской области «Стоматологическая поликлиника», «Стоматологической поликлинике №4» Ростовской области.
Апробация результатов исследования
Материалы диссертации были доложены и обсуждены на заседании:
- кафедры «Пародонтологии»,
- кафедры ЮНЕСКО «Здоровый образ жизни-залог успешного развития»,
- кафедры патофизиологии,
- кафедры клинической стоматологии №3 ГБОУ ВПО Московский государственный медико-стоматологический университет МЗ РФ.
- III международной студенческой Научно-практической конференции, РУДН, Москва (2011),
- 7 конгрессе European Federation of Periodontology (2012) Vienna, Austria,
- VIII Всероссийской конференции «Иммунологические чтения в Челябинске» (2013),
- 8 конгрессе European Federation of Periodontology (2015) London.
По теме моей диссертации " Современные иммунологические аспекты в патогенезе заболеваний пародонта опубликовано 26 работ , из них - 19 в журналах рекомендованных ВАК (Высшей Аттестационной Комиссией).
Я самостоятельно осуществляла подбор пациентов в исследование. Проводила клиническое, инструментальное и лабораторное обследование. Мной проведён анализ отечественной и зарубежной литературы, сформулированы цель, задачи, этапы и методы исследования, научные положения, выносимые на защиту, выводы и практические рекомендации. Я участвовала в иммунологических исследованиях, заполняла специально разработанные учетные формы и клинические карты. Также мной проведена статистическая обработка обобщенного материала, результаты статистической обработки вы сможете увидеть в этой статье.
У вас наблюдаются симптомы пародонтита? Все предыдущее лечение пародонтита оказалось неэффективным?
Записаться на прием к д.м.н. Теблоевой Лауре Михайловне!
В исследование было включено 340 пациентов с пародонтитом
Итак, в мое исследование включено 340 пациентов с хроническим генерализованным пародонтитом, обратившихся в момент обострения заболевания, которые составили основную группу.
Средний возраст обратившихся был 38+0,5 лет , из них 30,1% составили мужчины. То есть женщины в исследовании составили чуть меньше 70%. Все обратившиеся - жители Москвы и Московской области. Обследованные удовлетворяли перечисленным ниже критериям включения, невключения и исключения из исследования.
Критерии включения в исследование:
мужчины и женщины в возрасте от 21 до 50 лет; постоянное проживание в Москве или Подмосковье; верифицированный диагноз «пародонтит средней степени тяжести»; отсутствие предшествующего лечения пародонтита в течение не менее 6 месяцев; прикус ортогнатический, вторичная адентия – III класс дефектов зубных рядов по Кеннеди Е. (1974) – включенные дефекты в области моляров или премоляров с одной стороны – отсутствие не более 2 зубов; наличие несъемных ортопедических конструкций – одиночные искусственные коронки, мостовидные протезы – время изготовления менее 3-х лет, удовлетворяющие гигиеническим требованиям; способность свободно читать и заполнять анкеты; у женщин на основании опроса – отсутствие беременности и кормления грудью, климактерического синдрома; высказанное в письменном виде письменное добровольное согласие на участие в исследовании.
Критерии исключения из исследования:
пародонтит легкой или тяжелой степени тяжести; предшествующее лечение пародонтита в течение 6 месяцев и менее до первого визита; для женщин – беременность или послеродовый период, а также климактерический синдром (отсутствие менструаций со слов женщины более 1 месяца); другие воспалительные или дегенеративные заболевания полости рта; системные заболевания; патологические виды прикуса; частичная вторичная адентия – I, II, IV классы дефектов зубных рядов по Кеннеди Е. (1974); III класс по Кеннеди Е. – отсутствие более 2 зубов; наличие съемных ортопедических конструкций; наличие несъемных ортопедических конструкций, время изготовления которых более 3-х лет, не удовлетворяющих гигиеническим требованиям; трудности с чтением и заполнением анкет; отсутствие письменного добровольного согласия на участие в исследовании.
Критерии невключения в исследование:
лица, находящиеся под действием алкоголя или наркотиков; пациенты, не способные обслуживать себя самостоятельно; наличие острых воспалительных заболеваний вне полости рта; возраст менее 21 лет и более 50 лет;
Чтобы отобрать указанных пациентов, было осмотрено 668 пациентов , обратившихся по поводу пародонтита.
Социальный статус пациента оценивали на основании специальной анкеты. Индекс массы тела рассчитывали на основании сообщенных пациентом данных о росте и весе.
Комплексное обследование пациентов с пародонтитом включало клиническое, индексное и рентгенологическое исследования.
При постановке диагноза использована классификация, в основу которой положена клиническая форма заболевания, с определением характера тяжести течения. Данная классификация принята в 1983 г. на 16 Пленуме Всесоюзного общества стоматологов в г. Ереван. Для индексной оценки состояния тканей пародонта использовали метод Силнеса и Лоэ, индекс РМА, индекс CPITN, метод Muhleman в модификации Cower, индекс гигиены Грина Вермильона, измерение глубины пародонтальных карманов с помощью зондов Уильямса.
Антитела к P.gingivalis определяли в плазме крови. Использовался иммуно-ферментный анализ (ИФА) для определения IgG, IgM, IgE. Все реактивы были производства фирмы Sigma (США). В работе использован "сэндвич"-вариант твердофазного ИФА. Исследования выполнены ФГБУ «ФНИЦ эпидемиологии и микробиологии имени Н.Ф. Гамалеи» МЗ РФ.
Показатели интерферонового-статуса определяли микрометодом в цельной крови по методике Григорян С.С и др. (1988). Исследования выполнены в лаборатории интерферонов и интерфероногенеза в ФГБУ «ФНИЦ эпидемиологии и микробиологии имени Н.Ф. Гамалеи» МЗ РФ.
Исследование субпопуляционного состава лимфоцитов периферической крови проводили с применением проточного цитофлюориметра на базе лаборатории клеточной иммунологии ФГБУ «ФНКЦ ДГОИ им. Дмитрия Рогачёва МЗ РФ. В работе использована двух-платформенная технология: при подсчете абсолютного количества клеток задействованы 2 прибора – проточный цитофлюориметр и гематологический анализатор.
Анализ содержания цитокинов IFN-γ, IFN-α, IL-4, IL-10 и TNF-α проводили с помощью твердофазного иммуноферментного анализа. Исследования выполнены в лаборатории интерферонов и в ФГБУ «ФНИЦ эпидемиологии и микробиологии имени Н.Ф. Гамалеи» МЗ РФ.
Законы распределения параметров устанавливали с помощью λ-критерия Колмогорова-Смирнова. При непротиворечии гипотезе о нормальном распределении сравнение дисперсий проводили при помощи F-критерия Фишера. При равенстве дисперсий для сравнения средних применяли t-критерий Стьюдента, иначе – критерий Уэлча. При противоречии гипотезе о нормальном распределении средние величины сравнивали с использованием U-статистики Вилкоксона-Мана-Уитни и X критерий Ван-дер Вардена. Для изучения механизмов взаимосвязи параметров применен корреляционный анализ. Вычисляли коэффициент ранговой корреляции Кэндалла, что позволило не учитывать закон распределения изучаемых параметров. Полученные коэффициенты корреляции сравнивали с нулем для определения их значимости и между собой для определения различий (Лакин Г.Ф., 1990; Харламов и соавт., 1994). Частоты встречаемости признаков оценивали методом «случай-контроль» с расчетом отношения шансов (OR, odds ratio). 95% доверительные интервалы рассчитывали методом Фишера (OR-Cl95%) (Гржибовский А.М., 2008).
Результаты собственных исследований
До начала лечения пациенты предъявляли жалобы на кровоточивость дёсен при чистке зубов, подвижность зубов, запах изо рта. В анамнезе у пациентов выявлены следующие поведенческие факторы риска: курение, нерациональное питание, гиподинамия, ожирение, аборты. У 35% мужчин и 12% женщин установлено предшествующее неэффективное лечение пародонтита, причем среди женщин это число достоверно ниже (таблица 1).
Типичная анамнестическая картина у пациентов до начала лечения пародонтита в зависимости от пола
Проблема заболеваний пародонта до настоящего времени остается в центре внимания многочисленных исследований и является актуальной в стоматологии. Это объясняется рядом причин, и прежде всего распространенностью [1].
Одним из самых актуальных направлений пародонтологии является поиск эффективных способов лечения пародонтита.
Причиной низкой эффективности лечения заболеваний пародонта является недостаточное знание механизмов развития данной патологии.
Новые технологии, применяемые в комплексном лечении деструктивных форм пародонтита, направлены на восстановление гомеостаза в тканях пародонта. Но результат многолетних наблюдений убеждает в необходимости воздействия на иммунологическую реактивность организма в целом [1, 5].
Еще Кабаков Б.Д. в 1957 г. описал 12 незубных признаков пародонтита: бессонница, головная боль, «летучие» боли в суставах, ощущения «песка в глазах», нарушение памяти, потливость и т. д. [2].
Нервная, эндокринная и иммунная системы связаны топографически и характеризуются общностью модулирующих и трансмиттерных медиаторов, взаимодействие которых определяет гомеостаз и характер иммунного ответа тканей пародонта и организма в целом в условиях патологии [1, 2, 6].
Очевидно, это объясняется хронической интоксикацией организма, нарушениями в иммунной и вегетативной нервной системах [2].
Реализация комплекса лечебных мероприятий при пародонтите, коррекция иммунных расстройств, хотя и представляется весьма актуальной, к сожалению, остается практически не разработанным методом лечения.
Многочисленными исследованиями установлено при генерализованном пародонтите угнетение иммунной реактивности как по клеточным, так и по гуморальным факторам [1].
В этом аспекте представляется перспективным применение иммуномодулятора Галавит, оказывающего универсальное многофакторное действие на иммунную и нервную системы [3, 4].
Представленные данные клинико-иммунологического исследования свидетельствуют об иммуномодулирующем и, возможно, анксиолитическом эффектах Галавита.
Галавит, синтетический препарат, производное аминофталгидразида, обладает иммуномодулирующим и противовоспалительным действием.
Основные клинические эффекты Галавита обусловлены способностью воздействовать на функционально-метаболическую активность макрофагов. Препарат обратимо ингибирует избыточный синтез ФНО-альфа, ИЛ-1, ИЛ-6, а также синтез активных форм кислорода и других противовоспалительных цитокинов гиперактивированными макрофагами. Это в свою очередь определяет степень и цикличность воспалительных реакций, а также выраженность интоксикации. Галавит регулирует пролиферативную активность лимфоцитов, стимулирует микробоцидную функцию нейтрофильных гранулоцитов, усиливая фагоцитоз и повышая неспецифическую резистентность организма к инфекционным заболеваниям.
Таким образом, на уровне клеточного звена Галавит:
- нормализует содержание Т-лимфоцитов, В-лимфоцитов и NK-клеток;
- регулирует фагоцитарную активность нейтрофилов;
- регулирует фагоцитарную активность моноцитарно-макрофагального звена иммунной системы;
- улучшает качество представления и распознавания антигена;
- нормализует экспрессию молекул адгезии на моноцитарно-макрофагальном звене;
- стабилизирует клеточные мембраны.
На уровне гуморального звена Галавит:
- нормализует содержание иммуноглобулинов IgG, IgM и IgA;
- усиливает аффинность иммуноглобулинов;
- нормализует выработку эндогенных интерферонов и интерлейкинов [4].
Важнейшей причиной, способствующей развитию воспаления пародонта, является дефект иммунологической защиты в организме.
В последние годы подтверждаются предположения о существенной роли в иммунопатогенезе заболеваний пародонта, аутоиммунных реакций против антигенов пародонта [1].
При обострении пародонтита отмечается общая интоксикация, которую можно обнаружить по иммунограмме – подавление физиологической (фагоцитарной и адгезивной) активности нейтрофилов, наличие в ядрах и цитоплазме нейтрофилов дегенеративных сдвигов [5].
К сожалению, не многие иммунотропные препараты способны управлять воспалительной реакцией, усиливать экспрессию одних медиаторов, и ослабевать действие других. Очевидно, уникальность Галавита заключается и в противовоспалительном действии за счет индукции противовоспалительных цитокинов (ИЛ-4, ИЛ-10).
Для объективной оценки комплексного лечения пародонтита с применением Галавита нами проводились клинические и иммунологические исследования.
Оценка иммунного статуса больных со средней и тяжелой формой генерализованного пародонтита позволила установить существенный дисбаланс параметров иммунной реактивности, который не устраняется традиционными методами (хирургическое вмешательство, антибактериальная терапия) лечения. Это объясняется избыточным образованием иммунокомпетентными клетками аутоантител и, как следствие, провоцированием обострения патологического процесса в тканях пародонта.
Уже на 5-й день лечения Галавитом исчезали симптомы интоксикации: утомляемость, слабость и т. д. При иммунологическом исследовании выявлялась нормализация в системе иммунитета: повышение в крови нейтрофилов, увеличение их фагоцитарной активности, снижение количества нейтрофилов с признаками дегенерации и экспрессией Fas-рецепторов (табл. 1).
Таблица 1
Лейкоформула крови у больных пародонтитом (n=31)
| До лечения | На 5-й день | Норма | |
| Лимфоциты (109) | 3,8±1,9 | 5,1±0,5 | 4,5±0,3 |
| Эозинофилы, % | 5,0±1,1 | 2,0±1,5 | 1,8±0,2 |
| Палочкоядерные, % | 3,2±0,5 | 1,3±0,8 | 1,5±0,5 |
| Сегментоядерные, % | 42,0±1,6 | 60,5±3,5 | 59±6,0 |
| Моноциты, % | 6,1±2,8 | 5,5±2,5 | 5,2±1,5 |
| Лимфоциты, % | 52,6±8,0 | 29,3±2,8 | 32±3,8 |
| СОЭ, мм/г | 58,4±5,9 | 21,5±3,5 | 22,5±3,5 |
За счет нормализации количественных показателей иммунокомпетентных клеток восстанавливается и интерлейкиновый профиль, что подтверждает способность Галавита нормализовать функциональную активность системы иммунитета (табл. 2).
Таблица 2
Динамика иммунологических показателей больных пародонтитом при применении Галавита (n=31)
| Иммунологические показатели | До лечения | Через 1,5 месяца после лечения | Контрольная группа |
| CD3 (%) | 51,6±3,8 | 62,9±4,8 | 68,3±2,4 |
| CD4 (%) | 30,1±3,1 | 39,9±3,5 | 35,6±3,4 |
| CD8 (%) | 14,8±2,3 | 16,9±3,9 | 17,5±3,4 |
| CD22 (%) | 10,9±2,7 | 21,1±3,1 | 25,3±1,9 |
| IgA (г/л) | 1,24±0,5 | 1,9±0,4 | 2,5±1,0 |
| IgM (г/л) | 2,4±0,2 | 1,6±0,2 | 1,7±0,1 |
| IgG (г/л) | 17,7±0,7 | 15,6±0,8 | 13,2±0,7 |
| С3 фракция комплимента | 14,1±0,2 | 2,1±0,15 | 0,95±0,05 |
Проведенная иммунокоррекция Галавитом способствовала нормализации показателей до 6 месяцев у 30% больных (9 пациентов), на срок 12 месяцев у 20% (6 наблюдаемых). Более длительная ремиссия до 18–20 месяцев наблюдалась у остальных 16 пациентов, получавших Галавит.
Важно отметить, что у больных на фоне приема Галавита исчезали симптомы интоксикации: слабость, «летучие» боли в суставах, зуд кожи, бессонница.
Таким образом, проведенные клинические наблюдения и иммунологические исследования показали выраженное иммуномодулирующее действие Галавита на гуморальный и клеточный иммунный ответ. Кроме того, Галавит обладает нейропротекторным действием, нормализуя работу вегетативной нервной системы, координируя нервную и иммунную системы.
Наиболее мощным фактором, способствующим развитию и поддержанию болезней пародонта, является развитие дисбиоза в полости рта, который развивается на фоне сниженного иммунитета, или сам приводит к его изменению. Дисбиотические изменения протекают часто на фоне вторичного иммунодефицита
Воспалительные поражения пародонта возникают в результате сложного взаимодействия бактериальной инфекции и ответной реакции организма. Системные факторы и факторы внешней среды, способствующие их развитию, могут влиять и на течение процессов. Для пародонтита характерен комплекс патологических изменений, в основе которых лежат неуклонно прогрессирующее и волнообразно текущее хроническое воспаление, распространяющееся из десны на нижние отделы пародонта, и связанные с ним деструктивные процессы. Таким образом, при пародонтите, как правило, обнаруживается картина сопутствующего ему гингивита, органично входящего в комплекс патологических изменений, характерных для развившихся форм воспалительных заболеваний пародонта.
Развитие хронического пародонтита сопровождается существенными изменениями состояния иммунных механизмов защиты ротовой полости, проявляющимися в местных изменениях состава клеток крови десны (в том числе количественного соотношения популяций и субпопуляций лимфоцитов), а также содержания в слюне иммуноглобулинов и цитокинов. Данные изменения варьируют в зависимости от степени повреждения пародонта и отражают процессы местного воспаления и активации иммунных механизмов защиты. Ингибирование иммунных реакций сопровождается хронизацией патологического процесса и потерей зубов, ведущую роль в патогенезе играет дисбаланс местных иммунных реакций.
Иммунологические исследования пациентов с тяжелыми формами генерализованного пародонтита показали, что в общем изолированный патологический процесс сопровождался существенными изменениями Т- и В-звеньев иммунитета. При хроническом генерализованном пародонтите в тканях пародонта развивается поликлональная активация В-лимфоцитов, что привлекает в зону поражения нейтрофильные лейкоциты. Последнее, в условиях активации В-лимфоцитов приводит к неадекватному ответу на присутствие патогенных микроорганизмов.
Снижение функциональной активности авангардной линии антимикробной защиты, представленной нейтрофильными гранулоцитами и макрофагами, способствует пролонгированию течения и хроиизации процесса.
Хронические воспалительные заболевания пародонта развиваются на фоне подавленных механизмов фагоцитарной защиты, при этом характер местной иммунной реакции в зависимости от степени тяжести процесса существенно не различается. У одного и того же пациента выраженность воспалительного процесса в пародонте может колебаться от катарального гингивита до легкой или тяжелой форм пародонтита.
Современные открытия в области расшифровки механизмов естественного и адаптивного иммунитета на наноуровне позволили изучить роль образ-распознающих рецепторов эпителиальных клеток (pattern recognition receptors), идентифицирующих молекулярный образ микроорганизмов, запускающих активацию про- и противовоспалительных цитокиновых каскадов. Так, у больных с хроническим генерализованным пародонтитом в десневой жидкости наблю-. дается- увеличение содержания как про-, так и противовоспалительных медиаторов с наличием признаков ПтД-девиации (снижение уровня INF-y и повышение уровня IL-4). В пародонтальном комплексе у этих пациентов отмечалось выраженное увеличение концентраций Ig классов G, М и А, что, по-видимому, является следствием локальной поликлональной активации В-лимфоцитов. В десневой жидкости больных с хроническим генерализованным пародонтитом установлено повышение уровня цитокинов RANKL, TNF-a, TL-1 и снижение концентрации OPG, ч то может быть причиной активации остеокластов и последующей деструкции костной ткани. В зоне пародонта при этом развивается «нетипичное» для хронического процесса воспаление, характеризующееся повышенным уровнем IL-8 и преобладанием количества нейтрофилов над численностью других форм лейкоцитов.
Опосредованное образ-распознающими рецепторами преодоление эпителиального барьера микробами с формированием хронического очага инфекции возможно при внедрении как патогенной, так и условно-патогенной нормальной микрофлоры, если развивается утрата местной толерантности к ней. Известно, что интактный пародонт представляет собой достаточно эффективный барьер для бактерий. Инвазии пародонтопатоге-нов препятствует соединительнотканный эпителий и комплекс иммунных факторов защиты. В тех случаях, когда общая масса бактерий или вирулентность некоторых их видов достигает определенного критического уровня, происходит их внедрение в ткани пародонта. Возможно, этому способствует травма пародонта, а также сбои в иммунной системе.
В процессе инвазии бактерии могут вырабатывать соединения, ингибирующие или полностью блокирующие активность защитных сил. Инвазия бактерий приводит к гибели тканей и образованию микроабсцессов. Гистологически, в коронковой части пародонтального кармана внедрившиеся бактерии окружены мощными инфильтратами плазматических клеток, защищающими нижележащие ткани от инфекции. Уничтожение бактерий, внедрившихся в клетки и ткани пародонта, осуществляется посредством клеток фагоцитарной и лимфоцито-макрофаговой систем. Эти системы сами по себе обладают большим деструктивным потенциалом и могут стать причиной нарушения тканей пародонта вследствие дегрануляции и выработки цитокинов.
Иммунный ответ организма на присутствие пародонтопатогенов основан на взаимодействии нескольких систем: слизисто-секреторной, нейтрофильной, гуморальной, комплементарной и иммунорегуляторной. Предполагают, что основным механизмом слизисто-секреторной системы защиты является препятствие прикреплению на поверхности клеток адгезивных элементов пародонтопатогенов. Микроорганизмы с более активной адгезивной системой, например, трепонемы, прикрепляются к поверхностной мембране эпителиальных клеток. Другие микробы, отторгнутые защитной системой, прикрепляются к трепонеме и продолжают колонизацию.
Бактерицидные свойства слюны предотвращает развитие патогенной микрофлоры зубного налета, ведущего этиологического фактора заболеваний пародонта. Доказательством участия слизистосекреторной системы в защите от инвазии пародонтопатогенов являются фактические данные об увеличении содержания секреторного иммуноглобулина А (slgA) в слюне у больных пародонтитом. Однако эти данные противоречивы. Так, Орехова Л.Ю. с соавт. (2001) обнаружили снижение уровня секреторного иммуноглобулина в ротовой жидкости при пародонтитах.
Барер Г.М., Лемецкая Т.И. (1996) выявили повышенный уровень иммуноглобулинов основных классов вследствие их местного синтеза в воспаленной десне, а также транссудации из пораженных тканей с последующим поступлением десневой жидкости в смешанную слюну. В крови больных с данной‘Патологией снижается концентрация Ig А, М, G. По данным А.А. Кунина с соавт. (2001) при хроническом генерализованном пародонтите в стадии обострения содержание в ротовой жидкости Ig А, Е, G и лизоцима повышено, в то же время содержание slgA понижено, появляются следы Ig М. В десневой жидкости значительно увеличено количество макрофагов, нейтрофилов, лимфоцитов и эпителиоцитов. При этом в три раза снижена функциональная активность Т-лимфоцитов капиллярной крови десны.
Таким образом, хронический гингивит и пародонтит представляют собой многокомпонентные процессы, ключевыми из которых, с одной стороны, являются воспалительно-инфильтративные и деструктивные, а с другой стороны — компенсаторные. Ремиссия, которая наступает самостоятельно либо достигается проведением эффективного лечения, есть результат мобилизации и компенсаторной перестройки тканевых систем пародонта с их выведением на новый уровень гомеостаза. Наиболее мощным фактором, способствующим развитию и поддержанию болезней пародонта, является развитие дисбиоза в полости рта, который развивается или на фоне сниженного иммунитета, или сам приводит к его изменению.
Существует также механическая теория, которая позволяет по-новому взглянуть на патогенез воспалительного процесса в тканях пародонта. Весьма существенными явились результаты изучения изменений в системе иммунитета при длительной гиподинамии. Было обнаружено снижение способности лимфоцитов к активации и пролиферации, что повышает степень риска развития инфекционного процесса. Хорошо известно, что в полости рта лимфоциты относят к факторам местной защиты. Они мигрируют из лимфоидной ткани глоточного кольца и крови, через стенки микрососудов, обильно кровоснабжающих ткани десны. При длительной гипокинезии количество функционирующих микрососудов значительно уменьшается. Для тканей пародонта очень важно, что уменьшение кровоснабжения снижает уровень миграции клеток крови в десневую и ротовую жидкости. Это-касается также и сывороточных иммуноглобулинов, и компонентов комплементов, являющихся гуморальными факторами местной защиты тканей полости рта.
Можно представить, что снижение активности лимфоцитов влечет за собой уменьшение продуцирования секреторного иммуноглобулина IgA плазматическими клетками, образующимися из местных В-лимфоцитов в слизистой оболочке десны. Снижение же способности лимфоцитов к пролиферации, ведет к уменьшению связанных с ними иммуноглобулинов, что в свою очередь ослабляет защитные реакции в тканях пародонта. Становится понятным, что именно снижением активности лимфоцитов по причине регионарной гиподинамии и гипокинезии можно объяснить тот факт, что защитная реакция в пародонте начинается не с активации лимфоцитов антигенами микробов зубной бляшки, а с нейтрофильного хемотаксиса — увеличения числа нейтрофилов в зубодесневой борозде.
Для понимания механизмов развития деструктивных процессов в пародонте чрезвычайно важным явилось обнаружение при изучении иммунной системы в условиях гипокинезии достоверного увеличения продукции лимфоцитами остеокластактивирующего фактора, который вызывает потерю Са костной тканью. Совершенно очевидно также, что снижение интенсивности жевательной функции сопровождается снижением уровня саливации, что в свою очередь, ослабляет естественную резистентность тканей полости рта (в частности за счет таких факторов, как лизоцим, муцин и пр.). С уменьшением, саливации страдает и такой путь, снижения количества микроорганизмов в полости рта, как смыв их ротовой жидкостью.
Все вместе взятое благоприятствует микробной агрессии в полости рта и развитию воспаления в тканях пародонта, которые имеют наибольший контакт со скоплением микробов в зубной бляшке. Для развития воспаления в пародонте не менее важным является то, что гиподинамия способствует нарастанию устойчивости патогенных микробов к антибиотикам и возникновению аутоинфекции, а также сенсибилизации аллергенами аутомикрофлоры. Последнее, как установлено, вызывает потерю костной ткани в пародонте.
Благодаря изучению проблем гипокинезии и гиподинамии, стало очевидным, что малоподвижный образ жизни, который ведет человек в нашем столетии, отрицательно сказывается на состоянии его иммунной системы и сопротивляемости микробным инфекциям. Следует полагать, что это усугубляет последствия снижения факторов местной защиты полости рта, связанные с регионарной гиподинамией и гипокинезией (гипофункцией) в жевательной системе. Дополнением к этому являются многочисленные соматические заболевания, которые еще больше ослабляют иммунные силы организма и приводят в своем патогенезе к убыли костной ткани.
Таким образом, хронические очаги инфекции в полости рта вносят существенный вклад в развитие иммунологических дисбалансов, постоянно отвлекая на себя иммунологические ресурсы организма и истощая общий потенциал противоинфекционной защиты, что множит число вновь возникающих инфекционных очагов и хронизирует их. С другой стороны, полость рта у этих больных становится постоянно существующим источником распространения инфекции в нижележащие органы, а также лимфогенно и гематогенно по всему организму. Персистирующий антигенный инфекционный стимул неизбежно обусловливает аллергическую сенсибилизацию организма, что еще более грубо нарушает равновесие иммунной системы»больных, оказывая на нее угнетающее и дезорганизующее влияние.

Приглашаем подписаться на наш канал в Яндекс Дзен

Изучение микробиологических аспектов этиологии и патогенеза болезней пародонта является актуальной проблемой стоматологии. Обоснование роли определенных видов микроорганизмов в развитии патологического процесса, определение условий и механизмов реализации неповреждающего действия открывают новые перспективы для профилактики и лечения данных заболеваний. Уже установлена ведущая роль стрептококков в возникновении кариозных повреждений эмали зубов, а также значение отдельных сероваров Streptococcus mutans в этом процессе [1]. Продолжается выяснение влияния инфекционного фактора на этиологию и других форм патологических процессов в полости рта.
В полости рта местные микроорганизмы часто ассоциируются с этиологией двух широко распространенных патологических процессов - кариес и перидонтальные заболевания. Оральная патология, как правило, развивается после нарушения сбалансированного состояния среди местной микрофлоры, что приводит к появлению потенциально патогенных микроорганизмов [2].
В полости рта существующая важная среда обеспечивает относительно стабильную температуру (от 34º до 36 ºС) и рН ближе к нейтральной в большинстве участков, таким образом, поддерживается рост широкого разнообразия микроорганизмов. Вместе с тем ротовую полость нельзя рассматривать как однообразную среду. В ней можно определить несколько участков - мест для обитания микроорганизмов, каждое из которых характеризуется разнообразными физико-химическими факторами и таким образом поддерживает рост и развитие разной микробной общины. Это происходит частично из-за большого анатомического разнообразия полости рта, а также взаимосвязи между разными анатомическими структурами [3, 4].
Оральная микрофлора у людей весьма сложная и разнообразная. Она включает более чем 300 бактериальных видов, к которым можно добавить Protozoa, грибы, а также микоплазмы и актиномицеты. Их распространение меняется качественно и количественно в зависимости от их местообитания [5].
Как известно, количественный критерий имеет важное значение при установлении возбудителя инфекционного процесса. Возрастание доли определенного вида среди остальных микроорганизмов в течение заболевания, а также доминирование его в популяции, населяющей очаг поражения, может косвенно свидетельствовать об этиологической роли данного вида [6, 7]. У здоровых людей десневая бороздка содержит ограниченное количество матрикса зубной бляшки. Более 30% всей культивируемой микрофлоры такой бляшки составляют грамположительные палочки. Около 90% из них - это представители актиномицетов (Actinomyces viscosus, A.naeslundii, A.israelli) [1]. Прекращение гигиенического ухода за полостью рта ведет к накоплению матрикса бляшки. Это сопровождается, с одной стороны, развитием гингивита, а с другой - возрастанием доли актиномицетов, которые постепенно становятся доминирующей флорой. В зрелой, ненарушенной зубной бляшке актиномицеты составляют примерно половину всех микроорганизмов: A.viscosus и A.naeslundii - 38,4 %, A.israelli - 10 %, A.odontolyticus - 3,5 % [1].
На модели экспериментального гингивита показано, что количество A.viscosus и A. israelli увеличивается параллельно с нарастанием интенсивности воспаления десен. Другими исследователями также отмечена прямая корреляция между выраженностью клинических симптомов гингивита и содержанием A.viscosus в материале зубной бляшки.
При микробиологическом исследовании десневой жидкости и зубной бляшки у больных пародонтитом определено, что численность популяции A.viscosus и Rothia dentocariosa в области поражения оказалась больше, чем в непораженных участках. На преобладание актиномицетов в зубной бляшке при пародонтите указывают, в то время как другие авторы наблюдали высокое содержание R.dentocariosa, A.naeslundii, A.viscosus лишь у больных с минимальной активностью процесса.
Другая форма патологии органов рта, при которой доминируют актиномицеты - пришеечный кариес. В таких кариозных поражениях обнаружено более 50% A.viscosus, A.naeslundii, A.odontolyticus.
Поверхность слизистой полости рта омывается стабильно двумя важными физиологическими жидкостями - слюна и жидкость гингивальной щели. Они существенно важны для поддержания экосистемы оральной полости, обеспечивая ее при этом водой, питательными веществами, адгезией микроорганизмов, а также антимикробными факторами. Супрагингивальная среда промывается слюной, в то время сабгингивальный регион (гингивальная щель) промывается в основном жидкостью гингивальной щели [5].
В настоящей работе рассматривается вопрос о патологическом значении ферментирующих актиномицетов, а также микробиологические и иммунологические аспекты при пародонтите и гингивите с антиномикотической этиологией.
Материал и методы
Микробиологические исследования патологического материала проводились на кафедре микробиологии и иммунологии АМУ. Проведено микробиологическое исследование мазков ротовой полости больных пародонтитом и гингивитом. В ходе работы 139 больных, проходивших обследование и лечение в стоматологической поликлинике АМУ, были разделены на 2 группы. 1 группу составили 56 больных пародонтитом, 2 группу - 83 больных с гингивитом. А также каждая группа была разделена на две подгруппы: «а» - с актиномикотической этиологической, «b» - больные, у которых этиологическим аспектом служили другие микроорганизмы (бактерии и грибы).
Материалом для исследования служили мазки из ротовой полости, материалы пародонтального кармана зубов и из гингивиальной щели. Параллельно приготовлениям мазков образец поместили в 5 м транспортную среду (0,06 % обогащенную тиогликолевую среду), морфологические и тинктональные свойства изучали при окрашивании препаратов по Грамму, Цилью Нельсону и Романовскому Гимзе.
Для выделения культур Actinomyces в качестве плотной среды использовали тиогликолевую, крахмаламмиачную, а также среду Сабуро, кровяной агар.
Инкубации при 35-37 ºС проводили в анаэробных и аэробных условиях в течение 15 дней. Исследовали морфологические, культуральные, физиологические и биохимические свойства выделенных изолятов по общепринятому методу. Колонии изучали при помощи лупы и микроскопа.
Концентрацию иммуноглобулинов классов А, М, G провоспалительных цитокинов (TNFα, IL-1) в сыворотке крови, а также уровня sIgA в слюне определяли методом твердофазного иммуноферментного анализа. Для изучения количества субпопуляции Т-лимфоцитов (СD3, СD4, СD8), а также CD22 в крови был использован коммерческий тест-набор, «колоноспектр», предназначенный для определения дифференцированных антигенов лейкоцитов человека методом «иммуноперексидазного окрашивания клеток».
Результаты и обсуждение
В результате бактериологического и бактериоскопического анализа больных гингивитом и пародонтитом был выявлен актиномицет в ассоциации с другими микроорганизмами. У больных пародонтитом (50 человек) у 23 (46%) были выделены актиномицеты в ассоциации с другими микроорганизмами, у 27 (54,0%) были выделены лишь другие микроорганизмы. У больных гингивитом (83 человека) у 33 (40%) были выделены актиномицеты в ассоциации с другими микроорганизмами, а у 50 (60%) только другие микроорганизмы. При пародонтите часто выделены Act.odontolyticus, Act.viscosus, Act.israelii, Act.eriocsonii, Act.albicans, Act.nauslandii, Act.spp. А при гингивите были выделены актиномицеты - Act.odontolyticus, Act.viscosus, Act.israelii, Act.eriocsonii. Все эти актиномицеты были выделены в ассоциации с аэробными и анаэробными микроорганизмами.
При пародонтите были выделены следующие микроорганизмы: S.aureus, α гемолитические стрептококки, E.coli, C.albicans, A.actinomycetimocomitans, Fuzabacterium spp., грамположительные анаэробные кокки, бактероиды. А при гингивите актиномицеты были выделены в ассоциации с аэробными бактериями - S.aureus, α гемолитические стрептококки, Neisseria spp., C.albicans, Micrococcus spp., A.actinomycetemcomitans, из анаэробных - грамположительные анаэробные кокки, Porphyromonos qinqivalis.
Исходя из этих данных, можно предположить, что при возникновении таких болезней, как гингивит и пародонтит ротовой полости, значительную роль играют актиномицеты и так называемые «сопутствующие микроорганизмы» (бактерии и грибы), и они создают локальные условия для патологического процесса [6]. Поэтому необходимо изолировать и идентифицировать выделенные актиномицеты, а также другие микроорганизмы из очагов актиномикотических поражений. Развитие актиномикоза следует рассматривать как проявление аутоинфекции, которая возникает и прогрессирует на фоне гнойно-воспалительных заболеваний, травм, иммунодефицитных состояний. В ряде случаев для возникновения заболевания необходимо наличие гиперсенсибилизации или ассоциации с другими бактериями, обитающими в организме (микст инфекция) [8, 9]. При этом сопутствующая микрофлора значительно усугубляет тяжесть поражения и нередко способствует ошибкам при лабораторной диагностике заболевания, поскольку актиномицеты часто при микроскопическом исследовании не выявляются, а на питательных средах их видимый рост проявляется намного позже (на 7-14 день) сопутствующей микрофлоры, к тому же в зависимости от вида актиномицетов для их культивирования необходимы аэробные или анаэробные условия, что не всегда учитывается в практике врачей. Необходимо отметить, что при воспалительных заболеваниях пародонта наряду с увеличением количества актиномицетов наблюдается изменение морфологии этих бактерий. В частности, зубная бляшка здоровых людей представлена палочко- и кокковидными бактериями, а у больных гингивитом, пародонтитом она содержит плотные агрегаты нитевидных грамположительных бактерий.
В дальнейших исследованиях были проанализированы сравнительные показатели иммунной системы у больных пародонтитом и гингивитом актиномикотической этиологии, а также без нее.
У больных пародонтитом (IgA - 1,70±0,09 мг/ мл, IgM - 1,5±0,01 мг/ мл, IgG - 13,8±0,09 мг/ мл) и гингивитом (IgA - 1,25±0,1 мг/мл, IgM - 0,98±0,01 мг/ мл, IgG - 6,0±0,1 мг/мл) с актиномикотической этиологией анализ средних уровней иммуноглобулинов в сыворотке крови показал достоверное понижение, чем у больных, у которых этиологическим агентом служили другие бактерии и грибы (пародонтиты: IgA - 8,77±0,1 мг/ мл, IgM - 3,91±0,2 мг/мл, IgG - 23,7±0,04 мг/ мл; гингивиты: IgA - 2,72±0,02 мг/мл, IgM - 1,7±0,01 мг/мл, IgG - 12,7±0,02 мг/мл). А концентрация sIgA у больных с актиномикотическкой этиологией была заметно понижена (пародонтит - 56,4±10,1 мг/ мл, гингивит - 45,3±9,1 мг/мл) по сравнению с нормой, а также у больных, у которых выделены другие микроорганизмы, так как в норме уровень sIgA составляет 207,5±92,2 мг/мл.
У больных пародонтитом и гингивитом, у которых заболевания вызваны актиномицетами в сочетании с другими микроорганизмами, в уровне цитокинов в сыворотке крови отмечалось незначительное увеличение (у больных гингивитом: TNFα - 77,3±3,5, IL-1 - 78,4±3,3; у больных пародонтитом: TNFα - 71,8±6,3, IL-1 - 72,3±7,5). Можно полагать, что отмеченные изменения в концентрации цитокинов обусловлены у больных с остротой воспалительных процессов. По всей вероятности, как пародонтиту, так и гингивиту, обусловленным актиномицетами в ассоциации с другими микроорганизмами, свойственно было хроническое течение заболевания. Напротив, у больных пародонтитом и гингивитом, вызванным другими микроорганизмами, воспалительный процесс (как гнойный, так и без него) протекал остро, что сказывалось на содержании провоспалительных цитокинов (у больных гингивитом: TNFα - 102,5±10,4, IL-1 - 106,5±10,7; у больных пародонтитом: TNFα - 169,6±13,0, IL-1 - 236,8±11,5).
Результаты количественного определения субпопуляции Т-лимфоцитов показали, что содержание CD3 (у больных гингивитом - 48,2±10,0%, у больных пародонтитом - 38,6±8,3%), CD4 (гингивит - 29,9±7,5%, пародонтит - 27,3±7,0%), CD8 (гингивит - 21,0±5,9%, пародонтит - 14,5±3,5%), а также CD22 (гингивит - 9,5±3,1%, пародонтит - 4,5±1,1%) у всех больных с актиномикотической этиологией, были снижены по сравнению с лицами контрольной группы (CD3 - 65,5%, CD4 - 38,5%, CD8 - 29,5%, CD22 - 12,8%) (р
Полость рта человека населяют разные по видовому составу сообщества микроорганизмов. В их число входят как нормальная флора, так и условно-патогенные микроорганизмы, которые могут являться этиологическими агентами пародонтита. Количественное и качественное выявление ДНК основных пародонтопатогенов позволяет оценить степень дисбиотических нарушений микрофлоры ротовой полости, назначить адекватную терапию и оценить эффективность лечения.
Важная роль микробного фактора в этиологии и патогенезе воспалительных заболеваний пародонта определяет актуальность исследований в этом направлении.
Полость рта можно отнести к одному из идеальных для обитания микроорганизмов биотопов организма человека. Этот биотоп подразделяется на ряд суббиотопов с учетом анатомического строения и других особенностей отделов полости рта: десневую бороздку, язык, пародонтальный карман. Видовой состав микрофлоры этих суббиотопов напрямую зависит как от местных факторов защиты, так и от общих. К местным факторам можно отнести слюну и механизмы резистентности самой слизистой оболочки: фагоцитоз, выработка макрофагами и другими клетками биологически активных веществ, цитокинов.
Нормальная микрофлора ротовой полости играет не последнюю роль в защите организма человека от заболеваний. Практически у любого человека в полости рта, кроме ее естественных обитателей (нормофлоры, представленной лакто- и бифидобактериями), выявляются условно-патогенные и патогенные микроорганизмы.
Нарушение количественных соотношений между нормальной и условно-патогенной флорой приводит к развитию дисбиотических состояний и характеризуется снижением количества лакто- и бифидобактерий и ростом условно-патогенных микроорганизмов.
При пародонтите всегда имеют место дисбиотические нарушения. Доказано, что развитие пародонтита наиболее часто ассоциируется с увеличением количества и персистенцией в тканях пародонта Prevotella intermedia, Tannerella forsythensis, Treponema denticola, Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis.
Основная трудность выявления указанных патогенов связана с проблемой культивирования анаэробных микроорганизмов и количественной оценкой результатов. Современные бактериологические лаборатории не всегда располагают необходимым оборудованием и питательными средами для культивирования облигатно-анаэробных микроорганизмов. В настоящее время в научных и практических исследованиях в области диагностики инфекционных заболеваний широкое распространение получил метод полимеразной цепной реакции (ПЦР). Использование ПЦР в реальном времени позволяет точно анализировать состав микрофлоры в десневой жидкости, зубной бляшке, слюне, выявляя ДНК искомых микроорганизмов в сложной смеси нуклеиновых кислот, а определение количества микроорганизмов обеспечивает возможность динамического наблюдения, что помогает адекватному выбору этиотропной терапии и оценке ее эффективности.
Целью настоящего исследования явилось выявление патогенных микроорганизмов в разных суббиотопах полости рта у больных пародонтитом и здоровых лиц методом ПЦР в реальном времени.
Материал и методы
ПЦР-диагностика десневой жидкости, зубных отложений, слюны проведена у 34 больных пародонтитом (20 женщин и 14 мужчин в возрасте от 27 до 65 лет) и 39 здоровых лиц (20 женщин и 19 мужчин в возрасте от 27 до 65 лет). Последние считали себя практически здоровыми, не имеющими сопутствующей патологии, полость рта у них была санирована, в тканях пародонта отсутствовали воспалительные изменения.
В группу больных пародонтитом вошли пациенты, не имевшие тяжелой фоновой патологии внутренних органов и систем, которая могла бы оказать заметное влияние на течение патологического процесса в пародонте. 62% из них обратились за помощью впервые, а 38% ранее лечились, за помощью обращались 1 раз в год. В зависимости от степени тяжести хронического генерализованного пародонтита их подразделили на 3 группы: с легкой степенью заболевания — 8 (23,5%) человек; со средней — 12 (35,3%); с тяжелым течением заболевания — 14 (41,2%).
Десневую жидкость для исследования отбирали с помощью стерильных бумажных полосок размером 0,3—0,8 мм,
одновременно в пробирку собирали слюну и стерильным ершиком снимали зубной налет.
ДНК для выявления микроорганизмов выделяли по методике «Проба-ГС» (ООО «НПО ДНК-Технология», Россия) согласно прилагаемой инструкции. Метод основан на сорбции ДНК на органическом носителе, отмывке примесей с последующей элюцией нуклеиновых кислот с сорбента. ПЦР и определение температуры плавления олигонуклеотидных проб проводили с помощью детектирующего амплификатора «ДТ-96» (ООО «НПО ДНК-Технология»). Для оценки результатов использовали программное обеспечение, прилагающееся к детектирующему амплификатору «ДТ-96».
Для постановки ПЦР в реальном времени использовали реагенты ООО «НПО ДНК-Технология» согласно инструкции производителя.
После амплификации по показателю индикаторного цикла (Ct) рассчитывали количество ДНК исследуемого инфекционного агента. Для исключения ложноотрицательных результатов учитывали показатель амплификации геномной ДНК человека (контроль взятия биологического материала).
Результаты и обсуждение
Полученные данные представлены в табл. 1—4.
Таблица 1. Данные о микроорганизмах у больных пародонтитом легкой степени в разных биотопах полости рта (n=8)

Таблица 2. Данные о микроорганизмах у больных пародонтитом средней тяжести в разных биотопах полости рта (n=16)

Таблица 3. Данные о микроорганизмах у больных пародонтитом тяжелой степени в разных биотопах полости рта (n=10)
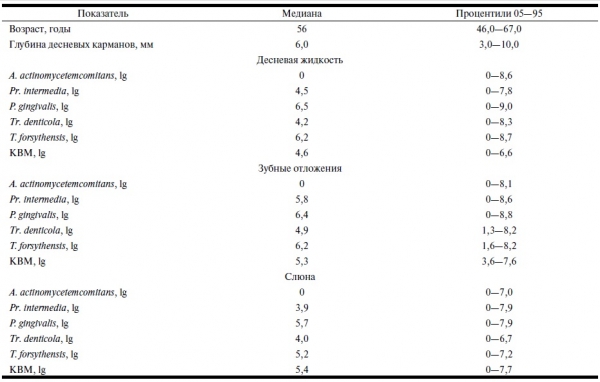
Таблица 4. Показатели у лиц со здоровым пародонтом (n=39)

Как видно из табл. 4, у здоровых людей в исследуемых средах — слюне, десневой жидкости, зубной бляшке — изучаемые микроорганизмы обнаруживали в единичных случаях. У больных пародонтитом в десневой жидкости, зубных отложениях и слюне отмечали повышение количества Pr. intermedia, P. gingivalis, T. forsythensis, Tr. denticola. Микроорганизм A. actinomycetemcomitans выявляли в единичных случаях. Количество P. gingivalis зависело от степени тяжести заболевания, у больных с тяжелым течением заболевания этот показатель был больше.
У большинства пациентов со здоровым пародонтом исследуемых микроорганизмов в десневой жидкости не
выявлялось, в зубных отложениях и слюне обнаруживали T. forsythensis в незначительных количествах.
В группе здоровых лиц в отдельных случаях наибольшее количество микроорганизмов обнаруживалось в зубных отложениях, но и в них их количество не превышало 10 в 6,4 степени ГЭ/образец (для T. forsythensis); других микроорганизмов было еще меньше.
В группе пациентов с пародонтитом легкой степени у большинства обследованных в десневой жидкости выявляли 3 микроорганизма: P. gingivalis (медиана — 10 в 4,4 ГЭ/образец), T. forsythensis (10 в 5,4 степени) и T. denticola (10 в 4,8 степени). В зубных отложениях и слюне были отмечены все микроорганизмы, кроме A. actinomycetemcomitans.
В зубных отложениях пациентов с пародонтитом средней степени тяжести выявлялись все 5 микроорганизмов, тогда как в десневой жидкости и слюне не обнаруживалось A. actinomycetemcomitans.
Самым высоким количество патогенных микроорганизмов у больных пародонтитом было в десневой жидкости и зубных отложениях (до 10 в 8 — 10 в 9 ГЭ/образец), в слюне оно было на 1—2 порядка ниже.
Группы здоровых лиц и больных со средней и тяжелой степенями пародонтита статистически значимо различались по количеству выявленных микроорганизмов. Здоровые и больные с легкой и средней степенями тяжести заболевания различались по количеству всех видов микроорганизмов в десневой жидкости; в зубных отложениях статистически значимо различались количества Pr.intermedia (р=0,0001), P. gingivalis (р=2,8х10 в —7 степени), T. forsythensis (p=l,6х10 в —6 степени) и Tr. denticola (p=3х10 в —5 степени), в слюне — P. gingivalis (p=0,0003) и T. forsythensis (p=0,01). Группа больных с тяжелой степенью пародонтита по исследуемым показателям статистически значимо отличалась от группы здоровых лиц по количеству всех выявляемых микроорганизмов в десневой жидкости и зубных отложениях, а в слюне были найдены достоверные различия между группами только по количеству P. gingivalis (р=8х10 в —5 степени), T. forsythensis (р=0,003) и Tr. denticola (р=1,6х10 в —4 степени). Таким образом, в качестве материала для исследования по 5 основным пародонтопатогенам наиболее репрезентативными являются зубные отложения и десневая жидкость.
На рис. 1 и 2 представлено количество микроорганизмов через 1 мес после лечения: снятие зубных отложений, противовоспалительная терапия, хирургический кюретаж.
Рис. 1. Количество выявляемых микроорганизмов у больных пародонтитом через 1 мес после лечения (десневая жидкость).
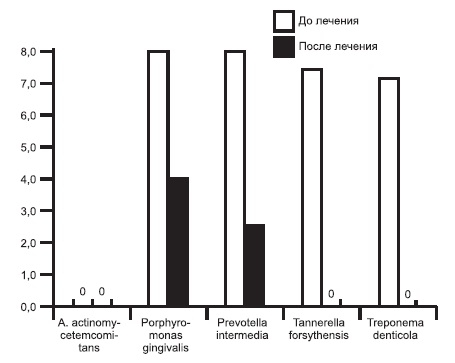
Рис. 2. Количество выявляемых микроорганизмов у больных пародонтитом через 1 мес после лечения (зубные отложения).

Исследованием установлены различия в снижении уровня микроорганизмов. В десневой жидкости после лечения выявлялась Tr. denticola, а в зубных отложениях — Pr. intermedia и P. gingivalis.
Полученные нами данные доказывают участие микроорганизмов зубной бляшки и других суббиотопов полости рта в развитии воспалительных заболеваний пародонта. Данная патология развивается на фоне изменения количества и качественного состава микрофлоры полости рта, что приводит к появлению и размножению условно-патогенной микрофлоры, вызывающей воспаление в пародонте.
Группы здоровых и больных достоверно различались по количеству 5 основных пародонтопатогенных микроорганизмов. По-видимому, для развития воспалительных заболеваний пародонта принципиальным является не только количество каждого конкретного условно-патогенного микроорганизма, но и число видов, принимающих участие в развитии патологического процесса. В качестве материала для исследования предпочтительны зубные отложения и десневая жидкость.
ПЦР с детекцией результатов в режиме реального времени — достаточно точный метод изучения количественного и качественного состава пародонтопатогенной микрофлоры ротовой полости. Исследование 5 пародонтопатогенных микроорганизмов в различных суббиотопах ротовой полости целесообразно проводить при выборе терапии и для оценки эффективности проведенного лечения.
Читайте также:

