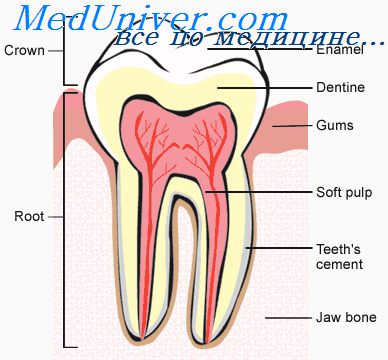
Красный комплекс микроорганизмов пародонта
Опубликовано: 16.04.2024
На основе результатов микробиологических исследований при различных клинических состояниях полости рта, в частности при разных формах поражения пародонта и твердых тканей зубов, были выявлены преимущественные микробные представители и их сочетания. Это позволило составить своего рода классификацию пародонтальных микробных комплексов. Различают красный, зеленый, желтый, пурпурный, оранжевый микробные комплексы.
Красный комплекс (P. gingivalis, B.forsitus, T. denticole). Сочетание этих микроорганизмов отличается особым агрессивным воздействием на пародонт, связанным с вышеперечисленными свойствами P. gingivalis, B.forsitus, T. denticole.
Присутствие этого комплекса обусловливает сильную кровоточивость десен и быстрое течение деструктивных процессов в пародонте.
Зеленый комплекс (Е. corrodent, Capnocytophaga spp., A. actinomycetemcomitans). Основным фактором вирулентности A. actinomycetemcomitans является лейкоток-син, вызывающий лизис нейтрофилов. Это сочетание микробов может явиться причиной как заболеваний пародонта, так и прочих поражений слизистой оболочки рта и твердых тканей зубов.
Желтый комплекс (S. mitis, S. israilis, S. sanguis).
Пурпурный комплекс (V. parvula, A. odontolyticus).
Оранжевый комплекс (P. nigrescen, Prevotella intermedia, P. micros, С. rectus + Campylobacter spp.). Prevotella intermedia продуцирует фосфолипазу А, нарушает целостность мембран эпителиальных клеток, является активным продуцентом гидролитических протеаз, расщепляющих белки пародонтальных тканей и тканевой жидкости на полипептиды, вырабатывает протеолитические ферменты, поэтому играет главную роль в образовании пародонтальных абсцессов.
Эти три комплекса также способны вызывать поражения пародонта и другие заболевания полости рта.
Выделение этих комплексов не означает, что в их состав входят только перечисленные виды микроорганизмов, но именно эти сообщества видов являются наиболее устойчивыми. Доказано, что использование увлажнителей воздуха в помещении значительно снижает интенсивность развития микробных комплексов. Современный увлажнитель воздуха позволяет минимизировать содержание патогенных микроорганизмов в помещении, тем самым тормозит их коллонизацию зубов.
Кстати, возможной причиной устойчивости именно таких микробных сочетаний является их существование в виде вязких биопленок по принципу вышеупомянутого «удобства» их метаболизма, когда продукты, выделяемые одними, являются питательными источниками для других микробов либо обеспечивают их повышенную устойчивость и вирулентность.
Интересно, что перечисленные микробные ассоциации находятся в составе стабильных зубных бляшек, прикрепленных к поверхности зуба или к стенкам пародонтального кармана (ПК). При этом состав свободно расположенных микробных скоплений внутри ПК может быть совсем иным.
Патогенность микробов пародонта
Патогенность — это способность определенных видов микроорганизмов вызывать инфекционные заболевания. Вирулентностью называется степень патогенности определенного штамма, которая изменяется под влиянием внешних воздействий. Патогенность и вирулентность зависят от способности микроорганизма уклоняться от защитных механизмов организма и проявлять агрессивные свойства. Пародонтопатогенные микроорганизмы способны преодолеть защитные механизмы хозяина с помощью синтеза иммунодепрессантов, которые подавляют синтез и активность иммунокомпетентных клеток, лизоцима и комплемента.
Зависимость степени повреждения пародонта от количества микробного налета и времени его сохранения и действия доказана многочисленными эпидемиологическими исследованиями. Одной из причин такой зависимости является возрастное снижение защитных механизмов и повышение восприимчивости тканей человека к действию микробных агентов, а также суммарный повреждающий эффект, увеличивающийся с возрастом.
Однако в ходе этих же исследований были открыты и другие факты, которые не позволяют излишне прямолинейно трактовать исключительное главенство только микроорганизмов. В частности, у некоторых пациентов с плохой гигиеной полости рта воспалительные и деструктивные изменения совсем незначительны. Не у всех лиц с гингивитом с течением времени развивался пародонтит.
Требует своего объяснения и тот факт, что наряду с участками глубокого поражения встречаются интактные ткани, причем не только в разных сегментах зубного ряда, но и в области одного зуба.
Эти наблюдения явились причиной возникновения и формирования двух основных теорий, которые по-разному оценивают связь ВЗП с количеством и характером микробного состава зубного налета.
Известно, что в полости рта выявляют порядка 1200 филотипов, подавляющее большинство которых представляют собой резидентную флору, оказывающую стабилизирующее воздействие для существования общей биопленки полости рта. Ряд видов, будучи также резидентной флорой, стабилизирующими являются только до определенного предела, при превышении которого они проявляют агрессивность и могут принимать участие в воспалительных процессах.
Характеристика пародонтопатогенных бактерий
К пародонтопатогенам на сегодняшний день относят около 20 видов бактерий, относящихся по степени вирулентности к двум подгруппам. К пародонтопатогенам 1-го порядка относятся бактерии, для которых выявлены строгие ассоциации с прогрессированием заболевания, к пародонтопатогенам 2-го порядка — бактерии, играющие второстепенную роль в развитии заболевания пародонта.
К первой подгруппе относят три вида. Это Porphyromonas gingivalis, Aggregatibacter actinomycetemcomitans и Tanerella forsythia. Все эти бактерии являются грамотрицательными анаэробами, облигатными или факультативными. Все имеют выраженную тенденцию к внутриклеточному паразитированию в десневом эпителии и тканях пародонта. Для всех трех бактерий доказана возможность распространения в человеческой популяции по типу экзогенного инфекционного агента.
Наиболее агрессивным пародонтопатогеном является Porphyromonas gingivalis, облигатно анаэробная, пигментообразующая бактерия, экспрессирующая три сильных фактора вирулентности (фимбрии, гингипаины и липополисахарид), непосредственно участвующих в деструкции тканей пародонта.
Ненамного уступает ему в вирулентности Aggregatibacter actinomycetemcomitans, грамотрицательная неподвижная факультативно анаэробная коккобацилла. Эта бактерия вырабатывает сильный лейкотоксин, разрушающий лейкоциты, моноциты и нейтрофилы, таким образом, атакуя факторы врожденного иммунного ответа. Лейкотоксин вызывает образование пор в клеточных мембранах и в высоких концентрациях вызывает лизис клеток, в том числе и опухолевых.
Факторы вирулентности Tanerella forsythia наименее изучены. Известно, что она продуцирует протео- и гликолитические ферменты, активность которых коррелирует с клиническими признаками пародонтита. Наиболее интригующей ее особенностью является способность индуцировать клеточный апоптоз. При добавлении экстракта T. forsythia к HL60 и другим клеточным линиям наступает ряд явлений, характерных для апоптозных процессов (активация каспазы3, образование пор в мембранах митохондрий и др.).
Также внимание исследователей привлекают две бактерии группы пародонтопатогенов второго порядка, Treponema denticola и Prevotella intermedia. По вирулентности они значительно уступают тройке лидеров, однако имеют свои интересные особенности, позволяющие им играть немаловажную роль в развитии пародонтита.
Treponema denticola — это изогнутая спирохета, обладающая самостоятельной подвижностью. Ее особенностью является способность к образованию ассоциаций с другими бактериями, способствуя тем самым распространению воспалительного процесса. Наиболее часто этот вид образует ассоциации с такими пародонтопатогенами, как P. gingivalis и T. forsythia. Присутствие у пациента, помимо других пародонтопатогенов, T.denticola — сигнал того, что процесс из локального может перейти к генерализации.
Prevotella intermedia — неподвижная палочковидная бактерия, обладающая несколькими факторами вирулентности, гораздо более слабыми, чем у пародонтопатогенов первой группы. Однако эта бактерия обладает мощными адгезивными свойствами, позволяющими ей быстро колонизировать участки тканей. Эти микробы первыми колонизируют ротовую полость вначале инфекционного процесса. Если
P. intermedia обнаруживается у пациента как моноинфекция, как правило, это означает самое начало заболевания. Если она обнаруживается с другими пародонтопатогенами, это указывает на прогрессирование заболевания, в то время как при стабилизации процесса она, как правило, отсутствует.
Роль пародонтопатогенных бактерий в развитии различных заболеваний
По всей видимости, роль пародонтопатогенных бактерий значительно шире, чем это представлялось ранее. В многочисленных работах последних лет появились сведения о том, что пародонтопатогены могут принимать участие в развитии многих заболеваний различных органов. Попадают они в кровоток через любые ранки или изъязвления во рту, в том числе при стоматологических манипуляциях. Наиболее часто обнаруживают в различных органах (легких, желудочнокишечном тракте, сердце, мозге) при воспалительных процессах A. actinomycetemcomitans. Показана роль P. gingivalis в развитии атеросклероза. Клетки P. gingivalis обладают способностью связывать эритроциты, и при попадании бактерии в кровоток ее буквально со всех сторон облепляют эритроциты. Бактерия передвигается по сосудам под прикрытием эритроцитов, избегая, таким образом, фагоцитоза. При наличии в сосудах какого-либо препятствия или изгиба бактерия останавливается, эритроциты распадаются и P. gingivalis колонизирует окружающие ткани, участвуя в формировании атеросклеротической бляшки. Помимо P. gingivalis в атеросклеротических бляшках обнаруживают также T. forsythia и P. intermedia. Также появились сообщения об обнаружении P. gingivalis в синовиальной жидкости и синовиальных тканях больных ревматоидным артритом.
Все это позволяет говорить об очень значимой роли пародонтопатогенов в развитии самых различных заболеваний. Таким образом, резко возрастает значимость диагностики пародонтопатогенов и эффективного их лечения.
Виды диагностики пародонтопатогенных бактерий
Основными видами диагностики пародонтопатогенов являются микроскопический, бактериологический или культуральный и молекулярногенетический (в основном это полимеразная цепная реакция, ПЦР). На практике до появления ПЦР применялись микроскопический и культуральный методы. Но микроскопический метод не позволяет определять бактерии до вида, скорее, дает общую характеристику микрофлоры.
До вида же бактерии можно определить культуральным методом. Однако многие пародонтопатогены не культивируются вообще, а там, где культивирование возможно, оно является долгим (от 5 дней до трех недель) и не всегда успешным процессом.
Поэтому в клинической практике диагностика пародонтопатогенов практически не применялась, да и научные исследования были затруднены из-за трудоемкости процесса, вследствие чего до определенного времени эти бактерии были изучены крайне плохо. Но ситуация изменилась с появлением на вооружении исследователей такого метода, как ПЦР. Именно с этого момента по-настоящему начинается изучение биологии этих бактерий, их факторов вирулентности и их роли в развитии заболеваний пародонта и других органов. В клинической же практике, однако, диагностика бактерий и сейчас еще не занимает подобающего ей места. Прежде всего это связано с тем, что долгое время на отечественном рынке не было доступных диагностических наборов. По сути дела, долгое время единственным диагностикумом была немецкая тестсистема «Микродент», определяющая пять вышеуказанных бактерий, однако ее цена делала данный анализ практически недоступным для наших пациентов. Сейчас ситуация меняется, отечественные производители начинают проявлять интерес к данной проблеме.
Коллектив ООО «НПФ «Генлаб» совместно с кафедрой микробиологии МГМСУ разработал и запатентовал ПЦР тест-систему «Мультидент5», определяющую в одном анализе пять пародонтопатогенных бактерий, а именно Porphyromonas gingivalis, Aggregatibacter actinomycetemcomitans, Tanerella forsythia Treponema denticola и Prevotella intermedia.
Данная диагностика позволяет не только быстро идентифицировать пародонтопатогенные бактерии (время анализа — 1 день), но и назначать адекватный курс антибиотикотерапии в зависимости от видов выявленных в анализе микроорганизмов.
красный комплекс – его агрессивное воздействие на пародонт обусловлено патогенным влиянием микроорганизмов Porphiromonas gingivalis, которые выделяют ферменты протеазы gingipains, разрушающие в эндотелии капилляров межклеточные адгезионные молекулы ICAM и интерлейкин-8 (хемокин, обеспечивающий прикрепление к внутренней стенки кровеносных сосудов лейкоцитов, для последующего их выхода из сосудов и продвижения к скоплениям патогенных микроорганизмов и их уничтожения). Gingipains стимулирует выделение брадикинина, подавляет деятельность ПМЯЛ. Porphiromonas gingivalis образует индол, связывает и разрушает фибриноген, секретирует коллагеназу, протеиназы, разрушающие С5 – компонент комплимента, деградацию неспецифических IgA IgG, ускоряют синтез простагландина Е2, провоспалительных цитокинов (IL-1, IL-6, IL-8) в фибробластах десны человека. Treponema denticole и Tannerella forsythia выделяют токсичные трипсиноподобные ферменты, разрушающие основное вещество и коллагеновые стуктуры тканей.
Treponema denticole активирует выработку IL -1, увеличивает проницаемость тканевых мембран для других пародонтопатогенов, повышает коллагенолитическую активность гингивальных фибробластов. Tannerella forsythia при взаимодействии с другими пародонтопатогенами вырабатывает специфические пептидазы, разрушающие тканевые структуры, обеспечивающие прикрепление десны к зубу, прикрепляется к эпителию и выделяет продукты, повреждающие его. Многие пародонтопатогены способны индуцировать апоптоз в различных клетках.
Фузобактерии угнетают бактерицидную активность полиморфноядерных лейкоцитов, снижая их способность к миграции.
Все выше перечисленные микроорганизмы способствуют развитию пародонтита.
зеленый комплекс – E. corrodent, Capnocytophaga spp., A. actinomycetemcommitans. Основным фактором вирулентности последних является лейкотоксин, вызывающй лизис нейтрофилов.Все представители данного комплекса относятся к пародонтопатогенной флоре.
желтый комплекс – S. mitis, S. israilis, S. sanguis.
пурпурный комплекс – V. cparvula, A. odontolyticus
оранжевый комплекс – Р. nigrescen, Prevotella intermedia, P. micros, C. rectus+ Campylobacter spp. Наиболее агрессивны относительно пародонтальных тканей Prevotella intermedia, которая продуцирует фосфолипазу А, нарушает целостность мембран эпителиальных клеток, является активным продуцентом гидролитических протеаз, расщепляющих белки пародонтальных тканей и тканевой жидкости на полипептиды, вырабатывает протеолитические ферменты, играет важную роль в образовании пародонтальных абсцессов.
6. Естественные барьеры защиты полости рта от микробного воздействия:
интактная слизистая оболочка полости рта, в том числе десны – не проницаема для большинства инфекционных агентов.
десквамация эпителиальных клеток – удаляются одновременно бактериальные агенты, эпителиальные клетки вырабатывают антибактериальные белки, которые контролируют рост нормальной микрофлоры.
нормальная флора полости рта – обладая высоким сродством к рецепторам клеток слизистой оболочки, препятствует ее обсеменению болезнетворными бактериями – лактобактерии блокируют рецепторы эпителиоцитов от адгезинов болезнетворных микроорганизмов. Нормальная аутофлора полости рта обладает антагонизмом по отношению к патогенным и условно-патогенным микроорганизмам.
ротовая жидкость, самоочищение зубов в процессе жевания – слюна содержит вещества, которые препятствуют адгезии микроорганизмов на эпителиальные клетки – агглютинины и секреторные иммуноглобулины - IgA, лизоцим разрушает стенки бактерий, лактоферрин связывает железо, ингибируя дыхательные ферменты патогенных бактерий.
метаболический баланс микроорганизмов полости рта и слизистой оболочки – бактерии производят разнообразные белки, ингибирующие синтез и высвобождение воспалительных цитокинов клетками слизистой оболочки. Эти белки считают частью обширной сигнальной системы, существующей между бактериями и эпителиальными клетками на поверхности слизистых оболочек.
7. К неспецифическим факторам защиты относят систему фагоцитов – нейтрофилы и макрофаги. Чтобы быть эффективными, фагоциты должны узнавать место микробной инвазии, покидать кровеносные сосуды и мигрировать в ткани к месту инвазии. Связывание компонента комплемента С5а с поверхностью лейкоцита определяет адгезию лейкоцитов на сосудистом эндотелии вблизи места микробной инвазии.
Моноциты могут оказывать токсическое действие на микроорганизмы, содействовать как воспалительным, так и противовоспалительным процессам, влиять на систему комплемента. Макрофаги обладают высокой фагоцитарной активностью, значительной подвижностью и способностью образовывать токсические метаболиты кислорода, имеют набор мощных гидролитических ферментов. Продуцируют интерлейкин -1, лейкоцитарный пироген, интерфероны, простагландины, тромбоксант-А2, лейкотриены В и С, фибронектин.
Система комплемента – это совокупность сывороточных белков, протеаз, тесно взаимодействующих с фагоцитами. Комплемент активирует фагоцитоз, осуществляя непосредственно или опосредованно через антитела опсонизацию микробов.
Биологические эффекты системы комплемента включают:
цитолиз и бактерицидность
образование анафилотоксинов в виде С3а и С5а
хемотаксическое действие С3а и С5а на нейтрофилы, моноциты и эозинофилы
компоненты комплемента С3b и С5b обеспечивают адгезию, опсонизацию и фагоцитоз.
Вещества белковой природы, участвующие в реакции воспаления, фибринолиза и свертывания крови.
Лизоцим – является важным фактором бактерицидности, предотвращает адгезию бактерий на слизистую полости рта, препятствует выделению вазоактивных веществ, в тканях соединяется с эластином и тем самым предохраняет ткани от повреждения эластазой, активирует секреторный IgA.
Лактоферрин – содержится в специфических гранулах нейтрофилах, играет важную роль в в генерации гидроксильных радикалов из молекулярного кислорода и пероксида водорода, участвует в продукции осторофазных белков: С-реактивного белка, альфа -1 антитрипсина, альфо -1 антихимотрипсина, церулоплазмина, фебриногена, компонентов комплемента (С3 и С9).
Цитокины – группа растворимых гормоноподобных белков, синтезируемых макрофагами, лимфоцитами и другими клетками моноцитарно-макрофагального ряда. Представляют собой сигнальные полипептидные молекулы иммунной системы. Цитокины начинают синтезироваться клетками только при появлении чужеродного агента в организме (пародонтогены). По направленности цитокины делят на провоспалительные и противовоспалительные. Баланс про- и противовоспалительных цитокинов во многом определяет ответную реакцию организма на бактериальную агрессию. К ним относят интерлейкины, интерфероны, факторы некроза опухоли, колониестимулирующие факторы, хемокины, факторы роста. Выполняя важную роль в формировании воспалительной реакции на внедрившуюся микрофлору, цитокины в ходе защиты разрушают ткани пародонта. Процесс запуска цитокинов осуществляется под действием эндотоксинов микроорганизмов.
Система естественных киллеров, не обладающих антигенной специфичностью (Т-киллеры, К – киллеры).

Рубрика: Медицина
Статья просмотрена: 4957 раз
Библиографическое описание:
Волошина, А. А. Значение микробного фактора в развитии и течении воспалительных заболеваний пародонта / А. А. Волошина. — Текст : непосредственный // Молодой ученый. — 2011. — № 1 (24). — С. 248-251. — URL: https://moluch.ru/archive/24/2579/ (дата обращения: 04.04.2021).
Заболевание пародонта занимает одно из первых мест по частоте и распространенности среди стоматологических заболеваний. По данным ВОЗ, основанным по статистике 53 стран мира, в различных возрастных группах заболеваемость гингивитом и пародонтитом достигает 80-100% [1].
Современная отечественная классификация, принятая на заседании Президиума секции пародонтологии Стоматологической Ассоциации России (СТАР) в 2001 г., дает следующие определения и характеристики заболеваний пародонта:
- гингивит-воспаление десны - обусловленное неблагоприятным воздействием местных и общих факторов, которое протекает без нарушения целостности зубодесневого прикрепления и проявления деструктивных изменений в других отделах пародонта.
Формы: катаральный, язвенный, гипертрофический.
Течение: острое, хроническое.
Фазы процесса: обострение, ремиссия.
Распространенность процесса: локализованный (очаговый), генерализованный.
- пародонтит - воспаление тканей пародонта, характеризующееся деструкцией связочного аппарата периодонта и альвеолярной кости.
Течение: хроническое, агрессивное.
Фазы процесса: обострение (абсцедирование), ремиссия.
Степень тяжести определяется по клинико-рентгенологической картине. Основным ее критерием является степень деструкции костной ткани альвеолярного отростка (на практике она определяется по глубине пародонтальных карманов (ПК) в миллиметрах).
Степень тяжести: легкая (ПК не более 4 мм), средняя (ПК 4-6мм), тяжелая (ПК более 6 мм).
Распространенность процесса: локализованный (очаговый), генерализованный.
- пародонтоз - дистрофический процесс, распространяющийся на все структуры пародонта. Его отличительной чертой является отсутствие пародонтальных карманов и воспалительных явлений в десневом крае.
Степень тяжести: легкая, средняя, тяжелая (в зависимости от степени обнажения корней зубов-до 4 мм, 4-6 мм, более 6 мм).
Распространенность процесса: только генерализованный.
- синдромы, проявляющиеся в тканях пародонта - эта группа обозначалась ранее как идиопатические заболевания пародонта с прогрессирующим лизисом кости ( синдром Иценко-Кушинга, Элерса-анлоса, Шедиака-игаши, Дауна, болезнях крови и др.)
Пародонтомы- опухолеподобные процессы в пародонте (фиброматоз десен, пародонтальная киста, эпулис, эозофильная гранулема) [2].
Ранние проявления заболеваний пародонта воспалительного характера регистрируются в возрасте от 10-20 лет, 80% детей страдает гингивитом.
Эпидемиологические исследования населения различных регионов нашей страны свидетельствуют о высокой распространенности воспалительных изменений пародонта в различных возрастных группах (80-100%), например, среди школьников Москвы в возрасте 10 лет гингивит выявлен у 69%, 12 лет - у 77%, 15 лет – у 87% обследованных. Пародонтит средней тяжести выявлен в возрасте 12 лет – у 3%, в 15 лет - у 12%, в 16 лет - у 18% обследованных [3]. При обследовании 4947 детей Риги и других городов Латвии в возрасте от 7 до 14 лет Г.И. Кадникова выявила гингивит. Распределение по нозологическим формам представлено на диаграмме [4].

Диаграмма. Распределение гингивита по нозологическим формам
Выраженные деструктивные изменения в пародонте с вовлечением в процесс костной ткани наиболее часто выявляются у лиц старше 40 лет.
Многими исследователями показана полиэтиологическая природа заболеваний пародонта, причем большая роль в их развитии принадлежит воспалительным реакциям, спровоцированным микрофлорой ротовой полости. В связи с этим исследование микробиологических факторов патогенеза заболеваний пародонта следует признать одной из актуальных проблем современной стоматологии [1].
В состав постоянной микрофлоры полости рта входят представители нескольких групп микроорганизмов: бактерии, грибы, спирохеты, простейшие, вирусы.
Количество бактерий в полости рта по числу видов и содержанию в единицы материала конкурирует с составом желудочно-кишечного тракта. Бактерии в полости рта представлены разнообразными видами кокков, палочек и извитых форм. Содержание микроорганизмов в смешанной слюне составляет от 4 млн. до 5 млрд., в зубном налете – от 10 до 1000 млрд. в 1 г. сухого остатка. Видовой состав микрофлоры полости рта представлен аэробными и анаэробными микроорганизмами. Относительная концентрация аэробных аэробных и факультативных бактерий в 1мл. слюны составляет 10 7 , анаэробных – 10 8 [5].
Среди разных видов бактерий существует метаболизм, способствующий тому, что микроорганизмы на поверхности зуба образуют многокомпонентную биопленку (Рис.1) [6].

Рис. 1. Метабиоз бактерий поддесневого участка
Совершенствование методов диагностики в микробиологии позволили более полно и точно изучить микробный спектр в норме и при патологии. Это дало возможность выявить наиболее патогенные виды микроорганизмов, характерных для того или иного заболевания. Изучением микрофлоры пародонтальных карманов занимались многие авторы. Исследования проводились с помощью фазовой контрастной и темнопольной микроскопии, бактериального культивирования, ферментативных, иммунодиагностических и молекулярных методов. Были выявлены три вида «маркерных» микроорганизмов, присутствие которых в пародонтальных карманах коррелирует с тяжестью или агрессивностью пародонтита. К ним относятся : Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis и Bacteroides forsythus.
В 1996 г. на Всемирном конгрессе по периодонтологии они были строго ассоциированы со статусом пародонтальной болезни и определены как «пародонтальные патогены».
Однако дальнейшие исследования позволили разделить обнаруженные в пародонтальных карманах микроорганизмы уже на шесть основных комплексов- «красный», «оранжевый», «голубой», «зеленый», «желтый», «пурпурный». При этом было доказано, что в пародонтальных карманах по мере углубления процесса грамотрицательные анаэробные микроорганизмы преобладают над другими видами. Было установлено, что наивысшей патогенностью для тканей пародонта обладают представители так называемого «красного комплекса»: Porphyromonas gingivalis , Bacteroides forsytus или Tannerella forsythia , Treponema denticola . «Оранжевый» комплекс также обладает высокой патогенностью. К нему относятся: Campylobacter rectus , Campylobacter showae , Eubacterium nodatum , Fusobacterium nucleatum , Prevotella intermedia , Prevotella nigrescens , Peptostreptococcus micros . «Голубой» комплекс включает в себя представителей рода Actinomyces . В «зеленый» комплекс входят: Actinobacillus actonomycetemcomitans , Capnocytophaga , Campilobacter concisus , Eikenella corrodens . actonomycetemcomitans , Capnocytophaga , Campilobacter concisus , Eikenella corrodens . Пятая, «желтая», группа состоит з стрептококков. В «пурпурную» группу входят Actinomyces odontoliticus и Veilonella parvulla [2] .
Мюллер указал на то, что огромное значение для колонизации микробного пейзажа поддесневого пространства имеют синергизм и антогонизм между пародонтальными патогенами и другими бактериями полости рта. Микрофлора начинает обладать особыми патогенными свойствами, когда действует в ассоциациях. Большинство инфекционных процессов, возникающих в челюстно-лицевой области, носят эндогенный характер. Сам факт возникновения эндогенных инфекций отражает нарушение эволюционно сложившегося баланса между организмом и его микрофлорой, с одной стороны, и нарушением равновесия внутри микробных ассоциаций, с другой.
Т.к. большинство бактерий во всех природных экосистемах существуют в биопленках, сообщества микрооранизмов отличаются особым характером взаимодействия. В частности, они могут быть особо устойчивы к защитной реакции макроорганизма, резистентны к антибиотикам и выносливы в стрессовых для микроорганизмов ситуациях- повышение температуры, кислотности, обезвоживания. Неспорообразующие анаэробы зубодесневых карманов отличаются полиморфизмом, обладаютразличной степенью ферментативной активности. Факторами их патогенности являются: способность к колонизации, наличие капсулы, инактивирующих ферментов, инвазивность, токсигенность, способность к длительному выживанию в организме. Эти факторы способствуют, с одной стороны, проникновению в зараженный организм, а с другой стороны, противодействуют его защитным реакциям [7] .
Анаэробные инфекции развиваются в некротизированной ткани в условиях нарушения кровоснабжения, а также при снижении окислительно-восстановительного потенциала, возникающего вследствие жизнидеятельности аэробов и факультативных анаэробов [8] .
Опираясь на данные проведенных исследований появились основания к использованию на практике противомикробных препаратов местного и общего назначения. Например, препараты группы детергенты: этоний, хлоргексидина биглюконат, роккал, декаметоксин. Они устойчивы в водных растворах, обладают низким поверхностным натяжением. Вследствие денатурации белковых фракций бактерий они оказывают антисептическое, бактерицидное и фунгицидное действие даже на антибиотикорезестентные штаммы микроорганизмов [9].
Биглюконат хлоргексидина (ХГБ) - используют 0,05% раствор, оказывает быстрое и сильное антибактериальное действие в отношении большинства (до 99%) грамположительных и грамотрицательных аэробов и анаэробов, в т.ч. спирохет, спороцидное в отношении спор бактерий (только при высокой температуре), противогрибковое (фунгицидное), в т.ч. в отношении C . albicans , противопротозойное в отношении трихомонад, прочно связывается с поверхностными слоями слизистой оболочкой, поверхностью зубов, антисептический эффект сохраняется в течении 12 часов, не вызывает развития устойчивых штаммов микроорганизмов; сохраняет активность в присутствии крови, физиологических жидкостей и органических жидкостей [10]. Также применяют группу галоидов (хлорамин Б, йодинол, хлорид йода), кислоты и щелочи (натрия тетраборат, натрия гидрокарбонат), производные хиноксалина (диоксидин), производные фторхинолона (пефлоксацин, офлоксацин, ципрофлоксацин, норфлоксацин).
По мере развития воспаления в пародонте происходят глубокие расстройства механизмов регуляции и снижение компенсаторно-приспособительных возможностей системы микроциркуляции. Вслед за сосудистой реакцией активизируется неспецифическая защита: система комплемента и фагоцитоз; в зоне повреждения увеличивается количество нейтрофилов и эозинофилов. Однако возбудители инфекционного воспаления противодействуют защитным механизмам организма хозяина. Происходят разнообразные мутации, чтобы избежать фагоцитоза. Все эти эффекты затягивают течение воспаления, способствует его хронизации и не позволяют уничтожить флогогенный агент. На повреждающее действие микробов организм также отвечает комплексом реакций защиты и поддержания гомеостаза. Иммунная защита в тканях пародонта не ограничивается врожденными механизмами иммунитета, а переходит к адаптивным иммунным реакциями с участием антител и экспансией клонально-специфических лимфоцитов. Однако именно система иммунобиологического надзора является одним из ключевых звеньев патогенеза хронического воспалительного процесса в пародонте [2]. Обладая свойствами антигенов, микроорганизмы при участии местных антигенов, представляющих макрофагальные клетки полости рта, сенсебилизируют лимфоциты MALT -системы. Клоны, специфичные по отношению к антигенам микробов, экспансируют и осуществляют в полости рта иммунный ответ против возбудителей. Но усиленная альтерация пародонта ведет к образованию тканевых неоантигенов, образуются иммунные комплексы. В свою очередь, эти иммунные комплексы и неоантигенов, образуются иммунные комплексы и неоантигены также становятся объектами иммунной атаки. Все это приводит к присоединению аутоаллергического компонента к антимикробному иммунному ответу и способствует самоповреждению тканей пародонта. Иммунологические исследования в пародонтологии напрямую связаны с микробиологическими, а точнее с невозможностью во многих случаях объяснить разнообразие ответной реакции тканей пародонта на действие идентичных микроорганизмов или их скоплений [9]. По мере развития заболевания, иммунная система и ее эффекторы оказывают на тканевые структуры все более повреждающее действие, эффекты которого, в том числе разрушение зубодесневого соединения и периодонтальной связки, резорбция альвеолярной кости, становятся основой грубых функциональных нарушений. В связи с этим ключевую роль в развитии типичных клинических проявлений пародонтита играют разрушение зубодесневого соединения и формирование пародонтальных карманов. Это сопровождается образованием в их стенках очагов гранулематоза, деструкцией круговой связки и проникновением воспалительного инфильтрата вглубь с развитием и нарастанием резорбтивных изменений в альвеолярной кости [2].
Генерализованный пародонтит сопровождается ослаблением клеточного звена иммунитета: уменьшается число Т-лимфоцитов и угнетается их функциональная активность. Нарушается хемотаксис гранулоцитов, ослабевает их способность к фагоцитозу. Гранулоциты при генерализованном пародонтите тяжелой степени имеют низкую активность ферментов гликолиза и тканевого дыхания. Способность фибробластов к пролиферации при прогрессировании пародонтита снижается, волокнистый компонент соединительной ткани образуется ими в недостаточном количестве. Эти изменения расцениваются как недостаточность репаративного компонента воспалительной реакции.
Таким образом, пародонтит развивается как незавершенное хроническое воспаление без естественного устранения флогогенного агента и «правильного» репаративного конца [9]. Отмечена связь эффективности лечения воспалительных заболеваний пародонта с нормализацией местных и иммунологических показателей. Целесообразно проводить лечение с обязательной консультацией у иммунолога. При соблюдении пациентом адекватных и своевременных профилактических мер, можно избежать начала или обострения заболеваний пародонта. При проведении профессиональной гигиены полости рта средняя интенсивность хронического гингивита снижается на 38,7%. Индивидуальная гигиена полости рта 3 раза в день после еды в сочетании с профессиональной гигиеной полости рта каждые 3 месяца является надежным средством профилактики воспалительных заболеваний пародонта. Рациональный прием пищи, завершающийся твердыми овощами и фруктами, благотворно влияет на ткани пародонта.
Григорьян А.С., Рахметова С.Ю., Зырянова Н.В. «Микроорганизмы в заболеваниях пародонта: экология, патогенез, диагностика», 2007 г., «Гэотар-Медиа», Москва
Цимбалистов А.В., Сурдина Э.Д., Шторина Г.Б., Жидких Е.Д. «Комплексное лечение генерализованного пародонтита тяжелой степени с применением депульпирования зубов», 2008 г., «СпецЛит», Санкт-Петербург
Курякина Н.В. «Заболевания пародонта», 2007 г., НГМА, Н.Новгород
Иванов В.С. «Заболевания пародонта», 1998 г., «Медицинское информационное агентство», Москва
Грудянов А.И., Дмитриева Н.А., Фоменко Е.В. « Применение пробиотиков в комплексном лечении воспалительных заболеваний пародонта», 2006 г., «Медицинское информационное агентство», Москва
Мюллер Х.-П. «Пародонтология», 2004 г., «ГалДент», Львов
Козинец Г.И., Высоцкий В.В., Погорелов В.И. «Кровь и инфекция», 2001 г., «Триада-Фарм», Москва
Баумгартнер Дж.К. «Антибиотики в лечении заболеваний пульпы», 2004 г., «Азбука», Москва
Долгих В.Т. «Клиническая патофизиология для стоматолога», 2000 г., «НГМА», Н.Новгород
Яснецова В.В., Ефремова Г.Н. «Лекарственные препараты, применяемые в стоматологии», 2004 г., «Гэотар-Медиа», Москва
Полость рта человека населяют разные по видовому составу сообщества микроорганизмов. В их число входят как нормальная флора, так и условно-патогенные микроорганизмы, которые могут являться этиологическими агентами пародонтита. Количественное и качественное выявление ДНК основных пародонтопатогенов позволяет оценить степень дисбиотических нарушений микрофлоры ротовой полости, назначить адекватную терапию и оценить эффективность лечения.
Важная роль микробного фактора в этиологии и патогенезе воспалительных заболеваний пародонта определяет актуальность исследований в этом направлении.
Полость рта можно отнести к одному из идеальных для обитания микроорганизмов биотопов организма человека. Этот биотоп подразделяется на ряд суббиотопов с учетом анатомического строения и других особенностей отделов полости рта: десневую бороздку, язык, пародонтальный карман. Видовой состав микрофлоры этих суббиотопов напрямую зависит как от местных факторов защиты, так и от общих. К местным факторам можно отнести слюну и механизмы резистентности самой слизистой оболочки: фагоцитоз, выработка макрофагами и другими клетками биологически активных веществ, цитокинов.
Нормальная микрофлора ротовой полости играет не последнюю роль в защите организма человека от заболеваний. Практически у любого человека в полости рта, кроме ее естественных обитателей (нормофлоры, представленной лакто- и бифидобактериями), выявляются условно-патогенные и патогенные микроорганизмы.
Нарушение количественных соотношений между нормальной и условно-патогенной флорой приводит к развитию дисбиотических состояний и характеризуется снижением количества лакто- и бифидобактерий и ростом условно-патогенных микроорганизмов.
При пародонтите всегда имеют место дисбиотические нарушения. Доказано, что развитие пародонтита наиболее часто ассоциируется с увеличением количества и персистенцией в тканях пародонта Prevotella intermedia, Tannerella forsythensis, Treponema denticola, Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis.
Основная трудность выявления указанных патогенов связана с проблемой культивирования анаэробных микроорганизмов и количественной оценкой результатов. Современные бактериологические лаборатории не всегда располагают необходимым оборудованием и питательными средами для культивирования облигатно-анаэробных микроорганизмов. В настоящее время в научных и практических исследованиях в области диагностики инфекционных заболеваний широкое распространение получил метод полимеразной цепной реакции (ПЦР). Использование ПЦР в реальном времени позволяет точно анализировать состав микрофлоры в десневой жидкости, зубной бляшке, слюне, выявляя ДНК искомых микроорганизмов в сложной смеси нуклеиновых кислот, а определение количества микроорганизмов обеспечивает возможность динамического наблюдения, что помогает адекватному выбору этиотропной терапии и оценке ее эффективности.
Целью настоящего исследования явилось выявление патогенных микроорганизмов в разных суббиотопах полости рта у больных пародонтитом и здоровых лиц методом ПЦР в реальном времени.
Материал и методы
ПЦР-диагностика десневой жидкости, зубных отложений, слюны проведена у 34 больных пародонтитом (20 женщин и 14 мужчин в возрасте от 27 до 65 лет) и 39 здоровых лиц (20 женщин и 19 мужчин в возрасте от 27 до 65 лет). Последние считали себя практически здоровыми, не имеющими сопутствующей патологии, полость рта у них была санирована, в тканях пародонта отсутствовали воспалительные изменения.
В группу больных пародонтитом вошли пациенты, не имевшие тяжелой фоновой патологии внутренних органов и систем, которая могла бы оказать заметное влияние на течение патологического процесса в пародонте. 62% из них обратились за помощью впервые, а 38% ранее лечились, за помощью обращались 1 раз в год. В зависимости от степени тяжести хронического генерализованного пародонтита их подразделили на 3 группы: с легкой степенью заболевания — 8 (23,5%) человек; со средней — 12 (35,3%); с тяжелым течением заболевания — 14 (41,2%).
Десневую жидкость для исследования отбирали с помощью стерильных бумажных полосок размером 0,3—0,8 мм,
одновременно в пробирку собирали слюну и стерильным ершиком снимали зубной налет.
ДНК для выявления микроорганизмов выделяли по методике «Проба-ГС» (ООО «НПО ДНК-Технология», Россия) согласно прилагаемой инструкции. Метод основан на сорбции ДНК на органическом носителе, отмывке примесей с последующей элюцией нуклеиновых кислот с сорбента. ПЦР и определение температуры плавления олигонуклеотидных проб проводили с помощью детектирующего амплификатора «ДТ-96» (ООО «НПО ДНК-Технология»). Для оценки результатов использовали программное обеспечение, прилагающееся к детектирующему амплификатору «ДТ-96».
Для постановки ПЦР в реальном времени использовали реагенты ООО «НПО ДНК-Технология» согласно инструкции производителя.
После амплификации по показателю индикаторного цикла (Ct) рассчитывали количество ДНК исследуемого инфекционного агента. Для исключения ложноотрицательных результатов учитывали показатель амплификации геномной ДНК человека (контроль взятия биологического материала).
Результаты и обсуждение
Полученные данные представлены в табл. 1—4.
Таблица 1. Данные о микроорганизмах у больных пародонтитом легкой степени в разных биотопах полости рта (n=8)

Таблица 2. Данные о микроорганизмах у больных пародонтитом средней тяжести в разных биотопах полости рта (n=16)

Таблица 3. Данные о микроорганизмах у больных пародонтитом тяжелой степени в разных биотопах полости рта (n=10)
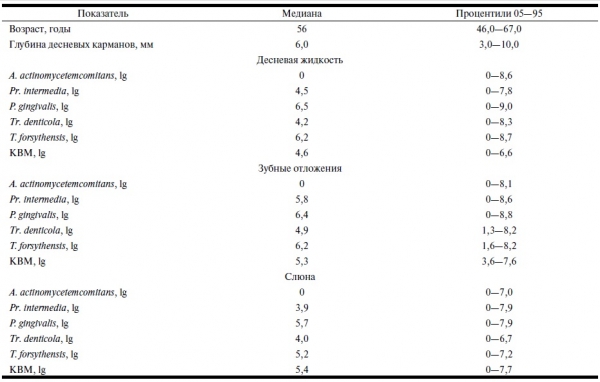
Таблица 4. Показатели у лиц со здоровым пародонтом (n=39)

Как видно из табл. 4, у здоровых людей в исследуемых средах — слюне, десневой жидкости, зубной бляшке — изучаемые микроорганизмы обнаруживали в единичных случаях. У больных пародонтитом в десневой жидкости, зубных отложениях и слюне отмечали повышение количества Pr. intermedia, P. gingivalis, T. forsythensis, Tr. denticola. Микроорганизм A. actinomycetemcomitans выявляли в единичных случаях. Количество P. gingivalis зависело от степени тяжести заболевания, у больных с тяжелым течением заболевания этот показатель был больше.
У большинства пациентов со здоровым пародонтом исследуемых микроорганизмов в десневой жидкости не
выявлялось, в зубных отложениях и слюне обнаруживали T. forsythensis в незначительных количествах.
В группе здоровых лиц в отдельных случаях наибольшее количество микроорганизмов обнаруживалось в зубных отложениях, но и в них их количество не превышало 10 в 6,4 степени ГЭ/образец (для T. forsythensis); других микроорганизмов было еще меньше.
В группе пациентов с пародонтитом легкой степени у большинства обследованных в десневой жидкости выявляли 3 микроорганизма: P. gingivalis (медиана — 10 в 4,4 ГЭ/образец), T. forsythensis (10 в 5,4 степени) и T. denticola (10 в 4,8 степени). В зубных отложениях и слюне были отмечены все микроорганизмы, кроме A. actinomycetemcomitans.
В зубных отложениях пациентов с пародонтитом средней степени тяжести выявлялись все 5 микроорганизмов, тогда как в десневой жидкости и слюне не обнаруживалось A. actinomycetemcomitans.
Самым высоким количество патогенных микроорганизмов у больных пародонтитом было в десневой жидкости и зубных отложениях (до 10 в 8 — 10 в 9 ГЭ/образец), в слюне оно было на 1—2 порядка ниже.
Группы здоровых лиц и больных со средней и тяжелой степенями пародонтита статистически значимо различались по количеству выявленных микроорганизмов. Здоровые и больные с легкой и средней степенями тяжести заболевания различались по количеству всех видов микроорганизмов в десневой жидкости; в зубных отложениях статистически значимо различались количества Pr.intermedia (р=0,0001), P. gingivalis (р=2,8х10 в —7 степени), T. forsythensis (p=l,6х10 в —6 степени) и Tr. denticola (p=3х10 в —5 степени), в слюне — P. gingivalis (p=0,0003) и T. forsythensis (p=0,01). Группа больных с тяжелой степенью пародонтита по исследуемым показателям статистически значимо отличалась от группы здоровых лиц по количеству всех выявляемых микроорганизмов в десневой жидкости и зубных отложениях, а в слюне были найдены достоверные различия между группами только по количеству P. gingivalis (р=8х10 в —5 степени), T. forsythensis (р=0,003) и Tr. denticola (р=1,6х10 в —4 степени). Таким образом, в качестве материала для исследования по 5 основным пародонтопатогенам наиболее репрезентативными являются зубные отложения и десневая жидкость.
На рис. 1 и 2 представлено количество микроорганизмов через 1 мес после лечения: снятие зубных отложений, противовоспалительная терапия, хирургический кюретаж.
Рис. 1. Количество выявляемых микроорганизмов у больных пародонтитом через 1 мес после лечения (десневая жидкость).
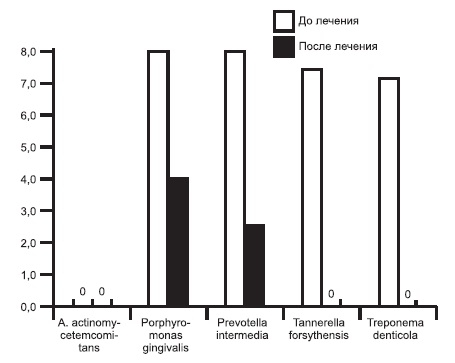
Рис. 2. Количество выявляемых микроорганизмов у больных пародонтитом через 1 мес после лечения (зубные отложения).

Исследованием установлены различия в снижении уровня микроорганизмов. В десневой жидкости после лечения выявлялась Tr. denticola, а в зубных отложениях — Pr. intermedia и P. gingivalis.
Полученные нами данные доказывают участие микроорганизмов зубной бляшки и других суббиотопов полости рта в развитии воспалительных заболеваний пародонта. Данная патология развивается на фоне изменения количества и качественного состава микрофлоры полости рта, что приводит к появлению и размножению условно-патогенной микрофлоры, вызывающей воспаление в пародонте.
Группы здоровых и больных достоверно различались по количеству 5 основных пародонтопатогенных микроорганизмов. По-видимому, для развития воспалительных заболеваний пародонта принципиальным является не только количество каждого конкретного условно-патогенного микроорганизма, но и число видов, принимающих участие в развитии патологического процесса. В качестве материала для исследования предпочтительны зубные отложения и десневая жидкость.
ПЦР с детекцией результатов в режиме реального времени — достаточно точный метод изучения количественного и качественного состава пародонтопатогенной микрофлоры ротовой полости. Исследование 5 пародонтопатогенных микроорганизмов в различных суббиотопах ротовой полости целесообразно проводить при выборе терапии и для оценки эффективности проведенного лечения.
Читайте также:

