Микрофлора при заболеваниях пародонта
Опубликовано: 23.04.2024
На основе результатов микробиологических исследований при различных клинических состояниях полости рта, в частности при разных формах поражения пародонта и твердых тканей зубов, были выявлены преимущественные микробные представители и их сочетания. Это позволило составить своего рода классификацию пародонтальных микробных комплексов. Различают красный, зеленый, желтый, пурпурный, оранжевый микробные комплексы.
Красный комплекс (P. gingivalis, B.forsitus, T. denticole). Сочетание этих микроорганизмов отличается особым агрессивным воздействием на пародонт, связанным с вышеперечисленными свойствами P. gingivalis, B.forsitus, T. denticole.
Присутствие этого комплекса обусловливает сильную кровоточивость десен и быстрое течение деструктивных процессов в пародонте.
Зеленый комплекс (Е. corrodent, Capnocytophaga spp., A. actinomycetemcomitans). Основным фактором вирулентности A. actinomycetemcomitans является лейкоток-син, вызывающий лизис нейтрофилов. Это сочетание микробов может явиться причиной как заболеваний пародонта, так и прочих поражений слизистой оболочки рта и твердых тканей зубов.
Желтый комплекс (S. mitis, S. israilis, S. sanguis).
Пурпурный комплекс (V. parvula, A. odontolyticus).
Оранжевый комплекс (P. nigrescen, Prevotella intermedia, P. micros, С. rectus + Campylobacter spp.). Prevotella intermedia продуцирует фосфолипазу А, нарушает целостность мембран эпителиальных клеток, является активным продуцентом гидролитических протеаз, расщепляющих белки пародонтальных тканей и тканевой жидкости на полипептиды, вырабатывает протеолитические ферменты, поэтому играет главную роль в образовании пародонтальных абсцессов.
Эти три комплекса также способны вызывать поражения пародонта и другие заболевания полости рта.
Выделение этих комплексов не означает, что в их состав входят только перечисленные виды микроорганизмов, но именно эти сообщества видов являются наиболее устойчивыми. Доказано, что использование увлажнителей воздуха в помещении значительно снижает интенсивность развития микробных комплексов. Современный увлажнитель воздуха позволяет минимизировать содержание патогенных микроорганизмов в помещении, тем самым тормозит их коллонизацию зубов.
Кстати, возможной причиной устойчивости именно таких микробных сочетаний является их существование в виде вязких биопленок по принципу вышеупомянутого «удобства» их метаболизма, когда продукты, выделяемые одними, являются питательными источниками для других микробов либо обеспечивают их повышенную устойчивость и вирулентность.
Интересно, что перечисленные микробные ассоциации находятся в составе стабильных зубных бляшек, прикрепленных к поверхности зуба или к стенкам пародонтального кармана (ПК). При этом состав свободно расположенных микробных скоплений внутри ПК может быть совсем иным.
Патогенность микробов пародонта
Патогенность — это способность определенных видов микроорганизмов вызывать инфекционные заболевания. Вирулентностью называется степень патогенности определенного штамма, которая изменяется под влиянием внешних воздействий. Патогенность и вирулентность зависят от способности микроорганизма уклоняться от защитных механизмов организма и проявлять агрессивные свойства. Пародонтопатогенные микроорганизмы способны преодолеть защитные механизмы хозяина с помощью синтеза иммунодепрессантов, которые подавляют синтез и активность иммунокомпетентных клеток, лизоцима и комплемента.
Зависимость степени повреждения пародонта от количества микробного налета и времени его сохранения и действия доказана многочисленными эпидемиологическими исследованиями. Одной из причин такой зависимости является возрастное снижение защитных механизмов и повышение восприимчивости тканей человека к действию микробных агентов, а также суммарный повреждающий эффект, увеличивающийся с возрастом.
Однако в ходе этих же исследований были открыты и другие факты, которые не позволяют излишне прямолинейно трактовать исключительное главенство только микроорганизмов. В частности, у некоторых пациентов с плохой гигиеной полости рта воспалительные и деструктивные изменения совсем незначительны. Не у всех лиц с гингивитом с течением времени развивался пародонтит.
Требует своего объяснения и тот факт, что наряду с участками глубокого поражения встречаются интактные ткани, причем не только в разных сегментах зубного ряда, но и в области одного зуба.
Эти наблюдения явились причиной возникновения и формирования двух основных теорий, которые по-разному оценивают связь ВЗП с количеством и характером микробного состава зубного налета.
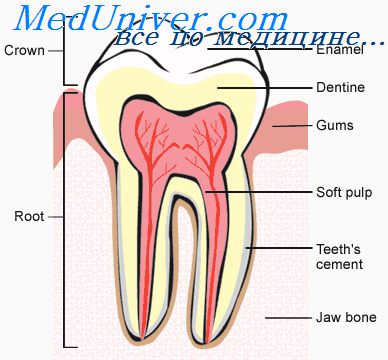
Пародонт представляет собой комплекс тканей, имеющих генетическую и функциональную общность: периодонт, кость альвеолы с надкостницей, десна и ткани зуба. Ткани пародонта постоянно подвергаются бактериальным, температурным и механическим воздействиям. Целостность пародонта является надежной защитой организма от действия неблагоприятных факторов. При нарушении внутренней среды, обусловленном местными (микробы, токсины, ферменты, травма, перегрузка и т. д.) или общими факторами (гиповитаминозы, заболевания, нарушения обмена веществ, нейротрофические расстройства), развиваются структурно-функциональные изменения тканей пародонта, что приводит к снижению барьерных функций и развитию заболеваний.
Заболевания тканей, окружающих зуб, относятся к числу болезней, известных с древних времен. С развитием цивилизации распространенность заболеваний пародонта резко возросла. Согласно данным Всемирной Организации Здравоохранения (1978), в большинстве стран заболевания пародонта поражают приблизительно 80 % детского населения и почти все взрослое. У людей старше 40 лет заболевания пародонта встречаются чаще, чем кариес.
Болезни пародонта крайне разнообразны — от непродолжительного обратимого гингивита, который может развиться в результате несоблюдения правил гигиены полости рта, стресса или кратковременных нарушений питания, до острого абсцесса пародонта и хронического необратимого пародонтита, приводящего в конечном счете к утрате функции зубов.
Гингивит. Различают несколько форм воспаления тканей десны, наиболее часто встречается катаральный гингивит. Он может быть локализованным (в области одного-двух зубов) или генерализованным.
Гингивит проявляется покраснением, отечностью десен, кровоточивостью при чистке зубов. Этиологические факторы гингивита разнообразны. К местным факторам следует отнести зубной камень, дефекты пломбирования и протезирования, недостаточный уход за полостью рта и т. д. Появление катарального гингивита может иметь место при ряде общесоматических заболеваний и гормональных нарушений (заболеваниях сердечно-сосудистой системы, желудочно-кишечного тракта, нарушениях функции гипофиза, щитовидной железы).
Механизм развития воспалительных явлений в тканях маргинального пародонта тесно связан с нарушением тканевой и сосудистой проницаемости. По существу, повышение проницаемости соединительнотканных структур является основным звеном в патогенезе всех заболеваний пародонта, протекающих с воспалительным компонентом.
Ведущая роль в возникновении гингивита принадлежит зубной бляшке. Она окружает весь зуб, в том числе и место соединения эмали с тканями десны. Принято различать бляшку над- и поддесневую.
Бляшка содержит большое количество микробов — в 1 мг налета 100—300 млн. бактериальных клеток, причем состав разных частей бляшки в пределах одного зуба и бляшек на разных зубах различен. Помимо кариесогенных микроорганизмов в бляшке обнаруживаются бактерии, вызывающие заболевания пародонта: Actinomyces viscosus, Bacteroides melanino-genicus, Veillonella alcalescens, фузобактерии и спирохеты. В состав бляшки входят также органические и неорганические вещества, которые являются хорошей средой для развития и жизнедеятельности микрофлоры. Со временем в зубной бляшке повышается концентрация неорганических веществ, она является матрицей для образования зубного камня.
При локализации зубной бляшки в пришеечной области десна подвергается длительному раздражению и хронической интоксикации. Экспериментально доказано, что при такой локализации бляшка способна вызвать не только воспаление десны, но и резорбцию альвеолярной кости.
Существенное влияние на состояние тканей пародонта оказывает наддесневой камень. Обладая плотной консистенцией, он травмирует ткани десны. Возникшее воспаление способствует еще большему образованию зубных отложений, что приводит к давлению зубного камня на десну и последующей ее атрофии.
Бактерии полости рта обычно не проникают в ткани десны, однако бактериальные антигены обладают такой способностью. Наиболее активны в этом отношении липополисахариды, декстраны и липотейхоевые кислоты. Они вызывают местный и генерализованный иммунные ответы, наряду с этим оказывают и разрушающее действие на ткани, обусловливая повреждение сосудов, развитие воспаления и некроза тканей. Липополисахариды и другие антигены бактериального происхождения способствуют выделению макрофагами и лейкоцитами ферментов типа коллагеназы, которые, возможно, также повреждают ткани десны. Однако истинная роль клеточных ферментов в повреждении тканей остается неясной; вполне вероятно, что большая часть ферментов вне клеток теряет свою активность.
На фоне измененной реактивности организма после перенесенных заболеваний, интоксикаций, при дефиците витаминов может развиться язвенный гингивит. При этом десневой край изъязвляется, что сопровождается повышением температуры, увеличением подчелюстных лимфатических узлов, появлением неприятного запаха изо рта.
При язвенном гингивите наряду со стрептококками и стафилококками в большом количестве обнаруживаются фузобактерии и спирохеты. Наличие фузоспирохетоза свидетельствует о нарушении резистентности тканей пародонта к микрофлоре . полости рта.
Пародонтит. При длительном течении катарального гингивита воспалительный процесс может распространиться на прикрепленную десну и костную ткань. Следствием этого является разрушение эпителиального прикрепления и образование патологического зубодесневого кармана, в результате чего таким образом возникает пародонтит, характеризующийся кровоточивостью десен, отложением поддесневой зубной бляшки и камня, подвижностью зубов, выделением гноя из-под десны при, надавливании. Однако основным признаком пародонтита .является патологический зубодесневой карман.
Зубодесневой карман в норме представляет собой щель, окружающую шейку зуба, ограниченную с одной стороны эмалью с покрывающей ее кутикулой, а с другой — внутренней поверхностью десневого края. Дно кармана образовано эпителием. Глубина десневого кармана при полностью прорезавшемся зубе составляет 1—2 мм. Более глубокие зубодесневые карманы рассматриваются как патологические.
Микрофлора патологического зубодесневого кармана весьма разнообразна и зависит от формы и стадии заболевания. Вначале преобладает факультативно-анаэробная и аэробная кокковая флора — энтерококки, нейссерии, р -гемолитические стрептококки группы Н (S. Sanguis), диплококки, близкие по свойствам пневмококкам. Позднее эту флору вытесняют более строгие анаэробы: пептострептококки, вейлонеллы, лептотрихии, бактероиды, фузобактерии, вибрионы, актиномицеты. При гноетечении в мазках из содержимого десневого кармана наблюдается картина, характерная для фузоспирохетозов. Отмечается обилие простейших (Entamocba gingivalis, Trichomonas elongata).
Микроорганизмы патологического зубодесневого кармана и продукты их жизнедеятельности оказывают существенное влияние как на состояние околозубных тканей, так и на организм в целом. Местное влияние особенно выражено за счет бактерий, продуцирующих гистолитические ферменты (гиалуронидазу, хондроитинсульфатазу, коллагеназу и другие протеиназы). При распаде грамотрицательных микроорганизмов выделяются эндотоксин и другие цитологические вещества; кроме того, бактерии вырабатывают токсические, метаболиты (аммиак, органические кислоты, сероводород). Все эти соединения могут существенно нарушать нормальный метаболизм тканей или вызывать воспалительные реакции, которые сами по себе могут быть деструктивными. Гистологическое действие бактериальных ферментов считают основной причиной появления патологического десневого кармана. Всасываясь в кровь, микробные и тканевые токсины обусловливают хроническую интоксикацию и сенсибилизацию организма. Так, с помощью кожно-аллергических проб у больных было выявлено состояние гиперчувствительности к стрептококкам, стафилококкам, нейссериям, актиномицетам и другим микроорганизмам. Значение микрофлоры десневых карманов как очагов инфекции и аллергизации особенно возрастает при сердечно-сосудистых и аллергических заболеваниях, анемиях, коллагенозах.
При исследовании содержимого зубодесневого кармана выявлены Ig G, А, М, фракции Сз и C5 комплемента, лейкоциты, а также обильная инфильтрация тканей десны плазматическими клетками, лимфоцитами, макрофагами. Все это позволяет предполагать, что многие реакции антиген — антитело и проявления клеточного иммунитета происходят именно в десневом кармане. Иммунные комплексы антиген — антитело активируют систему комплемента. При этом из клеток освобождаются различные биологически активные вещества. Наблюдается хемотаксис нейтрофилов, усиление фагоцитоза, трансформация лимфоцитов. Бактериальные ферменты, а также биологически активные вещества, выделяемые клетками, вызывают резорбцию костной ткани. Повреждение связочного аппарата и резорбция ткани альвеолы приводят к подвижности зубов.
Таким образом, распространение процесса при пародонтите происходит нисходящим путем, т. е. вначале поражается эпителий, затем глубоколежащие соединительнотканные элементы десны, эпителиальное прикрепление, связочный аппарат и наконец костная ткань.
Пародонтит при распространении процесса на надкостницу может осложниться образованием абсцесса.

Лечение и реабилитация пациентов с воспалительными заболеваниями пародонта являются одной из наиболее сложных проблем в стоматологии, что находит подтверждение в огромном количестве предложенных для этих целей средств и методов, которые далеко не всегда оказываются эффективными и необходимости использования лекарственных антимикробных препаратов избирательного действия [3, 7, 12].
Для определения вида возбудителя, назначения эффективного лечения и его оценки необходим микробиологический анализ патологического материала. Кроме того, с помощью микробиологической диагностики врач сможет конкретизировать диагноз и составить прогноз развития болезни [14].
Наиболее важными показаниями к проведению микробиологической диагностики являются такие заболевания как:
- Острый язвенно-некротический гингивит.
- Хронический пародонтит с частым рецидивированием и абсцедированием.
- Болезни паро- и периодонта, устойчивые к лечению.
- Агрессивные формы болезней пародонта (препубертатный, ювенильный пародонтит, быстропрогрессирующий у взрослых).
- Тяжелые формы патологии пародонта на фоне системных заболеваний.
- Комплексное лечение заболеваний пародонта с проведением системной антимикробной терапии, лоскутных операций, в случаях сложного протезирования или внутрикостной имплантации зубов, связанных с большими финансовыми затратами.
Сегодня актуальна выработка стандартов диагностических исследований при заболеваниях пародонта, которые могут использоваться в повседневной практике врача-стоматолога [17].
Цель исследования: на основе данных литературы сделать обзор методов диагностики микрофлоры при заболеваниях пародонта, рассмотреть преимущества и недостатки каждого из методов, что даст возможность врачу-стоматологу выбрать тот метод, который будет отвечать его целям, экономическим и техническим возможностям.
Цитологический метод исследования
Содержимое пародонтального кармана изучают по методике П. М. Покровского и М. С. Макаровой в модификации И. А. Бенюмовой (1962). Пародонтальные карманы предварительно промывают изотоническим раствором хлорида натрия, стерильной корневой иглой с турундой производят забор материала.
Забор содержимого из корневого канала проводится на этапе механической обработки корневых каналов стерильным эндодонтическим инструментом (H-файлом) (методика А. А. Кунина, 2003) [16].
Исследуемый материал распределяется на предметном стекле. Препарат фиксируют смесью Никифорова и окрашивают по Граму и Гимзе-Романовскому. Далее материал высушивается и микроскопируется при помощи светового микроскопа [1, 6].
Преимущества: простота в использовании
Недостатки: не позволяет определить вид возбудителя и его чувствительность к антибактериальным препаратам
Метод жидкостной цитологии
Жидкостная тонкослойная цитология – это способ получения монослойных цитолологических препаратов при переносе клеток из фиксирующего или транспортного растворов с использованием методов центрифугирования, осаждения и/или фильтрации.
С помощью урогенитального зонда или стоматологических бумажных адсорбентов производится забор материала из пародонтального пространства. Материал сразу помещается в специальный контейнер (виалу) и отправляется в лабораторию. В лаборатории виалы в базовых штативах помещаются в цитопроцессор, проводится обработка цитологического материала с полным сохранением клеточных и субтканевых структур. Производят окрашивание по методу Папаниколау [10].
– быстрый и удобный микроскопический анализ: препарат занимает небольшую площадь, клетки располагаются в один слой, в скоплениях хорошо видна структура ядер;
– возможность неоднократного приготовления препаратов из одного и того же контейнера;
– более высокая информативность по сравнению с традиционным цитологическим методом за счет обеспечения сохранности клеточных структур.
– более высокая, по сравнению с традиционной цитологией, стоимость пробоподготовки;
– необходимость дополнительного оборудования для приготовления препаратов;
– необходимость дополнительного обучения для интерпретации результатов [8].
Бактериологический метод исследования
Забор содержимого пародонтального кармана проводят стерильной ватной турундой на глубине 2 мм. Затем концевую часть турунды промывают в 10 мл физиологического раствора и получают взвесь микроорганизмов [6].
Забор содержимого корневого канала проводится следующим образом. Коронку зуба очищают от зубного налета гигиенической полировочной щеткой с последующей обработкой 3 %-ой перекисью водорода. После препарирования кариозной полости, раскрытия полости зуба, обеспечения эндодонтического доступа в канале H-файлом № 15-20 инструментальными движениями с ирригацией физиологическим раствором создают суспензию инфицированного состава, которую забирают с помощью стерильного бумажного штифта [11].
Образцы полученных проб помещают в транспортные системы и в течение 24 часов доставляют в бактериологическую лабораторию. Далее делают секторальный посев по методике Мельникова-Царева на 5 % кровяном агаре Шедлера, для идентификации микроорганизмов в современных условиях используют специальные тест-системы [9]. Определяют чувствительность выделенных микроорганизмов к антибактериальным препаратам, а также к препаратам растений, действие которых активно изучают в последнее время [3, 5].
– позволяет установить видовой состав микрофлоры;
– возможность определения чувствительности микроорганизмов к определенным антибактериальным препаратам
– чувствительность к забору материала, транспортировке и условиям проведения
ПЦР
Сбор мягкого зубного налета производят методом смыва из пародонтального кармана (в случае патологии) или из десневой бороздки (в случае нормы) с помощью стерильных бумажных эндодонтических штифтов [15].
Сбор твёрдого зубного налета производят следующим образом. После предварительного полоскания ротовой полости водой проводят обработку ватным тампоном зуба с целью полного удаления мягкого налета и соскабливают поддесневой твердый налет, используя кюрету Грейси [14].
Исследуемый материал помещают в пробирки с транспортной средой, предварительная обработка материала не требуется. ПЦР проходит в 3 этапа: выделение ДНК/РНК, амплификация ДНК/РНК-фрагментов, детекция ДНК/РНК-продуктов амплификации. Современные ДНК/РНК тесты способны идентифицировать от 3 до 11 периодонтопатогенов [4, 11, 13, 17].
– возможность анализа до 96 образцов за один запуск (использование при скрининговых исследованиях большого числа пациентов) [2];
– не требует специальных транспортных сред (для проведения анализа необязательно присутствие живых микроорганизмов);
– быстрый результат (весь процесс с момента передачи в лабораторию занимает не более одного рабочего дня);
– за счет автоматической интерпретации полученных результатов снимается проблема субъективной оценки;
– возможность определения чувствительности к антибактериальным препаратам
– ограничение оценки лекарственной устойчивости (данные о конкретных генетических механизмах резистентности могут отсутствовать, резистентность к препаратам часто связана с различными механизмами и мутациями в различных генах, которые независимо влияют на фенотип);
– возможность ложноположительного результата в результате загрязнения исследуемого материала и ложноотрицательного результата в результате ингибирования реакции компонентами биологических образцов [9].
Таким образом, на клиническом приеме врач-стоматолог при лечении заболеваний пародонта в целях определения вида возбудителя, назначения эффективного лечения и его оценки может использовать различные методы микробиологической диагностики. Выбор определяется преимуществами и недостатками каждого метода. Цитологический метод позволяет определить только наличие микрофлоры без возможности определить вид возбудителя и чувствительность к противомикробным средствам. Метод жидкостной цитологии является более информативным, однако также не дает возможности определения чувствительности к противомикробным средствам и является более дорогим. Бактериологический метод позволяет установить видовой состав микрофлоры, определить чувствительность микроорганизмов к антибактериальным препаратам, но является еще более дорогим и имеет чувствительность к забору и транспортировке материала. Метод ПЦР позволяет с высокой точностью определить видовой состав микрофлоры, не требователен к забору и транспортировке материала, дает возможность определения чувствительности к антибактериальным препаратам, однако имеет высокую стоимость и возможны ложные результаты.

Рубрика: Медицина
Статья просмотрена: 4957 раз
Библиографическое описание:
Волошина, А. А. Значение микробного фактора в развитии и течении воспалительных заболеваний пародонта / А. А. Волошина. — Текст : непосредственный // Молодой ученый. — 2011. — № 1 (24). — С. 248-251. — URL: https://moluch.ru/archive/24/2579/ (дата обращения: 04.04.2021).
Заболевание пародонта занимает одно из первых мест по частоте и распространенности среди стоматологических заболеваний. По данным ВОЗ, основанным по статистике 53 стран мира, в различных возрастных группах заболеваемость гингивитом и пародонтитом достигает 80-100% [1].
Современная отечественная классификация, принятая на заседании Президиума секции пародонтологии Стоматологической Ассоциации России (СТАР) в 2001 г., дает следующие определения и характеристики заболеваний пародонта:
- гингивит-воспаление десны - обусловленное неблагоприятным воздействием местных и общих факторов, которое протекает без нарушения целостности зубодесневого прикрепления и проявления деструктивных изменений в других отделах пародонта.
Формы: катаральный, язвенный, гипертрофический.
Течение: острое, хроническое.
Фазы процесса: обострение, ремиссия.
Распространенность процесса: локализованный (очаговый), генерализованный.
- пародонтит - воспаление тканей пародонта, характеризующееся деструкцией связочного аппарата периодонта и альвеолярной кости.
Течение: хроническое, агрессивное.
Фазы процесса: обострение (абсцедирование), ремиссия.
Степень тяжести определяется по клинико-рентгенологической картине. Основным ее критерием является степень деструкции костной ткани альвеолярного отростка (на практике она определяется по глубине пародонтальных карманов (ПК) в миллиметрах).
Степень тяжести: легкая (ПК не более 4 мм), средняя (ПК 4-6мм), тяжелая (ПК более 6 мм).
Распространенность процесса: локализованный (очаговый), генерализованный.
- пародонтоз - дистрофический процесс, распространяющийся на все структуры пародонта. Его отличительной чертой является отсутствие пародонтальных карманов и воспалительных явлений в десневом крае.
Степень тяжести: легкая, средняя, тяжелая (в зависимости от степени обнажения корней зубов-до 4 мм, 4-6 мм, более 6 мм).
Распространенность процесса: только генерализованный.
- синдромы, проявляющиеся в тканях пародонта - эта группа обозначалась ранее как идиопатические заболевания пародонта с прогрессирующим лизисом кости ( синдром Иценко-Кушинга, Элерса-анлоса, Шедиака-игаши, Дауна, болезнях крови и др.)
Пародонтомы- опухолеподобные процессы в пародонте (фиброматоз десен, пародонтальная киста, эпулис, эозофильная гранулема) [2].
Ранние проявления заболеваний пародонта воспалительного характера регистрируются в возрасте от 10-20 лет, 80% детей страдает гингивитом.
Эпидемиологические исследования населения различных регионов нашей страны свидетельствуют о высокой распространенности воспалительных изменений пародонта в различных возрастных группах (80-100%), например, среди школьников Москвы в возрасте 10 лет гингивит выявлен у 69%, 12 лет - у 77%, 15 лет – у 87% обследованных. Пародонтит средней тяжести выявлен в возрасте 12 лет – у 3%, в 15 лет - у 12%, в 16 лет - у 18% обследованных [3]. При обследовании 4947 детей Риги и других городов Латвии в возрасте от 7 до 14 лет Г.И. Кадникова выявила гингивит. Распределение по нозологическим формам представлено на диаграмме [4].

Диаграмма. Распределение гингивита по нозологическим формам
Выраженные деструктивные изменения в пародонте с вовлечением в процесс костной ткани наиболее часто выявляются у лиц старше 40 лет.
Многими исследователями показана полиэтиологическая природа заболеваний пародонта, причем большая роль в их развитии принадлежит воспалительным реакциям, спровоцированным микрофлорой ротовой полости. В связи с этим исследование микробиологических факторов патогенеза заболеваний пародонта следует признать одной из актуальных проблем современной стоматологии [1].
В состав постоянной микрофлоры полости рта входят представители нескольких групп микроорганизмов: бактерии, грибы, спирохеты, простейшие, вирусы.
Количество бактерий в полости рта по числу видов и содержанию в единицы материала конкурирует с составом желудочно-кишечного тракта. Бактерии в полости рта представлены разнообразными видами кокков, палочек и извитых форм. Содержание микроорганизмов в смешанной слюне составляет от 4 млн. до 5 млрд., в зубном налете – от 10 до 1000 млрд. в 1 г. сухого остатка. Видовой состав микрофлоры полости рта представлен аэробными и анаэробными микроорганизмами. Относительная концентрация аэробных аэробных и факультативных бактерий в 1мл. слюны составляет 10 7 , анаэробных – 10 8 [5].
Среди разных видов бактерий существует метаболизм, способствующий тому, что микроорганизмы на поверхности зуба образуют многокомпонентную биопленку (Рис.1) [6].

Рис. 1. Метабиоз бактерий поддесневого участка
Совершенствование методов диагностики в микробиологии позволили более полно и точно изучить микробный спектр в норме и при патологии. Это дало возможность выявить наиболее патогенные виды микроорганизмов, характерных для того или иного заболевания. Изучением микрофлоры пародонтальных карманов занимались многие авторы. Исследования проводились с помощью фазовой контрастной и темнопольной микроскопии, бактериального культивирования, ферментативных, иммунодиагностических и молекулярных методов. Были выявлены три вида «маркерных» микроорганизмов, присутствие которых в пародонтальных карманах коррелирует с тяжестью или агрессивностью пародонтита. К ним относятся : Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis и Bacteroides forsythus.
В 1996 г. на Всемирном конгрессе по периодонтологии они были строго ассоциированы со статусом пародонтальной болезни и определены как «пародонтальные патогены».
Однако дальнейшие исследования позволили разделить обнаруженные в пародонтальных карманах микроорганизмы уже на шесть основных комплексов- «красный», «оранжевый», «голубой», «зеленый», «желтый», «пурпурный». При этом было доказано, что в пародонтальных карманах по мере углубления процесса грамотрицательные анаэробные микроорганизмы преобладают над другими видами. Было установлено, что наивысшей патогенностью для тканей пародонта обладают представители так называемого «красного комплекса»: Porphyromonas gingivalis , Bacteroides forsytus или Tannerella forsythia , Treponema denticola . «Оранжевый» комплекс также обладает высокой патогенностью. К нему относятся: Campylobacter rectus , Campylobacter showae , Eubacterium nodatum , Fusobacterium nucleatum , Prevotella intermedia , Prevotella nigrescens , Peptostreptococcus micros . «Голубой» комплекс включает в себя представителей рода Actinomyces . В «зеленый» комплекс входят: Actinobacillus actonomycetemcomitans , Capnocytophaga , Campilobacter concisus , Eikenella corrodens . actonomycetemcomitans , Capnocytophaga , Campilobacter concisus , Eikenella corrodens . Пятая, «желтая», группа состоит з стрептококков. В «пурпурную» группу входят Actinomyces odontoliticus и Veilonella parvulla [2] .
Мюллер указал на то, что огромное значение для колонизации микробного пейзажа поддесневого пространства имеют синергизм и антогонизм между пародонтальными патогенами и другими бактериями полости рта. Микрофлора начинает обладать особыми патогенными свойствами, когда действует в ассоциациях. Большинство инфекционных процессов, возникающих в челюстно-лицевой области, носят эндогенный характер. Сам факт возникновения эндогенных инфекций отражает нарушение эволюционно сложившегося баланса между организмом и его микрофлорой, с одной стороны, и нарушением равновесия внутри микробных ассоциаций, с другой.
Т.к. большинство бактерий во всех природных экосистемах существуют в биопленках, сообщества микрооранизмов отличаются особым характером взаимодействия. В частности, они могут быть особо устойчивы к защитной реакции макроорганизма, резистентны к антибиотикам и выносливы в стрессовых для микроорганизмов ситуациях- повышение температуры, кислотности, обезвоживания. Неспорообразующие анаэробы зубодесневых карманов отличаются полиморфизмом, обладаютразличной степенью ферментативной активности. Факторами их патогенности являются: способность к колонизации, наличие капсулы, инактивирующих ферментов, инвазивность, токсигенность, способность к длительному выживанию в организме. Эти факторы способствуют, с одной стороны, проникновению в зараженный организм, а с другой стороны, противодействуют его защитным реакциям [7] .
Анаэробные инфекции развиваются в некротизированной ткани в условиях нарушения кровоснабжения, а также при снижении окислительно-восстановительного потенциала, возникающего вследствие жизнидеятельности аэробов и факультативных анаэробов [8] .
Опираясь на данные проведенных исследований появились основания к использованию на практике противомикробных препаратов местного и общего назначения. Например, препараты группы детергенты: этоний, хлоргексидина биглюконат, роккал, декаметоксин. Они устойчивы в водных растворах, обладают низким поверхностным натяжением. Вследствие денатурации белковых фракций бактерий они оказывают антисептическое, бактерицидное и фунгицидное действие даже на антибиотикорезестентные штаммы микроорганизмов [9].
Биглюконат хлоргексидина (ХГБ) - используют 0,05% раствор, оказывает быстрое и сильное антибактериальное действие в отношении большинства (до 99%) грамположительных и грамотрицательных аэробов и анаэробов, в т.ч. спирохет, спороцидное в отношении спор бактерий (только при высокой температуре), противогрибковое (фунгицидное), в т.ч. в отношении C . albicans , противопротозойное в отношении трихомонад, прочно связывается с поверхностными слоями слизистой оболочкой, поверхностью зубов, антисептический эффект сохраняется в течении 12 часов, не вызывает развития устойчивых штаммов микроорганизмов; сохраняет активность в присутствии крови, физиологических жидкостей и органических жидкостей [10]. Также применяют группу галоидов (хлорамин Б, йодинол, хлорид йода), кислоты и щелочи (натрия тетраборат, натрия гидрокарбонат), производные хиноксалина (диоксидин), производные фторхинолона (пефлоксацин, офлоксацин, ципрофлоксацин, норфлоксацин).
По мере развития воспаления в пародонте происходят глубокие расстройства механизмов регуляции и снижение компенсаторно-приспособительных возможностей системы микроциркуляции. Вслед за сосудистой реакцией активизируется неспецифическая защита: система комплемента и фагоцитоз; в зоне повреждения увеличивается количество нейтрофилов и эозинофилов. Однако возбудители инфекционного воспаления противодействуют защитным механизмам организма хозяина. Происходят разнообразные мутации, чтобы избежать фагоцитоза. Все эти эффекты затягивают течение воспаления, способствует его хронизации и не позволяют уничтожить флогогенный агент. На повреждающее действие микробов организм также отвечает комплексом реакций защиты и поддержания гомеостаза. Иммунная защита в тканях пародонта не ограничивается врожденными механизмами иммунитета, а переходит к адаптивным иммунным реакциями с участием антител и экспансией клонально-специфических лимфоцитов. Однако именно система иммунобиологического надзора является одним из ключевых звеньев патогенеза хронического воспалительного процесса в пародонте [2]. Обладая свойствами антигенов, микроорганизмы при участии местных антигенов, представляющих макрофагальные клетки полости рта, сенсебилизируют лимфоциты MALT -системы. Клоны, специфичные по отношению к антигенам микробов, экспансируют и осуществляют в полости рта иммунный ответ против возбудителей. Но усиленная альтерация пародонта ведет к образованию тканевых неоантигенов, образуются иммунные комплексы. В свою очередь, эти иммунные комплексы и неоантигенов, образуются иммунные комплексы и неоантигены также становятся объектами иммунной атаки. Все это приводит к присоединению аутоаллергического компонента к антимикробному иммунному ответу и способствует самоповреждению тканей пародонта. Иммунологические исследования в пародонтологии напрямую связаны с микробиологическими, а точнее с невозможностью во многих случаях объяснить разнообразие ответной реакции тканей пародонта на действие идентичных микроорганизмов или их скоплений [9]. По мере развития заболевания, иммунная система и ее эффекторы оказывают на тканевые структуры все более повреждающее действие, эффекты которого, в том числе разрушение зубодесневого соединения и периодонтальной связки, резорбция альвеолярной кости, становятся основой грубых функциональных нарушений. В связи с этим ключевую роль в развитии типичных клинических проявлений пародонтита играют разрушение зубодесневого соединения и формирование пародонтальных карманов. Это сопровождается образованием в их стенках очагов гранулематоза, деструкцией круговой связки и проникновением воспалительного инфильтрата вглубь с развитием и нарастанием резорбтивных изменений в альвеолярной кости [2].
Генерализованный пародонтит сопровождается ослаблением клеточного звена иммунитета: уменьшается число Т-лимфоцитов и угнетается их функциональная активность. Нарушается хемотаксис гранулоцитов, ослабевает их способность к фагоцитозу. Гранулоциты при генерализованном пародонтите тяжелой степени имеют низкую активность ферментов гликолиза и тканевого дыхания. Способность фибробластов к пролиферации при прогрессировании пародонтита снижается, волокнистый компонент соединительной ткани образуется ими в недостаточном количестве. Эти изменения расцениваются как недостаточность репаративного компонента воспалительной реакции.
Таким образом, пародонтит развивается как незавершенное хроническое воспаление без естественного устранения флогогенного агента и «правильного» репаративного конца [9]. Отмечена связь эффективности лечения воспалительных заболеваний пародонта с нормализацией местных и иммунологических показателей. Целесообразно проводить лечение с обязательной консультацией у иммунолога. При соблюдении пациентом адекватных и своевременных профилактических мер, можно избежать начала или обострения заболеваний пародонта. При проведении профессиональной гигиены полости рта средняя интенсивность хронического гингивита снижается на 38,7%. Индивидуальная гигиена полости рта 3 раза в день после еды в сочетании с профессиональной гигиеной полости рта каждые 3 месяца является надежным средством профилактики воспалительных заболеваний пародонта. Рациональный прием пищи, завершающийся твердыми овощами и фруктами, благотворно влияет на ткани пародонта.
Григорьян А.С., Рахметова С.Ю., Зырянова Н.В. «Микроорганизмы в заболеваниях пародонта: экология, патогенез, диагностика», 2007 г., «Гэотар-Медиа», Москва
Цимбалистов А.В., Сурдина Э.Д., Шторина Г.Б., Жидких Е.Д. «Комплексное лечение генерализованного пародонтита тяжелой степени с применением депульпирования зубов», 2008 г., «СпецЛит», Санкт-Петербург
Курякина Н.В. «Заболевания пародонта», 2007 г., НГМА, Н.Новгород
Иванов В.С. «Заболевания пародонта», 1998 г., «Медицинское информационное агентство», Москва
Грудянов А.И., Дмитриева Н.А., Фоменко Е.В. « Применение пробиотиков в комплексном лечении воспалительных заболеваний пародонта», 2006 г., «Медицинское информационное агентство», Москва
Мюллер Х.-П. «Пародонтология», 2004 г., «ГалДент», Львов
Козинец Г.И., Высоцкий В.В., Погорелов В.И. «Кровь и инфекция», 2001 г., «Триада-Фарм», Москва
Баумгартнер Дж.К. «Антибиотики в лечении заболеваний пульпы», 2004 г., «Азбука», Москва
Долгих В.Т. «Клиническая патофизиология для стоматолога», 2000 г., «НГМА», Н.Новгород
Яснецова В.В., Ефремова Г.Н. «Лекарственные препараты, применяемые в стоматологии», 2004 г., «Гэотар-Медиа», Москва

CC BY
Аннотация научной статьи по клинической медицине, автор научной работы — Тамарова Эльмира Рифовна, Зулькарнаева А. Р., Мавзютов А. Р.
Цель. Изучить распространенность ассоциированных с пародонтитом патогенных и условно-патогенных микроорганизмов у пациентов с хроническими формами пародонтита. Материалы и методы. У 60 пациентов с пародонтитом средней степени тяжести исследовано содержимое пародонтального кармана зубов и слюны. Изучен видовой состав основных пародонтопатогенных бактерий ( P. gingivalis, T. denticola, S. oralis, S. sanguis, S. mutans, S. salivarius, S. sobrinus, S. macacae ) с использованием метода полимеразной цепной реакции . Результаты. В содержимом пародонтального кармана зубов и слюны обнаружено сочетание несколько видов бактерий. Наиболее часто встречаются сообщества: S.mutans, S. sanguis, S. oralis (16,7%), P. gingivalis, T. denticola, S. mutans, S. sanguis, S. oralis (15,0%) и P. gingivalis, S. mutans, S. sanguis, S. oralis, S. sobrinus (15,0%). Заключение. Проведение молекулярно-генетических исследований у больных пародонтитом позволяет обосновать этиологический диагноз заболевания, назначить адекватную антибактериальную терапию.
Похожие темы научных работ по клинической медицине , автор научной работы — Тамарова Эльмира Рифовна, Зулькарнаева А. Р., Мавзютов А. Р.
Molecular-genetic characteristics of the oral microflora in cases of periodontitis
Objective. Estimation of the prevalence associated with periodontitis pathogenic and conditionally pathogenic microorganisms in patients with chronic forms of periodontitis . Materials and methods. The contents of the periodontal pockets and teeth of saliva in 60 patients with periodontitis of moderate severity were examined. The species-specific composition of the major periodontopathogenic bacteria ( P. gingivalis, T. denticola, S. oralis, S. sanguis, S. mutans, S. salivarius, S. sobrinus, S. macacae ) using the method of polymerase chain reaction were estimated. Results. It was found a combination of several types of bacteria in the contents of the periodontal pockets and teeth of saliva. The most frequent community are: S. mutans, S. sanguis, S. oralis (16,7%), p. gingivalis, T. denticola, S. mutans, S. sanguis, S. oralis (15,0%) and p. gingivalis, S. mutans, S. sanguis, S. oralis, S. sobrinus (15,0%). Conclusion. Molecular-genetic examination of patients with parodontitis allows to substantiate the etiological diagnosis of disease, to assign adequate antibacterial therapy.
Текст научной работы на тему «Микрофлора полости рта при воспалительных заболеваниях пародонта»
Уральское отделение РАН Оренбургский научный центр УрО РАН
Бюллетень Оренбургского научного центра УрО РАН
© Коллектив авторов, 2014 УДК 616.314.17-008.1-036
Э.Р. Тамарова А.Р. Зулъкарнаева, А.Р. Мавзютов
МИКРОФЛОРА ПОЛОСТИ РТА ПРИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЯХ ПАРОДОНТА
Башкирский государственный медицинский университет, Уфа, Россия
Цель. Изучить распространенность ассоциированных с пародонтитом патогенных и условно-патогенных микроорганизмов у пациентов с хроническими формами пародонтита.
Материалы и методы. У 60 пациентов с пародонтитом средней степени тяжести исследовано содержимое пародонтального кармана зубов и слюны. Изучен видовой состав основных пародонтопатогенных бактерий (P. gingivalis, T. denticola, S. oralis, S. sanguis, S. mutans, S. salivarius, S. sobrinus, S. macacae) с использованием метода полимеразной цепной реакции.
Резулътаты. В содержимом пародонтального кармана зубов и слюны обнаружено сочетание несколько видов бактерий. Наиболее часто встречаются сообщества: S.mutans, S. sanguis, S. oralis (16,7%), P. gingivalis, T. denticola, S. mutans, S. sanguis, S. oralis (15,0%) и P. gingivalis, S. mutans, S. sanguis, S. oralis, S. sobrinus (15,0%).
Заключение. Проведение молекулярно-генетических исследований у больных пародонтитом позволяет обосновать этиологический диагноз заболевания, назначить адекватную антибактериальную терапию.
Ключевые слова: пародонтит, микрофлора, полимеразная цепная реакция.
E.R. Tamarova, A.R. Zulkarnaeva, A.R. Mavzyutov
MOLECULAR-GENETIC CHARACTERISTICS OF THE ORAL MICROFLORA IN CASES OF PERIODONTITIS
Bashkir State Medical University, Ufa, Russia
Objective. Estimation of the prevalence associated with periodontitis pathogenic and conditionally pathogenic microorganisms in patients with chronic forms of periodontitis.
Materials and methods. The contents of the periodontal pockets and teeth of saliva in 60 patients with periodontitis of moderate severity were examined. The species-specific composition of the major periodontopathogenic bacteria (P. gingivalis, T. denticola, S. oralis, S. sanguis,
S. mutans, S. salivarius, S. sobrinus, S. macacae) using the method of polymerase chain reaction were estimated.
Results. It was found a combination of several types of bacteria in the contents of the periodontal pockets and teeth of saliva. The most frequent community are: S. mutans, S. sanguis, S. oralis (16,7%), P. gingivalis, T. denticola, S. mutans, S. sanguis, S. oralis (15,0%) and P. gingivalis, S. mutans, S. sanguis, S. oralis, S. sobrinus (15,0%).
Conclusion. Molecular-genetic examination of patients with parodontitis allows to substantiate the etiological diagnosis of disease, to assign adequate antibacterial therapy.
Key words: periodontitis, microflora, polymerase chain reaction.
В настоящее время воспалительные заболевания пародонта являются одной из важнейших проблем стоматологии вследствие широкой распространенности заболевания среди взрослого населения и высокой частотой возникновения рецидивов [1, 2]. Современный уровень научных знаний об этиопатогенезе пародонтита, определяет пародонтальную микрофлору в качестве доминирующего этиологического фактора. Среди причинных микроорганизмов наиболее часто встречаются Treponema denticola, Porphyromonas gingivalis, Streptococcus mutans, S. sanguis, S. sobrinus, S. oralis, S. salivarius и S. macacae, которых считают «маркерными» микроорганизмами пародонтита. Особенности их метаболизма и патогенность могут оказывать влияние на течение воспалительного процесса [1, 3]. В последние годы в клиническую диагностику микрофлоры полости рта внедрен ряд высокоспецифичных и высокочувствительных методов, среди которых наиболее широкое распространение получила полимеразная цепная реакция (ПЦР). Однако в отечественной научной литературе исследования, в которых применялся этот метод для диагностики микрофлоры при пародонтите, немногочисленны 5.
В связи с этим целью настоящего исследования явилось изучение распространенности ассоциированных с пародонтитом патогенных и условнопатогенных микроорганизмов у пациентов с хроническими формами пародонтита.
Материалы и методы
Проведено микробиологическое обследование 60 пациентов (26 мужчин и 34 женщины) в возрасте от 18 до 72 лет с пародонтитом средней степени тяжести, не имевших тяжелой «фоновой» патологии внутренних органов и систем, которая могла бы оказать заметное влияние на течение патологического процесса в пародонте. Из них 41 (68,3%) больной обратился за помощью впервые, а остальные 19 (31,7%) человек ранее лечились и обращались за помощью 1 раз в год.
Материалом для исследования служили содержимое пародонтального кармана зубов и слюна. Содержимое пародонтального кармана отбирали из наиболее глубоких участков с помощью стерильных бумажных эндодонтиче-ских штифтов (размер № 25), которые затем помещали в пробирку с физиологическим раствором. Одновременно в другую пробирку собирали слюну.
Поученные образцы транспортировали в лабораторию в охлажденном состоянии.
Поиск нуклеотидных последовательностей пародонтопатогенных микробов (P. gingivalis, T. denticola, S. oralis, S. sanguis, S. mutans, S. salivarius, S. sobrinus, S. macacae) для подбора праймеров осуществляли в международном банке Genbank (www.ncbi.nlm.nih.gov). Выравнивание сиквенированных последовательностей, подбор праймеров и оптимальных условий для ПЦР проводили с использованием компьютерных программ Megalain и PrimerSelect пакета программ DNAStar (Lasergene, США), любезно предоставленных Институтом биохимии и генетики УНЦ РАН. ДНК указанных представителей пародонтопатогенной микрофлоры выявляли методом полимеразной цепной реакции (ПЦР). ДНК выделяли с использованием реагента «Челикс». Амплификацию ДНК проводили на термоциклере Терцик МС-2 (ООО «НПО ДНК-Технология», Россия) с использованием стандартных наборов для амплификации («Интерлабсервис», Россия) согласно инструкции производителя. Амплифицированные фрагменты ДНК разделяли электрофоретически в горизонтальном 2,0% агарозном геле, окрашивали бромидом этидия и визуализировали при освещении ультрафиолетом в фотодокументационной системе.
Результаты и обсуждение
У больных хроническим пародонтитом в содержимом пародонтального кармана при пародонтите обнаружены все исследованные микроорганизмы. Наиболее распространены были бактерии Streptococcus mutans, которые выявлялись у 48 (80,0%) из 60 обследованных больных. Следует отметить широкую представленность S. sanguis и S. oralis, частота обнаружения которых превысила 50-53,3% и 51,7% соответственно. Остальные микроорганизмы встречались заметно реже. В то же время Porphyromonas gingivalis наблюдалась в 21 (35,0%) случае, а Treponema denticola - в 15 (25,0%) случаях, S. sobrinus - в 13 (21,7%) случаях, а частота Streptococcus salivarius и S. macacae составила 15,0% (9 больных).
Подобная тенденция по содержанию микроорганизмов наблюдалась и в образцах слюны больных пародонтитом. Максимальная представленность обнаружена для S. mutans (51 человек - 85,0%). Доля больных с S. sanguis и S. oralis составила 39 (65,0%) человек и 37 (61,7%) человек соответственно. Об-
ращает на себя внимание несколько более высокая частота встречаемости в слюне бактерий S. salivarius и S. sobrinus по сравнению с материалом паро-донтального кармана зубов - соответственно 28 (46,7%) и 25 (41,7%) случаев, однако эти различия оказались статистически незначимыми.
У пациентов с пародонтитом средней степени тяжести в исследованных биотопах полости рта наблюдались сочетания несколько видов бактерий. Наиболее часто встречающийся состав сообщества включал S. mutans, S. sanguis, S. oralis - у 1G (16,7%) человек. Второе место (9 человек, 15,G%) разделили два сообщества, в состав которых входили: 1) P. gingivalis, T. denticola, S. mutans, S. sanguis, S. oralis и 2) P. gingivalis, S. mutans, S. sanguis, S. oralis, S. sobrinus. Сочетание бактерий T. denticola, S. mutans, S. sanguis, S. oralis, S. sobrinus установлено у 7 (11,7%) пациентов, тогда как частота других сообществ микроорганизмов не превышала 5%.
У больных пародонтитом в содержимом пародонтального кармана зубов и слюны достаточно часто имеет место сочетание несколько видов бактерий. Проведение молекулярно-генетических исследований у больных пародонтитом позволяет обосновать этиологический диагноз заболевания, назначить адекватную антибактериальную терапию, направленную на санацию пациента от возбудителей.
1. Грудянов А.И., Овчинникова В.В. Профилактика воспалительных заболеваний паро-донта. М: МИА, 2GG7. 8G с.
2. Лукиных Л.М., Круглова Н.В. Хронический генерализованный пародонтит. Часть I. Современный взгляд на этиологию и патогенез. Стоматология. 2G11. 1: 123-125.
3. Николаева Е.Н., Царев В.Н., Щербо С.Н. и др. Применение новой тест-системы, основанной на полимеразной цепной реакции, в пародонтологии. Клиническая стоматология. 2GG4. 4: 63-67.
4. Царев В.Н., Ушаков Р.В. Антимикробная терапия в стоматологии. М.: Медицинское Информационное Агентство, 2GG4. 143 с.
Читайте также:

