Недостаток витамина в12 вызывает болезнь цинга
Опубликовано: 15.05.2024

Гиповитаминоз B12 – это заболевание, обусловленное недостаточным содержанием в организме витамина B12. Проявляется анемией, воспалением и жжением языка, образованием покраснений на коже, повышенной утомляемостью, бессонницей, снижением аппетита, болями в животе, расстройством желудка, похуданием, онемением пальцев и мышечными болями. При длительном течении болезни возможно развитие энцефалопатии, паралича и остеопороза. Диагностика основывается на данных клинического опроса и результатах исследования витамина в венозной крови. Для лечения используется заместительная терапия витаминными препаратами, коррекция рациона.
МКБ-10
- Причины
- Патогенез
- Симптомы гиповитаминоза В12
- Осложнения
- Диагностика
- Лечение гиповитаминоза В12
- Прогноз и профилактика
- Цены на лечение
Общие сведения
Витамины B12 – кобальтосодержащие биологически активные вещества, кобаламины. Данная группа соединений представлена цианокобаламином, гидроксокобаламином, метилкобаламином и кобамамидом. Значительная часть витамина попадает в организм в виде цианокобаламина, поэтому можно встретить использование названия этого вещества как синонима витамина B12. Синонимичные названия гиповитаминоза B12 – витаминная недостаточность B12, недостаточность внешнего фактора Касла. Заболевание наиболее распространено среди пациентов пожилого и старческого возраста. Согласно эпидемиологическим данным, гиповитаминозом B12 страдает не менее 15% людей старше 60 лет.

Причины
В норме витамин B12 направляется в желудок, а затем в кишечник с пищей. Он образует комплекс со специальным ферментом – внутренним фактором Касла, благодаря чему становится усваиваемым и всасывается клетками эпителия в подвздошной кишке. В слизистой оболочке кишечника соединение связывается с транспортным белком транскобаламином. Основное место хранения витамина – печень. Большое количество потребляется мышцами, селезенкой и почками. Витамин выводится желчным пузырем, в кишечнике повторно абсорбируется. Гиповитаминоз B12 развивается при нарушении одного или нескольких звеньев метаболизма соединения. Причинами заболевания являются:
- Дефицит в рационе. Основными поставщиками витамина считаются продукты животного происхождения, поэтому гиповитаминоз чаще диагностируется у вегетарианцев и людей, длительно соблюдающих строгие диеты. Цианокобаламин депонируется печенью и селезенкой, его запасы достаточно велики, для развития дефицита требуется от 3 до 5 лет.
- Невозможность абсорбции. Гиповитаминозу способствуют заболевания тонкой кишки, нарушающие всасывание витамина – целиакия, болезнь Крона, ахлоргидрия, а также сокращение реабсорбирующей поверхности кишки после резекции. Частой причиной гиповитаминоза является врожденная недостаточность внутреннего фактора или транскобаламина.
- Быстрое выведение или распад. Патологии почек и печени, алкоголизм препятствуют накоплению витамина, усиливают его выведение. Потеря витамина происходит при глистных инвазиях, например, при заражении широким лентецом.
- Усиление потребления организмом. Риск гиповитаминоза повышается в третьем триместре беременности и в период выздоровления после острых заболеваний. Метаболизм витамина усиливается при гипертиреозе, тиреотоксикозе, альфа-талассемии и гемолитической анемии.
Патогенез
Кобаламины выступают коферментами реакции трансметилирования – переноса метильной группы CH3. В результате многоэтапного процесса образуется тетрагидрофолиевая кислота, необходимая для метаболизма белков и нуклеиновых кислот. При ее дефиците ослабляется синтез пуринов, тимидина, ДНК, РНК и белков в клетках. Таким образом, недостаточность витамина B12 способствует сокращению производства наиболее часто обновляемых клеток – клеток крови и эпителия.
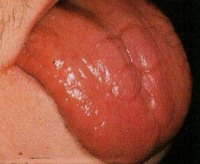
Патологически изменяется процесс кроветворения: в костном мозге образуются крупные, но незрелые эритроциты, неспособные переносить кислород к тканям. Развивается мегалобластная анемия. Снижение скорости обновления эпителиальных клеток проявляется поражениями пищеварительного тракта: атрофируется слизистая оболочка желудка, сокращается выделение пепсина и соляной кислоты, язык становится ярко-красным, гиперчувствительным к химическим раздражителям. Витамин B12 участвует в образовании миелина, гиповитаминоз сопровождается неврологическими расстройствами. У больных развиваются дистальные парестезии, боли, нарушения походки и чувствительности, усиливаются сухожильные рефлексы.
Симптомы гиповитаминоза В12
Дефицит витамина B12 имеет полиморфную симптоматику, проявляется нарушениями сразу в нескольких системах организма. Ключевым признаком заболевания является B12-дефицитная анемия, при которой пациенты испытывают общую слабость, головные боли, одышку, тошноту, рвоту и диарею. Нередко возникают отеки, покраснения и болевые ощущения на языке (глоссит), очаговые поражения кожи, особенно в дистальных отделах конечностей. Слабое кровоснабжение головного и спинного мозга у детей провоцирует задержку физического и психического развития: наблюдается отставание в росте, медленное формирование двигательных навыков, мышечная слабость и трудности в обучении.
Расстройства нервной системы представлены хронической усталостью, частыми головными болями, головокружениями, снижением интеллектуально-мнестических функций и внимания, депрессией и раздражительностью. Неврологические синдромы включают боли, чувство покалывания и онемения конечностей, нарушения разных видов чувствительности. Со стороны желудочно-кишечного тракта наблюдаются запоры, увеличение размеров печени, воспаление слизистой оболочки двенадцатиперстной кишки и желудка, образование язв в этих отделах. Сердечно-сосудистые симптомы встречаются реже: снижается артериальное давление, повышается риск атеросклероза.
Осложнения
При отсутствии лечения длительный гиповитаминоз B12 приводит к тяжелым заболеваниям ЦНС. Усиление дегенеративных процессов провоцирует развитие паралича нижних конечностей, ослабляет нормальные рефлекторные реакции и обуславливает патологические рефлексы. Постепенно формируется энцефалопатия с ослаблением когнитивных функций вплоть до деменции и амнезии. У пожилых больных возникают галлюцинаторно-бредовые расстройства. Недостаток витамина негативно сказывается на состоянии опорно-двигательного аппарата: истончается костная ткань, наблюдается остеопороз.
Диагностика
Обследование назначается при подозрении на мегалобластную анемию, недоедание, пациентам с синдромом мальабсорбции, целиакией, болезнью Крона и алкоголизмом, пожилым людям с симптомами депрессии, паранойи и спутанности сознания. В зависимости от имеющейся симптоматики диагностика проводится врачом-гематологом, неврологом или гастроэнтерологом. Включает дифференциацию B12-дефицитной анемии с другими видами анемий, позволяет определить причину неврологических нарушений и психических расстройств в пожилом возрасте. Для подтверждения диагноза гиповитаминоза используются следующие процедуры:
- Клинический опрос. В беседе пациенты предъявляют жалобы, характерные для анемического и неврологического синдрома: слабость, головокружения, одышка в сочетании с ощущением онемения и покалывания в ногах, снижением чувствительности в конечностях. В анамнезе может отмечаться приверженность вегетарианству и строгим диетам, недоедание, хронические заболевания кишечника и синдром мальабсорбции.
- Общий анализ крови. В результатах анализа определяется сниженный уровень эритроцитов и гемоглобина, гиперхромия, макроцитоз, пойкилоцитоз, лейкопения, тромбоцитопения, лимфоцитоз, сниженное или нормальное количество ретикулоцитов. Микроскопия эритроцитов выявляет наличие телец Жолли и колец Кебота.
- Анализ на витаминB12. Исследуется концентрация витамина в сыворотке крови из вены. При гиповитаминозе итоговый показатель менее 191 пг/мл. Понижение концентрации витамина B12 подтверждает его недостаточность, но не коррелирует с тяжестью анемии или нейропатии.
- Исследование костномозгового пунктата. В отдельных случаях требуется проведение пункции красного костного мозга. О макроцитарнаой анемии свидетельствует наличие мегалобластов в образце биоматериала.
Лечение гиповитаминоза В12
При выраженном гиповитаминозе терапия проводится в стационаре гематологического или терапевтического отделения. Медикаментозное лечение основано на внутримышечном или внутривенном введении препаратов цианокобаламина. В тяжелых случаях необходимы интралюмбальные инъекции. При легких формах, вызванных исключительно пищевым дефицитом витамина, показан пероральный прием лекарств без госпитализации. Вместе с цианокобаламином назначаются препараты фолиевой кислоты. Курс лечения продолжается 1-2,5 месяца. Дополнительно используется диетотерапия, в ежедневный рацион больных вводятся продукты богатые витамином B12 – печень, мясо, рыба, яйца, сыр.
Прогноз и профилактика
Заместительная терапия цианокобаламином позволяет за 2 недели устранить неврологическую симптоматику гиповитаминоза, за 8 недель – сократить дефицит витамина и заполнить депо организма. При своевременном начале лечения до развития осложнений прогноз благоприятный. С целью профилактики рецидивов заболевания пациентам назначается введение цианокобаламина внутримышечно 1 раз в неделю. Для предупреждения первичного развития гиповитаминоза необходимо придерживаться полноценного питания, включающего ежедневный прием мяса, субпродуктов, рыбы, яиц и сыра. Больным с нарушением абсорбции питательных веществ в желудочно-кишечном тракте требуется соответствующее лечение и регулярный мониторинг уровня витаминов в кровотоке.
Цинга – это заболевание группы авитаминозов, служащее клиническим проявлением дефицита витамина C. Основные симптомы – кровоточивость и набухание десен, поражение кожных покровов (сухость, петехии на конечностях с синеватым оттенком), костно-суставной системы (гемартроз, расшатывание зубов c дальнейшим их выпадением). Диагноз устанавливается на основании характерных клинических признаков, анамнестических данных, рентгенологического исследования. Лечение заключается в заместительной терапии аскорбиновой кислотой, соблюдении диеты с достаточным содержанием данного витамина.
МКБ-10
- Причины цинги
- Факторы риска
- Патогенез
- Классификация
- Симптомы цинги
- Осложнения
- Диагностика
- Дифференциальная диагностика
- Лечение цинги
- Диетотерапия
- Медикаментозное лечение
- Прогноз
- Профилактика
- Цены на лечение
Общие сведения
Цинга (скорбут, болезнь Меллера-Барлоу) возникает только при недостатке аскорбиновой кислоты. Ее название происходит от греческой приставки «а», обозначающей отрицание, и латинского корня «scorbutus – «цинга». В 1932 году было доказано противоцинготное действие витамина С. Вплоть до XX века от данного заболевания гибли миллионы человек. В настоящее время цинга встречается редко, в основном среди крайне бедных и неблагополучных слоёв населения с иррациональной культурой питания. Вспышки возможны во время длительных экспедиций, военных действий, в учреждениях закрытого типа. Частота развития и степень тяжести не зависят от возраста и пола.

Причины цинги
Аскорбиновая кислота, обладающая множеством биохимических функций, не синтезируется эндогенно в организме человека. Всасывание витамина С происходит в 12-ти перстной кишке, затем он накапливается в железистой ткани (преимущественно в мозговом слое надпочечников и щитовидной железе). Необходимые запасы данного вещества у взрослых составляют около 1500 мг. Причинами возникновения цинги могут являться:
- Нарушение всасывания витамина С. Усвоение аскорбиновой кислоты непосредственно связано с правильной работой желудочно-кишечного тракта. В условиях нарушения пристеночного переваривания (деструктивные изменения кишечного эпителия, например, при глистных инвазиях) и полостного пищеварения (панкреатит, длительная диарея) всасывание витамина снижается или полностью прекращается.
- Недостаточное поступление. Данная причина реализуется при несоблюдении ежедневного разнообразного питания, но она маловероятна, так как аскорбиновая кислота содержится практически во всех овощах, фруктах, ягодах. Суточная потребность составляет 70-100 мг для взрослых и 30-70 мг для детей. При абсолютном дефиците витамина цинга развивается в период от 4-х до 12-ти недель.
Факторы риска
К факторам риска развития цинги относятся беременность и лактация, тяжёлый физический труд, инфекционные болезни, которые приводят к чрезмерной активации симпатоадреналовой системы. В таком состоянии усиливается катаболизм (распад) всех веществ, в том числе – аскорбиновой кислоты. Алкоголизм, табакокурение снижают адаптационные возможности организма, что влечёт за собой увеличение потребности в витамине С.
Патогенез
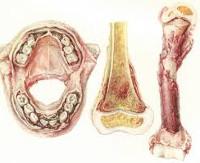
Витамин С участвует в окислительно-восстановительных процессах, отвечает за синтез и распад многих веществ. При цинге происходят аберрации в механизме образования коллагена – фибриллярного белка, составляющего основу соединительной ткани. При его дефекте тормозится активность остеобластов, нарушается структурирование белковых матриц и, как следствие, снижаются процессы окостенения.
Эндотелиальная выстилка сосудов также представлена коллагеном, который обеспечивает её морфофункциональную целостность и отвечает за процессы гемостаза. В результате дефектов эндотелия увеличивается проницаемость сосудистой стенки, что клинически проявляется кровотечениями различной локализации.
Аскорбиновая кислота принимает участие в образовании гемоглобина, осуществляя переход трёхвалентного железа в двухвалентное, которое становится пригодным для реабсорбции (всасывания). При дефиците железа нарушается цикл образования гема, развивается микроцитарная гипорегенераторная анемия. Недостаток витамина С приводит к снижению активности кофермента тетрагидрофолата, отвечающего за метаболизм фолиевой кислоты. На фоне таких изменений наблюдаются лабораторные признаки мегалобластной анемии.
Классификация
Систематизация форм цинги осуществляется по клиническим проявлениям, этиологическому фактору. Она может быть первичной (экзогенной) – возникающей на фоне алиментарной недостаточности витамина С, вторичной (эндогенной), вызванной повышенной потребностью и нарушением всасывания. По критерию тяжести различают 3 степени:
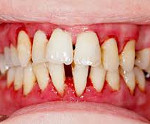
- Лёгкая. Проявляется слабостью, утомляемостью. При осмотре кожа с бледным оттенком по типу «гусиной» в результате увеличения волосяных луковиц. Характерно поражение слизистой оболочки рта: возникает гиперемия межзубных сосочков, кровоточивость. В дальнейшем припухлость распространяется на всю поверхность дёсен, они становятся разрыхлёнными.
- Средняя. Клинически проявляется болью в мышцах, преимущественно нижних конечностей, гиподинамией. Кожа становится грязно-синего цвета, вокруг волосяных фолликулов визуализируется огромное количество экхимозов – кровоизлияний с диаметром больше 3 мм. Характерно развитие афтозного стоматита, дёсны приобретают сине-багровый оттенок, зубы расшатываются и выпадают.
- Тяжёлая. Развивается резкая слабость, адинамия. Наблюдаются кровоизлияния в серозные полости (перикард, плевру), полость суставов, мышцы. При данной форме возникают язвенный стоматит, гингивит. Часто отмечается артериальная гипотензия, слабость пульса.
Симптомы цинги
Клинические проявление цинги начинаются с общей слабости, утомляемости. Снижение прочности коллагена капилляров и венул служит причиной петехий на конечностях, часто сопровождающихся перифолликулярным гиперкератозом. Отмечаются кровоизлияния в слизистые оболочки (геморрагический пародонтит), толщу мышц, что клинически проявляется миалгией различной степени. При попадании крови в полость сустава развивается характерный для цинги гемартроз, преимущественно коленный. Возникают распирающие боли, сустав увеличивается в объеме, при значительном скоплении геморрагического экссудата наблюдается сглаживание контура.
В результате дефицита Fe2+ в организме происходит снижение уровня железосодержащих ферментов (цитохрома, пероксидазы), что проявляется сидеропеническим синдромом: извращением вкуса, пристрастием к острой, пикантной пище. Развиваются дистрофические изменения ногтей, они становятся тонкими, тусклыми, появляется исчерченность; волосы редеют, легко ломаются. Сниженный уровень железа приводит к анемии с её классической клиникой: головокружение, недомогание, тахикардия.
Изменения эндокринной системы представлены гипофункцией мозгового вещества надпочечников. Дефицит катехоламинов приводит к артериальной гипотензии, нарушению нервной проводимости, усиливая проявления имеющейся анемии. Частые вирусные, бактериальные инфекции возникают на фоне иммуносупрессии, всегда имеющейся при цинге. За счёт угнетения остеогенеза ослабевает фиксация зубов, что приводит к их выпадению.
В раннем детском возрасте цинга проявляется болезнью Меллера-Барлоу. Наблюдаемые нарушения окостенения выражаются деформацией грудной клетки, места перехода хрящевой ткани рёбер в костную утолщаются, образуя «чётки». Отмечаются искривления трубчатых костей, изменения в них приводят к повреждению костного мозга – этим объясняется угнетение гемопоэза и усиление кровоточивости. Как и у взрослых, имеются кожные проявления – кровоизлияния в кожу, слизистые оболочки, носовые кровотечения.
Осложнения
Как правило, осложнения связаны с присоединением вторичной инфекции, так как очаги кровоизлияний являются благоприятной средой для размножения микроорганизмов. На языке, миндалинах образуется гнойный налёт, возникает некроз слизистой оболочки. Дефекты коллагена и геморрагический выпот в суставы сопровождаются контрактурами, анкилозами. В некоторых случаях кровь из сосудов пропотевает в полость перикарда, наблюдается геморрагический перикардит с переходом в тампонаду сердца. Кровоизлияния в желудочки мозга, межоболочечные пространства сопровождаются повышением внутричерепного давлением с риском развития дислокационного синдрома.
Диагностика
Поскольку клинические проявления цинги достаточно специфичны, диагностика не представляет особых трудностей. Обследование проводят врач-гастроэнтеролог, стоматолог и специалисты других профилей в зависимости от картины заболевания. Осложнения цинги представляют реальную угрозу для жизни больного, поэтому необходима своевременная диагностика, которая имеет следующую стадийность:
- Клинический опрос и осмотр. Пациенты жалуются на проявления анемического и геморрагического синдромов: быструю утомляемость, слабость, кровоточивость различной локализации. Анамнез характеризуется наличием хронических заболеваний ЖКТ, отсутствием в рационе продуктов с высоким содержанием витамина С. Кожные покровы бледные с множеством петехий. Определяется кровоточивость десен, расшатывание зубов, деформации костей.
- Инструментальные исследования. При отсутствии чётких данных, указывающих на алиментарную недостаточность витамина С, проводится ФГДС, колоноскопия. При подозрении на панкреатит, гепатит необходимо УЗИ брюшной полости. Для исключения или подтверждения кровоизлияний в серозные и суставные полости применяется рентгенографии ОГК, суставов. Ранним рентгенологическим признаком цинги является общий остеопороз костной ткани.
- Лабораторные исследования. В анализах крови обнаруживаются изменения, характерные для железодефицитной анемии. В копрограмме ‒ признаки мальдигестии, мальабсорбции. Определение концентрации аскорбиновой кислоты в плазме является незаменимым методом в спорных случаях. Референсные значения витамина С в крови составляют 4-20 мкг/мл.
Дифференциальная диагностика
Дифференциальная диагностика требует исключения заболеваний, представленных синдромом геморрагического диатеза:
- врождённых форм дефицита факторов свёртывания крови (гемофилии, болезни Стюарта-Прауэра):
- приобретённых форм – при циррозе печени, геморрагических лихорадках (Крымской, Эбола).
Экссудативный перикардит, возникающий при цинге, необходимо дифференцировать с инфарктом миокарда.
Лечение цинги
Терапевтические мероприятия определяются степенью тяжести цинги. Лечение лёгкой степени проводится под контролем диетолога в амбулаторных условиях с соблюдением рационального питания. Средняя и тяжёлая степени требуют обязательной госпитализации в терапевтический стационар, назначения лечебного питания, постельного режима, коррекции сопутствующих расстройств.
Диетотерапия
Основным немедикаментозным методом лечения цинги является диетотерапия. Она включает обязательный расчёт суточной калорийности, соотношения основных макро-, микронутриентов с учётом возрастно-половых, профессиональных особенностей и соблюдение составленного рациона. Он представлен продуктами, богатыми витамином С, в большинстве своём растительного происхождения: листовые овощи (белокочанная и брюссельская капуста, брокколи), красный плоды (томаты, перец), цитрусовые фрукты. Рекордсмен по содержанию аскорбиновой кислоты - сухой шиповник, в 100 г которого содержится 1200 мг витамина С.
Медикаментозное лечение
При средней и тяжёлой степени тяжести наряду с диетой требуется медикаментозная терапия, целью которой является коррекция обмена витаминов, купирование болевого синдрома и неотложных состояний. Для этого используются лекарственные средства различных фармакологических групп. При цинге применяются следующие виды лечения:
- Этиотропное. Основное медикаментозное воздействие нацелено на лечение заболеваний ЖКТ. Назначаются ферментные препараты, содержащие панкреатин, компоненты желчи и энзимы неживотного происхождения. При глистных инвазиях проводится дегельминтизация в зависимости от вида возбудителя. В случае алиментарной недостаточности витамина С назначается аскорбиновая кислота в таблетках и парентерально в течение 1 месяца.
- Симптоматическое. Терапия направлена на остановку кровотечений: с этой целью применяются хлорид кальция, аминокапроновая и транексамовая кислота. В тяжёлых случаях выполняется переливание эритроцитарной массы, плазмы. Железодефицитная анемия корректируется препаратами железа. При миалгии используются местные и системные НПВС, обладающие достаточным анальгезирующим эффектом.
Прогноз
Своевременно начатая рациональная терапия неосложнённой формы авитаминоза С даёт благоприятные перспективы для жизни, выздоровления и трудоспособности. Прогноз ухудшается при цинге средней и тяжёлой степени, становясь сомнительным в случае массивных кровоизлияний в серозные полости и неблагоприятным при кровоизлиянии в мозг. Присоединение вторичной инфекции, обострение сопутствующих заболеваний существенно ухудшает прогноз.
Профилактика
Основную и главную роль в профилактике гипо-, авитаминоза составляет диета. Немаловажным аспектом является санитарно-просветительская работа, которая заключается в пропаганде здорового образа жизни, консультировании по вопросам рационального и сбалансированного питания. Компенсация соматической патологии ЖКТ, санация очагов хронической инфекции, назначение витаминных комплексов лицам из группы риска представляют собой важнейшие меры, предупреждающие развитие цинги.

До XX века от этой болезни умирали миллионы людей ежегодно. Цинга (скорбут) начиналась обычно с кровоточивости десен, часто преследовала путешественников и узников тюрем. В 1932 году, наконец, обнаружили, что главная ее причина — авитаминоз. Точнее, — острый дефицит аскорбиновой кислоты в организме. В настоящее время патология достаточно изучена и успешно лечится. Большинству она известна из истории и научных источников, но все еще диагностируется у скудно питающихся и страдающих пищеварительными нарушениями людей.
Факторы появления цинги
Витамин С не синтезируется эндогенно и должен поступать с пищей ежедневно. Во избежание дефицита детям требуется около 40–60 мг, а взрослым — около 100 мг в сутки. При курении, во время беременности, при инфекционных заболеваниях и интенсивных физических нагрузках потребность возрастает в 1,5–2 раза. Запас аскорбинки в течение нескольких суток сохраняется в железистой ткани надпочечников, излишки выводятся почками.
Гиповитаминоз, провоцирующий цингу, развивается по нескольким причинам:
нарушение структуры кишечного эпителия;
тяжело протекающие глистные инфекции;
нарушение выработки пищеварительных ферментов (панкреатит, гастриты).
Во всех этих случаях витамин С, поступающий с пищей, не всасывается в организм, проходя через него транзитом. Это главная причина эндогенной (вторичной) цинги. Недостаток или отсутствие аскорбиновой кислоты в рационе — более редкий фактор патологии. Общеизвестно, что витамин С содержится во всех видах свежих ягод, фруктов, овощей, корнеплодов и зелени. Поэтому к экзогенному авитаминозу и первичной цинге приводит крайне скудное питание, лишенное всех полезных продуктов. Такая ситуация характерна для экстремальных ситуаций и регионов, в которых наблюдается гуманитарная катастрофа.
Механизм развития и симптомы болезни
Недостаток витамина С вызывает появление первых симптомов цинги в течение 4–12 недель. Нарушается всасывание железа, образование гемоглобина, усвоение фолиевой кислоты. Затем следует ряд системных реакций:
замедляется белковый обмен;
увеличивается проницаемость сосудистых стенок — возникают кровотечения;
развивается мегабластная анемия;
снижаются процессы восстановления и формирование костных тканей.
В зависимости от времени возникновения и продолжительности различают несколько степеней тяжести болезни:
Легкая. Проявляется покраснением слизистой рта, утолщением и разрыхлением десен, кровоточивостью межзубных сосочков. Возможна точечная гиперемия и бледность кожных покровов, физическая слабость, быстрая утомляемость, сонливость.
Средняя. Развивается афтозный стоматит: десны и слизистая рта опухают, становятся багровыми, зубы расшатываются, могут выпадать во время еды. Кожа приобретает синюшный оттенок. В области волосяных фолликулов появляются темные очаги кровоизлияний. Резко снижается работоспособность, больные испытывают боли в мышцах, суставах. Возможны спазмы и судороги нижних конечностей, тахикардия.
Тяжелая. Внешне проявляется язвенным стоматитом, обильной кровоточивостью десен. Фиксируются также внутренние кровотечения: в полости суставов, плевры. У больных отмечается низкое артериальное давление, они теряют способность передвигаться, испытывают резкую слабость и головокружение. Характерные симптомы цинги на запущенной стадии: резкие распирающие боли в коленях, распухание суставов, остеопороз.
У больных цингой расслаиваются и ломаются ногти, выпадают волосы, появляется тяга к острой пище или различные извращения вкуса. У маленьких детей развивается синдром Меллера-Барлоу:
из-за нарушения окостенения скелета искривляются трубчатые кости, возникают сколиозы и кифозы;
в местах переходов в костные фрагменты реберные хрящи утолщается, образуя рельефные «четки».
Осложненное течение болезни характеризуется вторичным инфицированием и некрозом слизистых, образованием глубоких язв. Поражение суставов сопровождается ограничением или полной потерей их подвижности. В тяжелых случаях вероятно нарушение внутричерепного давления, смерть от кровоизлияния в головной мозг или геморрагического перикардита.
Диагностика цинги
Предварительный диагноз устанавливается на основе первичного осмотра, жалоб больного, изучения анамнеза. Для подтверждения и установления степени тяжести болезни проводят инструментальные обследования:
УЗИ внутренних органов;
В лабораторных показателях крови косвенным признаком цинги является железодефицитная анемия. В копрограмме — диагностирование мальабсорбции. Ключевое значение имеет концентрация аскорбиновой кислоты в плазме.
Методы лечения цинги
При легкой форме первичной болезни, спровоцированной дефицитом витамина С в пище применяют диетотерапию. Помогает рацион, обогащенный зелеными овощами, различными видами фруктов и ягод. Лечение дополняют препаратами аскорбиновой кислоты, которые назначают перорально и в форме инъекций.
В зависимости от состояния организма больных проводят сопутствующую терапию соматических нарушений: назначают прием ферментов, противовоспалительных, антимикробных препаратов, НПВС. На начальной стадии проводят амбулаторное лечение. В тяжелых случаях пациентов госпитализируют, применяют инфузионную терапию, переливание плазмы крови.
Прогноз зависит от общего физического состояния, возраста больных и изменений, к которым привела болезнь. Как правило, нарушенные функции кроветворения и обменные процессы восстанавливаются успешно. С трудом поддаются лечению поражения суставов, сердца, мозга, костной системы. Необратимые нарушения чаще характерны для пожилых и страдающих системными патологиями людей.
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Ниже приведена классификация недостатка витамина В12 с обозначением наиболее важных патофизиологических механизмов и клинических обстоятельств их воздействия. Различаются количественная нехватка (абсолютная или относительная), когда поступающее во внутреннюю среду организма количество витамина оказывается недостаточным для нормальных потребностей (в первом случае), увеличенным за счет перерасхода или чрезмерного удаления (во втором случае), и дефицит расхода, когда имеющийся в наличии витамин не может участвовать в соответствующих биохимических реакциях.
| Природа недостатка витамина В12 | Механизмы, обусловливающие недостаток витамина В12 | Клиника |
| I. Количественный недостаток витамина В12 — абсолютный | а) недостаточный подвоз с пищей (редко) | суровая продолжительная неполноценность питания; абсолютный вегетарианский режим питания |
| б) недостаточная кишечная обработка в) недостаточное выделение из пищевых продуктов | синдром «плохого пищеварения» (при кишечных заболеваниях, болезнях поджелудочной железы, желудочно-кишечном соустьи и пр.) | |
| г) потребление в кишечнике: кишечными бактериями кишечными паразитами | аномальное размножение бактерий в условиях застоя (сужение, дивертикул, выключенная петля) обсеменение глистами | |
| д) недостаточное поглощение витамина В12: - за счет отсутствия внутреннего фактора - посредством аутоиммунного механизма - за счет генетического недостатка - по причине удаления сецерни-рующего субстрата - за счет незакрепления В12-ВФ на рецепторах подвздошной кишки - за счет заниженного рН — в связи с врожденным дефектом рецепторов — за счет нарушения чрезклеточного переноса — в связи с удалением кишечника — по причине гистологических поражений — за счет внутриклеточных поражений | - болезнь Бирмера, отдельные виды «ювенильной» злокачественной анемии - врожденный дефицит внутреннего фактора - полное иссечение желудка (редко частичное), атрофическое воспаление желудка (гастрит культьи), рак желудка - недостаточность поджелудочной железы, синдром Цоллингера-Эллисона - иссечение подвздошной кишки - терминальный илеит (нетрописечкий спру, спру, недостаток белков в пище) - облучение, алькоголизм, после применения ПАСК, колхицина, неомицина; недостаток фолиевой кислоты | |
| II. Количественный недостаток витамина В12 — относительный | а) увеличенный расход (редко) б) увеличенное выделение | беременность, гипертиреоз, гиперактивное кроветворение; новообразования (в частности миелопролиферативные болезни и миелома (возможно при печеночно-клеточных поражениях) |
| III. Недостаточное использование витамина В12 | — недостаточный перенос с плазмой — неполноценность связывания и отложения | макроцитная анемия с реакцией на В12+нормальная плазма цирроз печени |
| а) блокирование ферментивных реакций: б) структурными аналогами витамина В12 в) за счет врожденной недостаточности ферментов (редко) | кобалоксим, амидо- и анилидозамещение (экспериментально) недостаток метилмалонилСоА-мутазы, недостаток СН3.FH4-гомоцистеин метилтрансферазы. |
Благодаря относительно крупным — по сравнению с суточной потребностью — клеточным запасам истощение последних наступает поздно, под влиянием некоторых патогенетических факторов постоянного характера. Вот почему недостаточный подвоз с пищей и высокий расход витамина В12 значительно реже приводят к мегалобластической анемии, чем в случае недостатка фолиевой кислоты, при этом наибольшую практическую значимость представляет категория нарушения поглощения, в том числе на первое место выступает болезнь Бирмера.
Располагаем скудными данными о «метаболическом блокаже» витамина В12 (в том числе генетические энзимопатии).
Специфические клинические и лабораторные признаки недостатка витамина В12 будут описаны одновременно с болезнью Бирмера, при которой они выделяются наиболее полно. По существу они заключаются в мегалобластической анемии (характеристика которой уже была описана), невропатии с изменением миелинового вещества (патогенез еще не выяснен и роль избытка неметаболизированных пропионовой и метилмалоновой кислот не доказана), наличии малого количества витамина В12 в крови, выделении увеличенного количества АММ с мочой и характерной гематологической реакции после назначения витамина В12 в физиологических дозах.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Выделяют наследственные и приобретенные формы витамин В12-дефицитной анемии.
Наследственные формы витамин В12 дефицитных анемий
Встречаются редко. Клинически характеризуются типичной картиной мегалобластной анемии с наличием симптоматики поражения желудочно-кишечного тракта и нервной системы.
Причины врожденных (наследственных) форм витамин В12-дефицитной анемии
- Нарушение абсорбции витамина В12
- Недостаточная секреция внутреннего фактора:
- врожденный дефицит внутреннего фактора
- количественный
- качественный
- ювенильная псриицнозная анемия (аутоиммунная)
- ювенильная периициозная анемия (антитела против слизистой оболочки желудка) с аутоиммунной полиэндокринопатией
- ювенильная пернициозная анемия с дефицитом IgA
- врожденный дефицит внутреннего фактора
- Недостаточное всасывание в тонком кишечнике (селективная мальабсорбция витамина В12).
- аномальный внутренний фактор
- нарушение транспорта кобаламина к энтероцитам (синдром Имерслунд - Гресбека)
- Недостаточная секреция внутреннего фактора:
- Нарушение транспорта витамина В12
- Врожденный дефицит транскобаламнна II
- Транзиторный дефицит транскобаламина II
- Парциальный дефицит транскобаламина I
- Нарушение метаболизма витамина В12
- Дефицит аденозилкобаламнна: болезни кобаламина А и В
- Дефицит метилмалонил-КоА-мутазы (mut°, mut
)
- Комбинированный дефицит аденозилкобаламина и метил-кобаламнна: болезни кобаламина С, D и F
- Дефицит метилкобаламнна: болезни кобаламина Е и G.
Нарушение абсорбции витамина В12
Заболевания наследуются аутосомно-рецессивно, часты родственные браки. Установлено, что ген внутреннего фактора человек локализован на хромосоме It; локус синдрома Имерслунд-Гресбека расположен на хромосоме 10. Симптомы заболевания обычно появляются постепенно. У детей отмечают вялость или раздражительность, беспокойство; снижение аппетита вплоть до анорексии; замедление весовых прибавок, отставание в физическом развитии. Возможны тошнота, рвота, диарея. Постепенно нарастает бледность кожных покровов и слизистых, появляется субиктеричность. Характерны афтозный стоматит, глоссит, гепатоспленомегалия. Типичными являются неврологические нарушения - гипорефлексия, появление патологических рефлексов, атаксия, дефекты речи, парестезии, возможно развитие клонуса и комы. Лабораторно у больных снижена концентрация витамина В12 в сыворотке крови, отмечается метилмалоновая ацидурия. Лечение проводят парентеральным введением больших доз витамина В12 (1000 мкг внутримышечно ежедневно не менее 2 нед); после нормализации клинической и гематологической картины заболевания поддерживающая терапия витамином В12 проводится на протяжении всей жизни (1000 мкг внутримышечно 1 раз в месяц). Больным с наследственным дефицитом ВФ помимо парентерального введения витамина В12, назначают заместительную терапию внутренним фактором человека.
Нарушение транспорта витамина В12
Врожденный дефицит транскобаламина II (ТК II)
ТК является основным транспортным средством для витамина В12, врожденная его недостаточность наследуется аутосомно-рецессивно и сопровождается нарушением абсорбции и транспорта витамина. Клинические проявления заболевания отмечаются в возрасте 3-5 нед и характеризуются появлением вялости, снижением аппетита, замедлением весовых прибавок с развитием гипотрофии, могут быть рвота, диарея; наблюдаются рецидивирующие инфекции, обусловленные иммунной недостаточностью и клеточного, и гуморального типов; позднее появляется поражение нервной системы. В периферической крови отмечается прогрессирующая панцитопения - выраженная мегалобластная анемия с нейтропенией, тромбоцитопенией. Уровень кобаламина в сыворотке крови обычно нормальный. Отмечаются гомоцистинурия и метилмалоновая ацидурия. Для диагностики дефицита ТК II используют ионообменную хроматографию или сывороточный электрофорез на полиакриламидном геле с меченным "Со В12. Так как ТК II синтезируется амниоцитами, возможна пренатальная диагностика дефицита ТК II.
Наследственные витамин В12-дефицитные анемии, обусловленные нарушением абсорбции витамина
Наслед-ственный дефицит внутреннего фактора (врожденная пернициозная анемия)
Ювенильная пернициозная анемия (аутоиммунная)
Ювенильная пернициоз-ная анемия с аутоиммунной полиэндо-кринопатией или селективным дефицитом IgA
Синдром Имерслунд-Гресбека (эссенциальная эпителионатии с синдромом мегалобластной анемии)
Врожденное отсутствие синтеза ВФ или врожденные дефекты в молекуле ВФ
Наличие антител, блокирующих секрецию ВФ слизистой желудка
Наличие антител, блокирующих секрецию ВФ слизистой желудка
Нарушение транспорта комплекса ВФ-В12к энтероцитам вследствие отсутствия рецепторов для комплекса ВФ-В12
Сроки появления симптомов
Первые 2 года жизни, иногда у подростков и взрослых
9 мес - 5 лет (сроки истощения запасов витамина В12, приобретенных плодом внутриутробно)
10 лет и старше
Первые 2 года жизни, иногда позднее
Гистология слизистой оболочки желудка
Слизистая не изменена
Слизистая не изменена
Лечение: 1000 мкг витамина В12 внутримышечно 2 раза в неделю. После нормализации клинической и гематологической картины заболевания проводится поддерживающая терапия - по 250-1000 мкг витамина В12 ежемесячно в течении всей жизни.
Парциальный дефицит транскобаламина I (TK I)
Описан парциальный дефицит ТК I (также известен как «R-binder» или гаптокоррин). Концентрация витамина В12 в сыворотке крови у таких больных очень низкая, но клинико-гематологических признаков дефицита витамина В12 нет, поскольку у больных отмечается нормальный уровень ТК И. Концентрация ТК I составляет 2 5 - 5 4 % от нормы. Клинически заболевание проявляется миелопатией, которую нельзя объяснить другими причинами.
Нарушения метаболизма витамина В12
Кобаламин является кофактором двух внутриклеточных ферментов - метилмалонил-КоА-мутазы и гомоцистеин-метионинметилтрансферазы (метионинсинтетазы).
Метилмалонил-КоА-мутаза - фермент митохондрий, осуществляет диссимиляцию метионина и других аминокислот - валина, изолейцина, треонина на стадии изомеризации метилмалонил-КоА в сукцинил-КоА. При недостаточности витамина В12 снижается активность метил-малонил-КоА-мутазы, что приводит к нарушению пропионатного пути обмена аминокислот. Промежуточный метаболит - метилмалонат - экскретируется из организма, не превращаясь в сукцинил-КоА и, следовательно, не поступая в цикл Кребса, с которым связан обмен аминокислот, углеводов, липидов.
Метионинсинтетаза катализирует перемещение метильных групп от N-метилтетрагидрофолата к гомоцистеину с образованием метионина; одновременно обеспечивает поддержание в активном состоянии фолатной системы, осуществляющей перенос одноуглеродистых соединений в обмене гистидина, биосинтезе пуринов, тимидина и, соответственно, в синтезе нуклеиновых кислот. При недостатке витамина В12 ресинтез метионина данной системой прекращается, а фолиевая кислота накапливается в виде неиспользуемого в других реакциях метилтетрагидрофолата. Данный фермент содержится в активно пролиферирующих клетках костного мозга и эпителия.
Уменьшение активности метилмалонил-КоА-мутазы сопровождается повышенной экскрецией метилмалоновой кислоты. Снижение активности метионинсинтетазы приводит к пшергомоцистеинемии и гомоцистеинурии. Метилмалоновая ацидурия характеризуется тяжелым метаболическим ацидозом с накоплением большого количества кислот в крови, моче, ликворе. Частота составляет 1 : 6 1 000.
Все нарушения метаболизма кобаламина наследуются аутосомно-рецессивно; различаются по клиническим проявлениям; возможна их пренатальная диагностика. Дефекты кобаламинов А, В, С, Е и F у плода определяют, используя культуру фибробластов, или биохимически в амниотической жидкости или моче матери. В некоторых случаях бывает успешным назначение кобаламина in utero.
Дефицит аденозилкобаламина: болезни кобаламина А и В.
В клетках больных не синтезируется аденозилкобаламин, что обусловливает развитие метилмалоновой ацидурии без гомоцистинурии. В первые недели или месяцы жизни у больных развивается тяжелый метаболический ацидоз, приводящий к задержке развития ребенка. Отмечаются гипогликемия, гиперглицинемия. Концентрация витамина В12 в сыворотке крови нормальная, мегалобластная анемия отсутствует.
Лечение: гидроксикобаламин или цианокобаламин по 1 000-2 000 мкг внутримышечно 2 раза в неделю в течение всей жизни.
Выделяют 2 типа дефицита фермента:
- mut" - активность фермента не определена;
- mutr - резидуальная активность фермента, которая может быть стимулирована высокими дозами кобаламина. Возникает метилмалоновая ацидурия, обусловливающая появление тяжелого метаболического ацидоза. Клинически отмечаются повторные рвоты, приводящие к эксикозу, мышечная гипотония, апатия, отставание в развитии. Уровень кетонов, глицина, аммония в крови и моче повышен. У многих больных отмечается гипогликемия, лейкопения, тромбоцитопения. Лечение: в диете ограничивают количество белка (исключить поступление аминокислот - валина, изолейцина, метионина и треонина). Карнитин назначают тем больным, у которых выявляют его дефицит. Для уменьшения выработки пропионата в кишечнике анаэробными бактериями назначают линкомицин и метронидазол. Несмотря на терапию, у больных возможно развитие осложнений: инфарктов базальных ганглиев, тубулоинтерстициального нефрита, острого панкреатита, кардиомиопатии.
Комбинированный дефицит аденозилкобаламина и метил-кобаламина: болезни кобаламина С, D и F
У больных не синтезируется как метилкобаламин (что приводит к гомоцистинурии и гипометионинемии), так и аденозилкобаламин (что приводит к метилмалоновой ацидурии), что обусловливает дефицит активности метилмалонил-КоА-мутазы и метионинсинтетазы. Заболевание начинается в первые годы жизни. Клинически имеются мегалобластная анемия, отставание в физическом развитии, задержка умственного развития, апатия, возможны судороги, делирий. Отмечаются гидроцефалия, легочное сердце, печеночная недостаточность, пигментная ретинопатия. Больные с ранним началом заболевания могут погибнуть в первые месяцы жизни, при позднем начале заболевания прогноз более благоприятный. Лечение: большие дозы витамина В12 (1 000-2 000 мкг) внутримышечно 2 раза в неделю постоянно.
Дефицит синтеза метилкобаламина: болезни кобаламина Е и G
Нарушение синтеза метилкобаламина приводит к снижению активности метионинсинтетазы, что обусловливает развитие гомоцистинурии и гипометионинемии обычно без метилмалоновой ацидурии, хотя при болезни кобаламина Е может наблюдаться транзиторная метилмалоновая ацидурия. Заболевание начинается в первые два года жизни, иногда у взрослых. Клинически отмечается мегалобластная анемия, отставание в развитии, неврологические нарушения, нистагм, гипотония или гипертония, инсульт, слепота, атаксия. Лечение: гидроксикобаламин по 1 000-2 000 мкг парентерально 1-2 раза в неделю. Возможна пренатальная диагностика болезни кобаламина Е, при подтверждении диагноза матери со второго триместра беременности назначают витамин В12 парентерально 2 раза в неделю.
Приобретенные формы витамин В12-дефицитной анемии
Встречаются значительно чаще, чем наследственные.
Причины приобретенных витамин В12-дефицитных анемий:
Неадекватное поступление витамина В12.
- Дефицит витамина В12 у матери (вегетарианство, пернициозная анемия, спру), приводящий к дефициту витамина B12в грудном молоке - мегалобластная анемия у детей на грудном вскармливании развивается в 7-24 мес (иногда в более раннем возрасте).
- Алиментарная недостаточность витамина В12 (содержание в диете
Читайте также:

