Основные белки межклеточного матрикса тканей пародонта
Опубликовано: 16.04.2024
Внеклеточный матрикс (межклеточный) (англ. extracellular matrix, ECM) —внеклеточные структуры ткани. Внеклеточный матрикс составляет основу соединительной ткани, объединяет разрозненные клетки в единый многоклеточный организм, обеспечивает механическую поддержку клеток и транспорт химических веществ.
ВКМ словно «государство» для клеток: он отвечает за их благополучие и управляет всеми аспектами жизни, от питания и размножения до смерти.
Компоненты ВКМ синтезируют специализированные клетки. В соединительной ткани наиболее распространены фибробласты, но создавать ВКМ умеют и другие клетки: в хрящах, например, это хондроциты, в костях - остеобласты.
Компоненты матрикса могут синтезировать и клетки прилегающих органов: например, клетки эпителия сосудов производят компоненты рыхлой соединительной ткани.
Межклеточный матрикс выполняет разнообразные функции:
- обеспечивает механические контакты между клетками,
- образует механически прочные структуры, такие, как кости, хрящ, сухожилия и суставы,
- составляет основу фильтрующих мембран (например, в почках),
- изолирует клетки и ткани друг от друга (например, обеспечивает скольжение в суставах и движение клеток),
- формирует пути миграции клеток, вдоль которых они могут перемещаться, например, при эмбриональном развитии.
Таким образом, межклеточный матрикс чрезвычайно вариабелен как по химическому составу, так и по выполняемым функциям.
Металлопротеиназы – белки, наводящие порядок в ВКМ, разрушители его компонентов. Они «чистят путь» клеткам, которые движутся в ВКМ, и уничтожают старые и «сломанные» компоненты матрикса.
Основные компоненты внеклеточного матрикса - гликопротеины, протеогликаны и гиалуроновая кислота. В состав внеклеточного матрикса входит множество других компонентов: белки интегрин, фибронектин, фибрин, эластин и др. Коллаген является превалирующим гликопротеином внеклеточного матрикса.
Гликопротеины - двухкомпонентные белки, в которых белковая (пептидная) часть молекулы ковалентно соединена с одной или несколькими группами гетероолигосахаридов.
Доля углеводов не превышает 20%, углеводные цепи короткие, имеют нерегулярное строение и не содержат уроновых кислот.
Это такие важные структурные белки, как коллаген и эластин. Благодаря коллагену ВКМ приобретает прочность, а эластин дает гибкость и эластичность.
Протеогликаны – высокомолекулярные соединения, состоящие из белка (5–10%) и гликозаминогликанов (90–95%). Это строение объясняет их высокую молекулярную массу, также они образуют основное вещество межклеточного матрикса.
Они запасают воду и полезные вещества, выполняют функцию «магазина», из которого клетки получают необходимые «продукты». Кроме того, протеогликаны играют роль межтканевых прослоек и смазочного материала в суставах.
Интегрины - трансмембранные гетеродимерные клеточные рецепторы, взаимодействующие с внеклеточным матриксом и передающие различные межклеточные сигналы. От них зависит форма клетки, её подвижность, они участвуют в регулировке клеточного цикла.
С помощью таких взаимодействий в клетках активируются сигнальные каскады, регулирующие экспрессию генов, отвечающие за пролиферацию и дифференцировку клеток, их выживание или апоптоз.
Структурно интегрины представляют собой облигатные гетеродимеры: каждый состоит из одной α- и одной β-субъединицы.
Интегрины улавливают химические и физические сигналы из внеклеточного матрикса и проводят их в клетку. Сигнал от интегринов передается в ядро через белки цитоскелета и сигнальные белки — это способ управления внеклеточного матрикса экспрессией генов и регулировка клеточной пролиферации. При посредничестве белков цитоскелета ВКМ также управляет формой и движениями клеток.
Фибронектины - адгезивные белки. Интегрины превращают фибронектины в нерастворимые нити - компоненты внеклеточного матрикса. Они помогают клеткам закрепляться на поверхностях и отвечают за их рост и перемещение в ВКМ
Молекулы фибронектинов - димеры сходных между собой полипептидных цепей (250 кДа), связанных дисульфидными связями. Субъединицы подразделяются на ряд различных «доменов» способных связываться с клеточными рецепторами, коллагенами, фибрином и протеогликанами. Такая особенность строения фибронектинов придает им свойство «молекулярного клея».
Гиалуроновая кислота (гиалуронат) - несульфированный гликозаминогликан, входящий в состав соединительной, эпителиальной и нервной тканей. Является одним из основных компонентов внеклеточного матрикса, содержится во многих биологических жидкостях (слюне, синовиальной жидкости и др.).
Синтезируется встроенными в мембрану белками и затем «выдавливается» через нее в межклеточное пространство. По составу ГК похожа на углеводную часть протеогликана - это полимер из остатков D-глюкуроновой кислоты и D-N-ацетилглюкозамина. ГК помогает интегринам проводить сигналы в клетку, регулирует клеточный ответ на эти сигналы и, как фибронектин, дает клеткам возможность закрепляться на различных поверхностях.
Внеклеточный матрикс есть во всех тканях организма, поэтому сбои в его функционировании ведут к развитию болезней соединительной ткани, преждевременному старению и гибели клеток. Для лечения заболеваний, связанных с нарушениями структуры соединительной ткани, необходимо изучать ВКМ. Таких болезней множество, они могут протекать тяжело и значительно ухудшать качество жизни пациентов.
Первые признаки старения, которые сразу заметны - слабость, хрупкость костей, появление морщин и возрастной пигментации. Многие из этих проблем связаны с необратимыми изменениями во внеклеточном матриксе.
Одна из причин старения кожи - нарушение работы фибробластов (клеток, синтезирующих компоненты ВКМ). При этом благополучие фибробластов зависит от состояния внеклеточного матрикса, получается замкнутый круг.
Источники: https://biomolecula.ru/, http://www.chem.msu.su/
Телефоны Учебного центра "Олта": 8-812-248-99-34, 8-812-248-99-38, 8-812-243-91-63, 8-929-105-68-44

Среди заболеваний пародонта ведущие позиции занимает генерализованный пародонтит (ГП), который является актуальной проблемой современной стоматологии, учитывая его высокую распространенность, сложность патогенеза и непродолжительную эффективность большинства современных лечебных мероприятий.
По данным различных исследований, распространенность заболеваний пародонта в настоящее время достигает 95%. Более половины населения имеют симптомы пародонтита I-II степени тяжести, а 10% лиц страдают ГП III степени. Результаты статистически достоверных исследований свидетельствуют, что самый высокий уровень заболеваемости приходится на возраст 35-44 года и 15-19 лет.
За последние десятилетия увеличилось количество фундаментальных трудов отечественных и зарубежных авторов, посвященных выяснению причинно-следственных связей развития воспалительных и дистрофически-воспалительных заболеваний тканей пародонта с участием инфекционных, иммунных, наследственных, травматических и других агентов на фоне анатомо-топографической специфики тканей полости рта. Однако в литературе недостаточно внимания уделено изучению роли отдельных компонентов межклеточного матрикса костной ткани пародонта в норме, в патологическом состоянии и на этапах заживления.
Структура экстрацеллюлярного матрикса ткани пародонта, как сложная сеть в виде полужидкого геля, состоит преимущественно из коллагеновых белков, протеогликанов и гликопротеинов. В образовании этого матрикса участвуют клетки-фибробласты, хондробласты, остеобласты, одонтобласты, цементобласты и др.
Заодно матрикс содержит молекулы, которые обладают способностью образовывать комплексы. Поэтому специализированной формой внеклеточного матрикса тканей в норме является базальная мембрана, которая образует дискретную структуру, отделяющую одну клеточный слой от другой. Основу экстрацеллюлярного матрикса составляет семейство коллагеновых белков, которое относится к гликопротеинам и содержит остатки глицина, пролина и гидроксипролина.
Какие-либо нарушения в синтезе коллагеновых белков в тканях пародонта клинически проявляются в виде признаков воспаления — отек и кровоточивость десен, сопровождающих формирование пародонтальных карманов, появление гноетечения, возникновение подвижности зубов и их выпадение. Среди причин, которые обуславливают появление данных изменений, выделяют разные аутоиммунные состояния, генетические дефекты, дефицит аскорбиновой кислоты, ионов меди и многие другие.
Типы белков костной ткани пародонта и их функции
Наряду с коллагеновыми белками в межклеточном матриксе имеющиеся и неколлагеновые — эластин, гликопротеины, протеогликаны и др. Гликопротеины — это сложные белки, в состав которых входит углеводный компонент. Белок в этих соединениях является своеобразной основой, к которой надежно присоединены гликаны цепи. В соответствии с особенностями химического строения гликопротеины можно разделить на истинные гликопротеины и протеогликаны (гликозаминопротеогликаны).
Главная разница между ними заключается в том, что углеводные группировки истинных гликопротеинов имеют обычно 15-20 моносахаридних компонентов, которые не образуют повторяющихся олигосахаридных фрагментов, тогда как в протеогликанах эти группировки построены из большого количества единиц, повторяющиеся и в основном имеющих своеобразный дисахаридный характер. Чаще всего такой дисахарид содержит глюкозамин или галактозамин в сульфатированном или несульфатированном виде и уроновую кислоту (глюкуроновую или идуронову).
Немногочисленные исследования зарубежных авторов проведены в направлении изучения метаболических процессов в органическом матриксе костной ткани, в частности одного из компонентов — протеогликанов, которые обеспечивают консолидацию коллагеновых волокон и их связь с кристаллами минералов.
Среди многочисленных функций гликопротеинов выделяют:
Функция высокоспецифического взаимодействия и узнавания молекул.
Транспортная функция, в том числе перенос металлов и гидрофобных молекул.
Функция катализатора, то есть регуляция биологического действия ферментов.
Структурно-механическая функция и поддержание эластичности тканей.
Гидроосмотическая и ионорегулирующая функция.
Среди гликопротеинов костной ткани пародонта важная роль отводится остеонектину, остеопонтину, костному сиалопротеину, костному кислому гликопротеину-75, Gla-белкам (остеокальцину и матриксному Gla-белку). Белки минерализованных тканей пародонта составляют основу для прикрепления минералов и определяют процессы минерализации.
Особенностью таких белков является наличие остатков фосфосерина, глутамата и аспартата, способные связывать ионы кальция и участвовать в образовании кристаллов апатита. Другая особенность заключается в наличии углеводных остатков и последовательности аминокислотных остатков арг-гли-асп в первичной структуре белков, обеспечивающих связывание их с клетками и белками, которые формируют экстрацеллюлярный матрикс.
Остеонектин — это гликопротеин, который в большом количестве присутствует в минерализованной части тканей пародонта. Данный белок синтезируется остеобластами, фибробластами, одонтобластами, в небольшом количестве хондроцитами и эндотелиальными клетками. В N-концевом звене молекулы остеонектина находится значительное количество отрицательно заряженных аминокислот, а также прослеживается до 12 участков связывания ионов кальция, который входит в состав гидроксиапатита.
Через углеводный компонент остеонектин связывается с коллагеном I типа. Остеонектин не только обеспечивает взаимодействие компонентов матрикса, но и регулирует пролиферацию клеток, участвует в процессах развития и созревания минерализованных тканей.
Остеопонтин — это белок из несколько повторов, обогащенных аспаргиновой кислотой, которые дают ему свойство связываться с кристаллами гидроксиапатита. Средний участок молекулы содержит последовательность арг-гли-асп, отвечающую за прикрепление клеток. Этот белок играет ведущую роль в построении минерализированного матрикса, взаимодействия клеток и матрикса, в транспорте неорганических ионов.
Костный сиалопротеин — специфический белок минерализованных тканей, который состоит из углеводов и подвергается многочисленным химическим модификациям в реакциях сульфатирования тирозина. В составе костного сиалопротеина содержится до 30% фосфорилированных остатков серина и повторяющейся последовательности глутаминовой кислоты, участвующих в связывании ионов кальция.
Костный сиалопротеин обнаруживается во всех минерализованных компонентах пародонта (костная ткань, дентин, цемент корня), в частности, в гипертрофированных хондроцитах или остеокластах. Он отвечает за прикрепление клеток и минерализацию матрикса.
Костный кислый гликопротеин-75 — белок, который ингибирует процессы резорбции в минерализованных тканях, обнаружен в костной ткани альвеолярного отростка, дентине зуба и хрящевой ростковой пластинке. Функции продолжают изучаться.
Остеокальцин (костный глутаминовой белок) связывает ионы кальция, которые используются для образования кристаллов гидроксиапатита.
В процессах ремоделирования костной ткани альвеолярного отростка активное участие принадлежит остеопротегерину — гликопротеину, который относится к рецепторам фактора некроза опухоли и подавляет мобилизацию, пролиферацию и активацию остеокластов.
Еще одним компонентом экстрацеллюлярного матрикса тканей пародонта служат неколлагеновые белки протеогликаны. Этот класс сложных белков построен из стержневых белков, к которым через N- и О-гликозидные связи присоединяются олигосахариды, соединенные с цепями гликозаминогликанов (ГАГ).
Протеогликаны отличаются размерами, относительным содержанием белка и конкретным набором гликозаминогликанов. Протеогликаны выполняют роль рецепторов в построении экстрацеллюлярного матрикса, облегчают прикрепление и регулируют процессы роста клеток. Они образуют комплексы с белками, включая факторы роста.
В комплексах белки надежно защищены от протеолитических ферментов. Такие комплексы выполняют функции резервуаров, которые неблагоприятных условиях высвобождают фактор роста и позволяют ему проявлять свою биологическую активность.
При общем сохранении биомеханических и физиологических особенностей соединительной ткани пародонтального комплекса его жизнедеятельность определяется поддержанием баланса между процессами биосинтеза и деградации коллагенов и протеогликанов.
Распад и синтез протеогликанов регулируют такие гормоны, как соматотропин, тироксин, инсулин, а также цитокины (интерлейкин-1 и другие), витамины А и С, микроэлементы и различные факторы роста.
В тканях пародонта факторами роста обычно выступают небольшие полипептиды, стимулирующие или ингибирующие пролиферацию отдельных типов клеток:
Трансформирующий фактор роста бета.
Костный морфогенетический белок.
Фактор роста эндотелия.
Инсулиноподобный фактор роста.
Фактор роста фибробластов.
Фактор роста тромбоцитов и др.
Протеогликаны, в частности версикан, бигликан, декорин и синдекан, в значительном количестве представлены в тканях пародонта (цементе корня, дентине или пульпе зуба, периодонтальной связке, компактной части альвеолы и слизистой десен). В связке протеогликанов со специфическими белками главная роль принадлежит гликозаминогликанам.
Роль сульфатированных гликозаминогликанов при пародонтите
Гликозаминогликаны (ГАГ), которые относятся к гетерополисахаридам, представлены в виде линейных структур и состоят с дисахаридных единиц, которые периодически повторяются. Молекула дисахарида состоит из уроновой кислоты и аминосахара, аминогруппа которого обычно ацетилированная. Наличие сульфатных и карбоксильных групп в ГАГ наделяет их значительным отрицательным зарядом и способностью связывать воду.
Благодаря высокой плотности отрицательного заряда на их поверхности, они связывают катионы кальция, натрия и калия; принимают участие в минеральном обмене. Структуру тканей пародонта поддерживают такие сульфатированные гликозаминогликаны:
В лечении заболеваний пародонта особое внимание исследователей привлекают препараты на основе хондроитина сульфата, глюкозамина гидрохлорида и гиалуроновой кислоты.
Благодаря своим уникальным физико-химическим свойствам, в частности способности образовывать протеогликанов агрегаты, эти гликозаминогликаны способны обеспечивать многочисленные функции соединительной ткани, включая трофическую, барьерную, пластическую и репаративную.
Изучая влияние лекарственных препаратов на основе ГАГ на дистрофически-воспалительный процесс в пародонте, установлено, что глюкозамина гидрохлорид является специфическим субстратом, способным подавлять образование супероксидных радикалов и ферментов, которые вызывают повреждения тканей (коллагеназы и фосфолипазы).
Глюкозамина гидрохлорид предотвращает разрушительное действие глюкокортикоидов на хондроциты и активирует синтез ГАГ, активно участвует в построении коллагеновых волокон и межклеточного матрикса в целом, стимулирует пролиферацию хондроцитов и других клеток соединительной ткани, улучшает сосудистую микроциркуляцию.
Также глюкозамина гидрохлорид проявляет антиоксидантное действие благодаря химической структуре молекулы, которой присущи высокая реакционная способность и превалирование восстановительных свойств над окислительными.
Препараты на основе хондроитина сульфата снижают активность ферментов, разрушающих соединительную ткань, поэтому стимулируют процессы репарации, снижая активность воспалительного процесса в пародонте на ранних стадиях и способствуют уменьшению болевой реакции.
Установлено, что хондроитина сульфат увеличивает экспрессию OPG в остеобластах субхондральной костной ткани, вызывает повышение соотношения OPG / RANKL и в итоге снижает костную резорбцию. В тканях пародонта из несульфатированных ГАГ гиалуроновая кислота образует комплексы с белками и служит биологическим цементом, заполняя пространство между клетками.
Считают, что главная функция гиалуроновой кислоты в соединительной ткани состоит в связывании воды. Вследствие подобного сообщения межклеточное вещество приобретает характер желеобразного матрикса, способного «поддерживать» клетки.
Важную роль играет гиалуроновая кислота и в регуляции проницаемости тканей. Сетка из гиалуроновой кислоты в виде геля является своеобразным фильтром, который задерживает микробные и другие крупные молекулы, попадающие в организм. Разрыв гликозидных связей в цепях гиалуроновой кислоты вызывает ее деполимеризацию. В результате фильтровальная система нарушается, между клетками попадают различные молекулы, включая крупные. Накапливается межклеточное жидкость, которая удерживается неразрушенным полимером — развивается отек тканей.
Клетки организма выделяют в межклеточное пространство специальный фермент гиалуронидазу, который может повышать межклеточную проницаемость. По этой причине гиалуронидазу называют фактором проницаемости. Некоторые бактерии содержат фермент наподобие гиалуронидазы, что дает им возможность проникать из кровяного русла в межклеточное пространство.
В патогенезе гингивита и пародонтита важна биопленка, под воздействием которой активность кислых и слабокислых протеиназ в зубных отложениях и тканях десны увеличивается в 4-5 раз. Такой процесс сопровождается деградацией гликопротеинов и других белков тканей пародонта.
Ферменты бета-глюкуронидаза, гиалуронидаза, бета-N-ацетилгексозаминидаза и хондроитинсульфатаза активно участвуют в расщеплении кислых ГАГ и гликопротеинов межклеточного вещества, оболочек клеток пародонта, в результате способствуют разрушению циркулярной связи и тканей пародонта в целом.
Деградация компонентов экстрацеллюлярного матрикса и деструкция тканей пародонта вызывается также повышенной активностью матриксных металлопротеиназ (MMП). Они составляют большую группу структурно родственных ферментов, которые расщепляют большинство белков внеклеточного матрикса и базальной мембраны.
При агрессивном течении пародонтита деструктивные процессы всего за нескольких месяцев приводят к необратимой потере ткани пародонта на всех уровнях. Одноврменно с этим, ММП отведена важная роль в развитии остеопоротического процесса костной ткани.
Эта группа ферментов активно задействована в процессах деградации цепей взаимодействия факторов роста, цитокинов и веществ, участвующих в апоптозе и клеточной адгезии. Вместе с другими внеклеточными протеиназами ММП задействованы в воспалительном процессе, реализации иммунного ответа, коагуляции, физиологической перестройке тканей.
Однако в условиях патологического процесса ММП вызывают повреждения тканей на всех уровнях. Причиной повышения активности матриксных металлопротеиназ при данных условиях считают дисбаланс между ММП и их локально действующими ингибиторами — тканевыми ингибиторами матриксных металлопротеиназ (ТИМП).
В литературных источниках встречаются сообщения о изучения уровня ГАГ в крови для различных патологических состояний, сопровождающихся воспалительным процессом. В частности представлены сведения, которые свидетельствуют об информативности показателей метаболизма этих соединений при регенерации костной ткани.
Глубокое понимание роли факторов роста, цитокинов и внеклеточных матричных молекул в процессах заживления описано в работе DeCarlo и Whitelock, когда авторы изучали перлекан, внеклеточную молекулу. Была установлена ее важная роль в потенциале репаративных процессов костной ткани альвеолярного отростка, а именно стимулирующее влияние на клеточную адгезию, пролиферацию, дифференциацию и ангиогенез.
Вывод
Анализ обширных отечественных и зарубежных данных свидетельствует об активной роли несульфатированных и сульфатированных ГАГ при заболеваниях пародонта, в том числе в процессах репаративного остеогенеза тканей пародонта.
Заживление как комплексный динамический процесс реализуется с участием растворимых медиаторов, клеток крови, компонентов экстрацеллюлярного матрикса или высокоактивных клеток, участвующих в восстановлении и тканевой интеграции.
Фаза воспаления включает отек ткани, экстравазацию клеток крови и в итоге — формирование кровяного сгустка. Именно в этот момент первичного повреждения ткани в экстрацеллюлярного матрикса в свободном виде начинают определяться сГАГ, фибронектин, поперечно-сшитые формы фибрина, витронектин, тромбоспондин и медиаторы воспаления.
В сочетании с отеком ткани (сГАГ связывают много воды), эти факторы способствуют локализации воспаления, препятствуют его переходу на окружающие ткани, формируют своеобразный барьер на пути распространения инфекционного процесса.
Свободные сульфатированные гликозаминогликаны, которые связываются с рецепторами тромбоцитов, в комбинации с цитокинами на фоне высокой активности протеолитических ферментов, способствуют активации факторов роста. Среди них фактор роста фибробластов, фактор роста эндотелия, эпидермальный фактор роста и трансформирующий фактор роста.
Представлено обобщенное формулирование основных механизмов действия несульфатированных и сульфатированных ГАГ на пародонтальные структуры:
Угнетение синтеза липидов.
Подавление активности протеолитических ферментов.
Угнетение синергического действия ферментов и кислородных радикалов.
Снижение биосинтеза медиаторов воспаления за счет маскировки вторичных антигенных детерминант и угнетение хемотаксиса.
Ускоренное построение нормальных коллагеновых волокон.
Регуляция биосинтеза компонентов межклеточного матрикса.
Регуляция пролиферации клеток.
Улучшение процессов микроциркуляции.
Перестройка в структуре протеогликанов.
Регуляция хондро- и остеогенеза.
Вышеизложенные пункты позволяют понять, как исследования в области молекулярной и клеточной биологии повлияли на понимание течения патологических процессов в костной ткани, процессов репаративного остеогенеза и возможности их модуляции.
В современной пародонтологии перспективными считают новые подходы с применением природных регуляторов физиологических и патологических процессов, которые лишены любого токсического воздействия на клетки и ткани.
Именно таким перспективным агентом являются сульфатированные и несульфатированные гликозаминогликаны, область применения которых в пародонтологической практике актуальна и требует дальнейшего изучения.
• Межклеточные контакты представляют собой специализированные белковые комплексы благодаря которым соседние клетки вступают во взаимный контакт и сообщаются друг с другом
• Внеклеточный матрикс представляет собой плотную сеть, состоящую из белков, которая расположена между клетками и образована ими самими
• Клетки экспрессируют рецепторы для белков внеклеточного матрикса
• Белки внеклеточного матрикса и межклеточные контакты контролируют трехмерную организацию клеток в ткани, а также их рост, подвижность, форму и дифференцировку
Одним из наиболее важных событий в эволюции живых существ было появление многоклеточных организмов. Когда клетки выработали способ группироваться вместе, они приобрели способность образовывать сообщества, в которых различные клетки специализированы по функциям. Если, например, два одноклеточных организма «объединяют усилия», можно представить себе, что каждый из них будет специализироваться на выполнении определенных функций, необходимых для успешного роста и размножения, а остальные оставит своему партнеру.
Для образования простого многоклеточного организма или ткани более сложного организма клетки должны надежно прикрепляться друг к другу. Как показано на рисунке ниже, для клеток животных это прикрепление может достигаться тремя путями. Во-первых, клетки непосредственно прикрепляются друг к другу посредством образования межклеточных контактов, которые представляют собой специальные модификации клеточной поверхности соседних клеток. Эти контакты видны в электронном микроскопе. Во-вторых, клетки могут взаимодействовать между собой без формирования контактов, используя белки, которые не образуют такие специализированные области. В-третьих, клетки соединяются между собой непрямым образом, прикрепляясь к сети внеклеточного матрикса (ВКМ), который содержит молекулы, расположенные в межклеточной среде.
Прикрепление клеток происходит за счет образования контактов их поверхности с внеклеточным матриксом.
Однако формирование многоклеточного организма представляет собой не такую простую задачу, как скрепление нескольких клеток друг с другом. Правильное функционирование таких сообществ клеток обеспечивается их эффективным взаимодействием и разделением труда между ними. Межклеточные контакты представляют собой высокоспециализированные области, в которых клетки соединяются между собой посредством белковых комплексов, связанных с мембранами. Известно несколько различных типов межклеточных контактов, каждый из которых выполняет специфическую роль в сообщении клеток между собой.
Белки, образующие щелевые контакты, дают возможность клеткам непосредственно сообщаться друг с другом, образуя каналы, через которые происходит обмен малыми цитоплазматическими молекулами. Белки, формирующие плотные контакты, служат селективным барьером, который регулирует прохождение молекул через слой клеток и препятствует диффузии белков в плазматической мембране. Адгезивные контакты и десмосомы формируют механическую устойчивость, связывая цитоскелет контактирующих клеток, в результате чего слой клеток может функционировать как единое целое. Эти контакты могут служить передатчиками сигналов, переводя изменения клеточной поверхности в биохимические сигналы, которые распространяются по клетке.
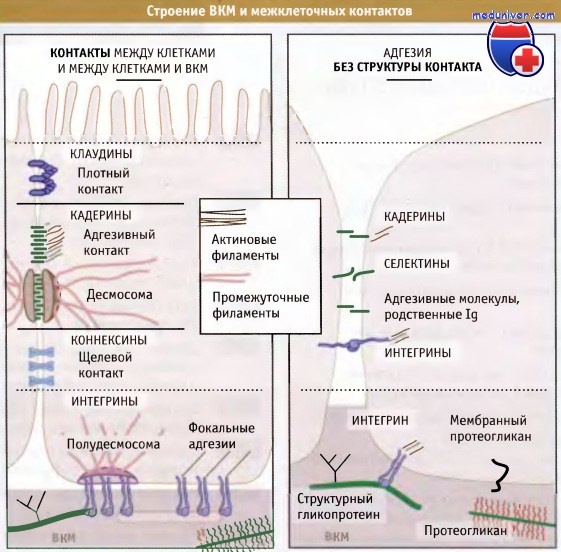
Схемы строения межклеточных контактов эпителиальных клеток (слева),
контактных адгезивных комплексов клеток неэпителиального происхождения (справа) и комплексов клеток с внеклеточным матриксом (внизу).
Показаны также основные классы компонентов внеклеточного матрикса (ВКМ).
Известны также различные типы белков, которые участвуют в бесконтактном взаимодействии клеток. К таким белкам относятся интегрины, кадерины, селектины и родственные иммуноглобулинам молекулы, обеспечивающие адгезию клеток.
Все клетки, даже самые примитивные одноклеточные организмы, обладают функциями узнавания внешнего окружения и взаимодействия с ним. Даже до появления клеточных сообществ клетки должны были прикрепляться к поверхности и перемещаться по ней. Таким образом, адгезивные структуры клеточного матрикса сформировались рано в эволюции. Как показано на рисунке ниже, у многоклеточных организмов пространство между клетками заполнено плотной структурой, состоящей из белков и сахаров, которая называется внеклеточным матриксом. Внеклеточный матрикс организован в виде волокон, слоев и пленочных структур.
В некоторых тканях внеклеточный матрикс находится в виде сложных слоев, которые называются базальной ламиной и непосредственно контактируют с клетками. Белки, входящие в состав внеклеточного матрикса, бывают двух типов: структурные гликопротеины, например коллаген и эластин, и протеогликаны. Эти белки придают тканям прочность и эластичность, а также служат селективным фильтром, контролирующим поток нерастворимых компонентов между клетками. Протеогликаны проявляют гидрофильные свойства и поддерживают между клетками водное окружение. Когда клетки мигрируют, внеклеточный матрикс функционирует как опорная структура, обеспечивающая их передвижение.
Клетки секретируют компоненты внеклеточного матрикса. Они сами образуют эту наружную опорную систему, и при необходимости могут изменять ее форму за счет деградации и замены окружающих участков матрикса. В настоящий момент вопросы контроля сборки и деградации внеклеточного матрикса представляют существенный интерес, поскольку они играют важную роль в развитии многоклеточных организмов, в заживлении ран, а также в образовании злокачественных опухолей.
Контакты клеток с внеклеточным матриксом образуются за счет рецепторных белков клеточной поверхности, которые, собираясь вместе, формируют на поверхности клеток структуры типа островков (patch) и которые связывают внеклеточный матрикс, расположенный с наружной стороны плазматической мембраны с цитоскелетом со стороны цитозоля. Так же как в случае некоторых межклеточных контактов, некоторые из этих белков образуют упорядоченные комплексы, соединяющие клеточную поверхность с цитоскелетом. Эти белки обладают гораздо более широкими функциями, чем просто «клеточные присоски»; они также участвуют во многих процессах передачи сигналов и обеспечивают клеткам возможность сообщаться друг с другом.
Различные клетки вместе со своим внеклеточным матриксом формируют ткани, для которых характерна высокая степень специализации. Хрящевая, костная и другие виды соединительной ткани могут противостоять сильной механической нагрузке, в то время как другие, например ткань, формирующая легкие, не отличаются прочностью, однако являются высокоэластичными. Баланс между прочностью, эластичностью и трехмерной структурой тщательно регулируется, и компоненты каждой ткани выполняют свои функции во взаимодействии друг с другом. Таким образом, организация и состав ткани соответствуют функции, выполняемой органом; например, мышцы совершенно отличаются от кожи, и слава Богу!
Межклеточные контакты и прикрепление клеток к матриксу не ограничены только клеточной поверхностью. Во многих случаях белки должны быть заякорены в мембране достаточно сильно для того, чтобы противостоять механическим усилиям. Для этого требуется их связывание с цитоскелетом, что в основном обеспечивает клетке структурную поддержку. Наличие цитоскелета также предотвращает латеральное смещение рецепторов в плоскости мембраны, «удерживая» их на своих местах. Наряду с этим, процессы передачи сигнала регулируют сборку межклеточных контактов и поддерживают их. Цитоскелет и сигнальные механизмы играют существенную роль в клеточной адгезии.
Последующие статьи на сайте подразделяется на темы, которые посвящаются рассмотрению основных классов молекул внеклеточного матрикса, таких представителей группы его рецепторов, как интегрины, роли этих рецепторов в процессах развития, а также структуре и функциям наиболее распространенных типов клеточных контактов.
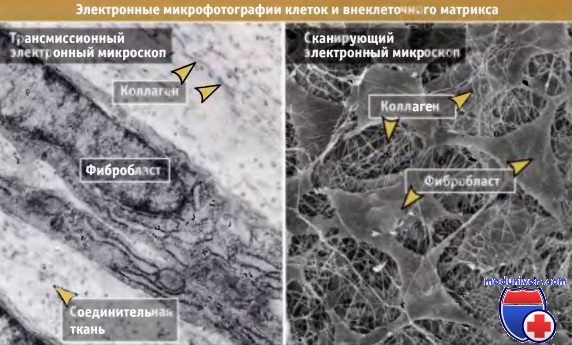
На электронных микрофотографиях видно, что межклеточное пространство заполнено волокнистым материалом.
На фотографиях видны коллагеновые фиблиллы в межклеточном пространстве между фибробластами в соединительной ткани (слева) и в роговице глаза (справа).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Внеклеточный матрикс (межклеточный) (англ. extracellular matrix, ECM) —внеклеточные структуры ткани. Внеклеточный матрикс составляет основу соединительной ткани, объединяет разрозненные клетки в единый многоклеточный организм, обеспечивает механическую поддержку клеток и транспорт химических веществ.
ВКМ словно «государство» для клеток: он отвечает за их благополучие и управляет всеми аспектами жизни, от питания и размножения до смерти.
Компоненты ВКМ синтезируют специализированные клетки. В соединительной ткани наиболее распространены фибробласты, но создавать ВКМ умеют и другие клетки: в хрящах, например, это хондроциты, в костях - остеобласты.
Компоненты матрикса могут синтезировать и клетки прилегающих органов: например, клетки эпителия сосудов производят компоненты рыхлой соединительной ткани.
Межклеточный матрикс выполняет разнообразные функции:
- обеспечивает механические контакты между клетками,
- образует механически прочные структуры, такие, как кости, хрящ, сухожилия и суставы,
- составляет основу фильтрующих мембран (например, в почках),
- изолирует клетки и ткани друг от друга (например, обеспечивает скольжение в суставах и движение клеток),
- формирует пути миграции клеток, вдоль которых они могут перемещаться, например, при эмбриональном развитии.
Таким образом, межклеточный матрикс чрезвычайно вариабелен как по химическому составу, так и по выполняемым функциям.
Металлопротеиназы – белки, наводящие порядок в ВКМ, разрушители его компонентов. Они «чистят путь» клеткам, которые движутся в ВКМ, и уничтожают старые и «сломанные» компоненты матрикса.
Основные компоненты внеклеточного матрикса - гликопротеины, протеогликаны и гиалуроновая кислота. В состав внеклеточного матрикса входит множество других компонентов: белки интегрин, фибронектин, фибрин, эластин и др. Коллаген является превалирующим гликопротеином внеклеточного матрикса.
Гликопротеины - двухкомпонентные белки, в которых белковая (пептидная) часть молекулы ковалентно соединена с одной или несколькими группами гетероолигосахаридов.
Доля углеводов не превышает 20%, углеводные цепи короткие, имеют нерегулярное строение и не содержат уроновых кислот.
Это такие важные структурные белки, как коллаген и эластин. Благодаря коллагену ВКМ приобретает прочность, а эластин дает гибкость и эластичность.
Протеогликаны – высокомолекулярные соединения, состоящие из белка (5–10%) и гликозаминогликанов (90–95%). Это строение объясняет их высокую молекулярную массу, также они образуют основное вещество межклеточного матрикса.
Они запасают воду и полезные вещества, выполняют функцию «магазина», из которого клетки получают необходимые «продукты». Кроме того, протеогликаны играют роль межтканевых прослоек и смазочного материала в суставах.
Интегрины - трансмембранные гетеродимерные клеточные рецепторы, взаимодействующие с внеклеточным матриксом и передающие различные межклеточные сигналы. От них зависит форма клетки, её подвижность, они участвуют в регулировке клеточного цикла.
С помощью таких взаимодействий в клетках активируются сигнальные каскады, регулирующие экспрессию генов, отвечающие за пролиферацию и дифференцировку клеток, их выживание или апоптоз.
Структурно интегрины представляют собой облигатные гетеродимеры: каждый состоит из одной α- и одной β-субъединицы.
Интегрины улавливают химические и физические сигналы из внеклеточного матрикса и проводят их в клетку. Сигнал от интегринов передается в ядро через белки цитоскелета и сигнальные белки — это способ управления внеклеточного матрикса экспрессией генов и регулировка клеточной пролиферации. При посредничестве белков цитоскелета ВКМ также управляет формой и движениями клеток.
Фибронектины - адгезивные белки. Интегрины превращают фибронектины в нерастворимые нити - компоненты внеклеточного матрикса. Они помогают клеткам закрепляться на поверхностях и отвечают за их рост и перемещение в ВКМ
Молекулы фибронектинов - димеры сходных между собой полипептидных цепей (250 кДа), связанных дисульфидными связями. Субъединицы подразделяются на ряд различных «доменов» способных связываться с клеточными рецепторами, коллагенами, фибрином и протеогликанами. Такая особенность строения фибронектинов придает им свойство «молекулярного клея».
Гиалуроновая кислота (гиалуронат) - несульфированный гликозаминогликан, входящий в состав соединительной, эпителиальной и нервной тканей. Является одним из основных компонентов внеклеточного матрикса, содержится во многих биологических жидкостях (слюне, синовиальной жидкости и др.).
Синтезируется встроенными в мембрану белками и затем «выдавливается» через нее в межклеточное пространство. По составу ГК похожа на углеводную часть протеогликана - это полимер из остатков D-глюкуроновой кислоты и D-N-ацетилглюкозамина. ГК помогает интегринам проводить сигналы в клетку, регулирует клеточный ответ на эти сигналы и, как фибронектин, дает клеткам возможность закрепляться на различных поверхностях.
Внеклеточный матрикс есть во всех тканях организма, поэтому сбои в его функционировании ведут к развитию болезней соединительной ткани, преждевременному старению и гибели клеток. Для лечения заболеваний, связанных с нарушениями структуры соединительной ткани, необходимо изучать ВКМ. Таких болезней множество, они могут протекать тяжело и значительно ухудшать качество жизни пациентов.
Первые признаки старения, которые сразу заметны - слабость, хрупкость костей, появление морщин и возрастной пигментации. Многие из этих проблем связаны с необратимыми изменениями во внеклеточном матриксе.
Одна из причин старения кожи - нарушение работы фибробластов (клеток, синтезирующих компоненты ВКМ). При этом благополучие фибробластов зависит от состояния внеклеточного матрикса, получается замкнутый круг.
Источники: https://biomolecula.ru/, http://www.chem.msu.su/
Телефоны Учебного центра "Олта": 8-812-248-99-34, 8-812-248-99-38, 8-812-243-91-63, 8-929-105-68-44

43524
Что такое коллаген
Кожа, как известно, состоит из нескольких слоев: эпидермиса, дермы и подкожно-жировой клетчатки.
АЗТ- и PRP-терапия направлены главным образом на дерму, которая отвечает за толщину и эластичность кожи, в дерме происходит огромное количество параллельных процессов синтеза и распада. Лучше пытаться влиять на эту деятельность , хорошо представляя себе патогенетические механизмы, протекающие в коже.
Основной компонент дермы – это коллаген, органическое соединение из группы фибриллярных белков. Сосочковый слой дермы образован более мелкими пучками волокон коллагена, в нем преобладает большое количество клеток (фибробласты, фиброциты, тучные клетки, Т-лимфоциты), в то время как сетчатый слой характеризуется более крупными пучками, формирующими характерную сеть, обеспечивающую прочность кожи, отсюда и название слоя – сетчатый.
Коллаген:
- Основной белок дермы
- Волокна переплетены в правозакрученную спираль, состоящую из трех полипептидных цепей
- Производится фибробластами и расщепляется коллагеназой
- Обеспечивает упругость и эластичность кожи
Синтез коллагена
Фибробласты – основные клетки дермы, которые производят как коллаген, так и другие белки и некоторые энзимы. В разные периоды жизни человека дерма претерпевает изменения. Так, в юном возрасте она характеризуется высокой активностью фибробластов и состоит из небольших ярко-красных пучков коллагеновых волокон. С возрастом активность фибробластов снижается, уменьшается их количество, пучки коллагеновых волокон утолщаются и приобретают бледно-розовую окраску.
Молекула коллагена состоит из трех полипептидных цепей, скрученных в виде правой тройной спирали и состоящих из аминокислотных остатков (как правило, это остатки глицина, пролина и лизина). Трёхспиральная структура коллагена придает молекуле прочность.
На одном из концов молекула «сшита» поперечными связями из остатков лизина, что придает волокнам высокую степень упругости.
Особую роль в регуляции синтеза коллагена играют гормоны. Глюкокортикоиды тормозят синтез коллагена, что проявляется уменьшением толщины дермы, а также атрофией кожи в местах продолжительного введения этих гормонов (Zöller et al.).
На синтез коллагена влияют также половые гормоны, рецепторы к которым обнаружены в фибробластах. Синтез коллагена зависит от содержания эстрогенов, что подтверждает тот факт, что у женщин в менопаузе снижается содержание коллагена в дерме (Calleja-Agius et al.).
Основные типы коллагена в дерме
Существует 19 типов коллагена, в разных тканях преобладают разные его типы, что в свою очередь определяется той ролью, которую коллаген играет в конкретном органе или ткани.
В дерме, в основном, содержится коллаген I (сетчатый слой) и III (сосочковый слой) типов. Тип I составляет от 80 до 85 % матрикса дермы и отвечает за эластичность. Коллаген типа I является главным «союзником» старения. Как было установлено Nelson et al., в результате фотостарения содержание коллагена в коже снижается. Тип III второй по важности, составляет от 10 до 15 % матрикса. Волокна отличаются меньшим диаметром в сравнении с волокнами коллагена типа I и формируют более мелкие пучки, обеспечивая коже гибкость.
Тип IV является структурной составляющей базальной мембраны.
Тип V диффузно распространен в дерме и составляет от 4 до 5 % матрикса.
Тип VII участвует в образовании заякоренных фибриллов.
Тип XVII локализуется в гемидесмосомах, которые связывают клетки эпителия с лежащей под ними базальной мембраной.
В молодой коже преобладают волокна коллагена типов I (80 %) и III (15 %), что составляет 6:1. С возрастом происходит уменьшение содержания коллагена типа I, что ведет к утолщению и нарушению связей между волокнами.
Коллаген и старение
Старение характеризуется такими изменениями кожи, как появление морщин и потеря упругости. Это связано с уменьшением количества волокон коллагена в дерме. Поскольку коллаген является важнейшей «опорой» кожи, неудивительно, что если уровень его снижается, то кожа начинает «проседать», терять эластичность, а взамен приобретать морщины. Установлено, что каждый год происходит снижение уровня коллагена в тканях на 2 % (Fenske et al.).
Важную роль играет и гликация, процесс, в ходе которого лишняя молекула сахара (глюкоза) присоединяется к белковой молекуле (в частности, к молекуле коллагена), как бы склеивая ее. «Склеенные» волокна коллагена теряют способность к сокращению, что затрудняет их способность к регенерации и снижает упругость.

Как мы можем контролировать процессы синтеза и распада коллагена?
В настоящее время эстетическая медицина может предложить современные и эффективные методики созданию пула веществ для наиболее эффективного и контролируемого синтеза коллагена. В первую очередь это аминокислотно-заместительная терапия (АЗТ) и PRP-терапия (плазмотерапия).
АЗТ представляет собой инъекционное введение аминокислот (глицин, L-пролин, L-лизин моногидрохлорид, L-лейцин), которые ответственны за выработку коллагена.
Недавнее исследование Avantaggiato et al. показало, что совместное инъекционное введение ацетилцистеина и аминокислот привело к улучшению внешнего вида кожи, замедлило ее старение и обезвоживание.
На российском рынке хорошо зарекомендовал себя препарат JALUPRO® (Италия).
Практические аспекты использования AЗТ мы выяснили у Дианы Юдиной, доктора-косметолога, которая давно и очень успешно использует аминокислотно-заместительную терапию в своих комплексных программах.
Каким пациентам Вы назначаете АЗТ? Почему?
В первую очередь применение АЗТ показано при:
- хроностарении кожи лица средней и сильной степени выраженности, возраст 35+;
- дегидратированной коже, рубцах постакне, стриях;
- подготовке и реабилитации после эстетических процедур (пластическая операция, фракционный фототермолиз, радиоволновой или ультразвуковой лифтинг, электропорация, мезотерапия, IPL)
На сегодняшний день известно о множестве механизмов старения кожного покрова. Большинство из них связаны со снижением функциональной активности фибробластов: с возрастом замедляется продукция и обновление компонентов межклеточного матрикса (коллагена, эластина, фибронектина, гликозамингликанов, протеогликанов), ухудшается его организация и заживление ран.
По данным последних исследований, особенность первичной структуры α-цепей коллагена заключается в том, что 33,7 % всех аминокислотных остатков в молекуле коллагена приходится на глицин, 13,3 % – на пролин, 9,7 % – на гидроксипролин, 11,6 % – на аланин. В полипептидной цепи коллагена доминируют характерные триплеты гли-X-Y, где в положении «X» и «Y» могут быть любые аминокислоты, но чаще в положении «X» находится пролин, а в положении «Y» – гидроксипролин или гидроксилизин.
Клинически доказано, что АЗТ обеспечивает хемотаксис и деление фибробластов, имеет синергический эффект, усиливая функциональную активность кератиноцитов и фибробластов, оптимизирует процессы рубцевания, сокращает реабилитационный период (до 40 %) после эстетических процедур, увеличивает толщину и эластичность, снижает рельефность кожи.
Может ли АЗТ стать заменой классической биоревитализации?
С моей точки зрения, эти две процедуры дополняют друг друга, классическая ревитализация обеспечивает максимальную среду для функциональной активности фибробластов, для их синтеза, хемотаксиса, миграции и пролиферации.
АЗТ стимулирует неоколлагенез, усиливает активность кератиноцитов, процессы метаболизма, восстанавливает структуру коллагена.
Плазмолифтинг™ – методика, которую разработали отечественные ученые Ренат Ахмеров и Роман Зарудий. Во всем мире метод известен, как PRP-терапия (platelet rich plasma) или плазмотерапия, и основан он на использовании плазмы крови пациента.
Богатая тромбоцитами плазма вводится в проблемные зоны и активизирует механизм обновления клеток.
После введения плазмы фибробласты начинают синтезировать коллаген, эластин и гиалуроновую кислоту, за счет чего улучшается состояние и внешний вид кожи. Для получения плазмы осуществляется забор крови у пациента в специальную пробирку. Затем кровь очищается и помещается в центрифугу, где разделяется на три фракции, из которых выбирается наиболее обогащенная активированными тромбоцитами плазма. Вся процедура занимает около часа и требует лишь местного обезболивания (при необходимости).
Основным преимуществом плазмотерапии является безопасность и патогенетическая обоснованность метода.
Показания к терапии:
- Возрастные изменения кожи (морщины, птоз);
- Пониженный тургор;
- Сухость и шелушение;
- Растяжки;
- Фотостарение;
- Увеличение эффекта от других терапевтических процедур;
- Подготовка кожи к хирургическому вмешательству;
- Акне;
- Выпадение волос.
Мы задали несколько вопросов ведущему специалисту по аутологичной плазме Олесе Алексеевне Чирковой.

Чиркова Олеся Алексеевна
Хирург-косметолог, Главный специалист компании "Плазмолифтинг" по направлению эстетическая медицина в России, Европе,странах Балтии и СНГ. Ассистент кафедры косметологии Института ДПО ИПХиФК
Может ли PRP-терапия считаться аминокислотно-заместительной в полной мере?
Вопрос невероятно сложный, потому как имеет не один ракурс рассмотрения. Если диагноз АК-недостаточности установлен, определены кислоты в дефиците, процент их дефицита и форма, то в данном случае мы можем предположить, что введение плазмы не будет являться вариантом первого выбора, а станет лишь сопутствующей терапией при введении АК в составе мезо- или фармпрепарата, так как является источником транспортных белков. Это обеспечит более рациональный подход, так как эффективность при местном введении плазмы и прочих веществ повышает их биодоступность.
Однако если мы возьмем в качестве примера обратившегося к врачу эстетической медицины среднестатистического пациента с признаками старения, но без четкого диагноза и цифр по аминокислотам, то в данном случае PRP-терапия будет самым быстрым, простым и беспроигрышным вариантом по компенсации витальных потребностей.
Какой группе пациентов однозначно нужна аминокислотно-заместительная терапия?
Учитывая данные диетологов о том, что на планете проживает до 80 % белково-дефицитных людей, то – всем. Совершенно серьезно стоит подойти к аминокислотной коррекции большинству пациентов, так как это обеспечит фундамент для последующих процедур, эффективность которых возрастет на фоне предварительной коррекции.
Читайте также:

