Поддерживающая терапия заболеваний пародонта
Опубликовано: 22.04.2024
Официальный сайт Ст оматологической А ссоциации Р оссии
А.И. Грудянов, И.Ю. Александровская
ПЛАНИРОВАНИЕ ЛЕЧЕБНЫХ МЕРОПРИЯТИЙ ПРИ ЗАБОЛЕВАНИЯХ ПАРОДОНТА
"Медицинское информационное агентство" Москва 2010
П37 Планирование лечебных мероприятий при заболеваниях пародонта. - М.: ООО "Медицинское информационное агентство", 2010. - 56 е.: ил.
Заболевания пародонта отличаются крайне высокой распростра-ненноствю, многообразием клинических проявлений и зачастую различным характером течения и прогноза в зависимости от ряда местных и внутренних факторов. В этой связи планирование лечебных вмешательств является сложным вопросом не только для молодых специалистов, но и для опытных врачей.
В представленном издании осуществлена попытка создания алгоритма действий специалистов с использованием как известных и хорошо зарекомендовавших себя средств и методов, так и новейших, с учетом индивидуальных особенностей конкретного пациента.
УДК 616.314-085 ББК 56.6
Александровская И.Ю., 2010 © Оформление. ООО "Медицинское информационное агентство", 2010
Все права защищены. Никакая часть данной книги не может быть воспроизведена в какой-либо форме без письменного разрешения владельцев авторских прав.
Оглавление
Глава 1. Принципы лечения заболеваний пародонта
Глава 2. Начальное лечение
Глава 3. Хирургическое лечение
Глава 4. Поддерживающая терапия.
Введение
Лечение заболеваний пародонта является одной из наиболее сложных задач современной стоматологии в силу крайнего многообразия клинических проявлений, причем не только у разных пациентов, но зачастую и у одного пациента с патологией различных участков зубных рядов. Именно поэтому, несмотря на заметный прогресс в изучении этиологии и патогенеза воспалительных заболеваний пародонта, стратегия лечебных мероприятий, их последовательность и эффективность в каждом конкретном случае часто представляют серьезную проблему, а предлагаемые стандарты лечения оказываются весьма условными.
Тем не менее в данной работе нами предпринята попытка обобщения накопленного отечественного и мирового опыта систематизации и описания последовательности выполнения огромного количества предложенных для этих целей средств и методов в соответствии с принятой в нашей стране систематикой заболеваний пародонта.
Еще недавно было принято выделять 3 этапа комплексного лечения воспалительных заболеваний пародонта:
1) начальное лечение (предварительная терапия);
2) хирургическое лечение (основное лечение);
3) поддерживающее лечение (поддерживающая терапия).
В 2003 г. Питер Феди в известной "Пародонтологической Азбуке" предложил четвертый этап в виде реставрационной терапии (Fedi F. Peter, 2003), а в 2008 г. Герберт Вольф предложил в качестве самостоятельного "нулевой этап" - экстренное лечение (Wolf F. Herbert, 2008) 1 .
Глава 1
ПРИНЦИПЫ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ПАРОДОНТА
Течение воспалительных заболеваний пародонта пред-J1 полагает соблюдение общемедицинских принципов.
I. Комплексность:
а) использование комплекса местных лечебных воздействий (консервативных, хирургических, ортопедических, ортодонтических), направленных на восстановление структуры и функции пародонта и на достижение максимального косметического эффекта;
б) взаимодействие врачей-стоматологов с врачами других специальностей в целях дополнения эффекта местных вмешательств устранением или минимизацией общих метаболических влияний на состояние пародонтального комплекса (т.е.сочетание местного и общего лечения).
II. Индивидуальность: необходимо проводить детальный анализ формы и тяжести поражения пародонта, особенностей его клинического течения у конкретного пациента, а также характера сопутствующей патологии (при ее наличии), состояния реактивности тканей ротовой полости и организма в целом.
III. Последовательность, лечение воспалительных заболеваний пародонта строится как поэтапная терапия, что предусматривает обоснованный выбор лечебных методов и средств воздействия на каждом этапе лечения. То есть речь идет об алгоритме лечебных воздействий. Это очень важно, поскольку часто именно нарушение этапности приводит к отрицательным результатам лечения пародонтита. Однако именно индивидуальность клинической картины часто становится причиной коррекции общепринятого алгоритма.
IV. Систематичность, в целях профилактики обострения воспалительного процесса необходимо проведение повторных курсов лечения, т.е. поддерживающей терапии. Интервалы между курсами лечения определяются индивидуально на основании наблюдения клинической динамики после первого курса лечения и зависят от тяжести и клиники процесса у конкретного пациента.
V. Взвешенность и сбалансированность: выбор средств и методов лечения должен быть полным, обоснованным и взвешенным, учитывать форму и степень тяжести процесса, индивидуальные особенности пациента. В принципе этот момент предполагает необходимость со стороны специалиста (причем, как правило, группы специалистов) решить самый насущный для врача и, конечно, для пациента вопрос: какой результат можно получить в идеале и какой ценой (рис. 1.1).
Для того чтобы дать более подробную характеристику "принципа комплексности" лечения, следует сказать, что оно может быть не только местным или общим, но и, по характеру воздействия, этиотропным, патогенетическим, симптоматическим, а в зависимости от используемых методов - терапевтическим, хирургическим, ортопедическим и т.д.
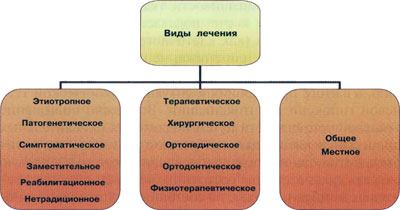
Рис. 1.1. Виды лечения заболеваний пародонта
Этиотропная терапия направлена на устранение причины болезни.
Поскольку сегодня обязательным причинным фактором воспалительно-деструктивных поражений пародонта признан микробный (ВОЗ), то все средства и методы, позволяющие устранить или ослабить его влияние, и составляют этиотропный комплекс. Это:
- непосредственное удаление биопленки и твердых зубных отложений - носителей биопленки;
- использование средств, подавляющих как созревание биопленки, так и степень ее патогенного влияния на ткани, - антисептиков, а при необходимости - антибиотиков;
- обучение гигиене полости рта, контроль за тщательностью ее проведения, что является как самостоятельным методом профилактики, так и обязательным атрибутом на всех этапах лечения воспалительных заболеваний пародонта.
Патогенетическая терапия основана на воздействии на механизмы развития ответной воспалительной реакции на микробный налет, или биопленку. Выбор метода патогенетического воздействия зависит от того, на какое звено патогенеза воспаления намерен воздействовать врач: либо это снижение восприимчивости тканевого комплекса к токсическим агентам за счет подавления активного общего и местного ответа (как клеточного, так и гуморального), либо устранение или снижение токсических реакций окисления, выполняющих изначально защитную функцию, а в итоге приводящих к ситуации хронической тканевой гипоксии и интоксикации. Возможно повышение тканевой устойчивости путем подавления окислительных процессов в клеточных мембранах с помощью как анти-оксидантов, так и гипоксантов, влияние которых в первую очередь сказывается на состоянии билипидного слоя клеточных мембран, а также на состоянии митохондриально-го аппарата. Целесообразно использовать средства, подавляющие нарушенные в условиях хронического воспаления процессы образования простагландинов и токсичных форм лимфоцитов. Показаны и средства, обеспечивающие функциональную активность нейтрофилов, адекватную силе повреждающего фактора. Важным и не до конца изученным вопросом является возможность воздействия на цитокиновую систему, причем как на функциональное состояние первичного продуцента (макрофагов, лимфоцитов, моноцитов), так и на его последующее образование, в первую очередь за счет усиления самостимулирующей, или аутокринной, ветви в целях своевременного и адекватного увеличения противовоспалительных форм.
Безусловно, важны средства и методы, позволяющие восстановить или улучшить состояние главных метаболических тканевых источников. С этой целью и предлагают следующие группы препаратов:
- нестероидные противовоспалительные средства;
- стероидные противовоспалительные средства;
- препараты, препятствующие снижению напряжения и утилизации кислорода в тканях и закислению тканевой среды;
- средства, улучшающие гемоциркуляцию;
Симптоматическая терапия направлена на устранение и ослабление отдельных симптомов заболевания, причиняющих больному страдания:
- средства для купирования повышенной чувствительности шеек и корней зубов;
Примером как заместительной, так и реабилитационной терапии может служить ортопедическое лечение.
Нетрадиционная терапия (например, гомеопатия) применяется при лечении заболеваний пародонта в случаях, когда применение традиционных средств терапии невозможно в связи с аллергией или тяжелым сопутствующим заболеванием, а также при отсутствии чувствительности микрофлоры к препаратам, обычно используемым в паро-донтологии.
Способы введения лекарственных веществ в пародонто-логии, по сути, те же самые, что и в общей медицине, но с небольшими исключениями:
- инстилляции - введение в пародонтальный карман (рис. 1.2);
- аппликации (рис. 1.3);
- инъекции (рис. 1.4);
- физические методы (электрофорез, фонофорез, магнитофорез);
- традиционные методы введения - per os и внутримышечно;
Субгингивальное введение подразумевает использование "доставляющих" систем, которые обеспечивают большую концентрацию лекарственных средств непосредственно в очаге поражения. К ним относятся: тетрациклиновые и хлоргексидиновые нити, доксициклиновые полимеры, самоклеящиеся пленки "Диплен-дента", ПериоЧипы и т.д.
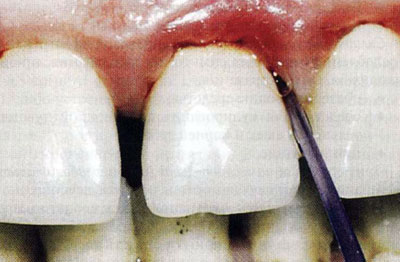
Рис. 1.2. Инстилляции
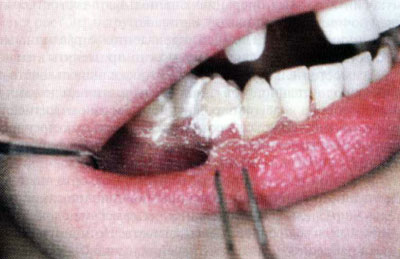
Рис. 1.3. Самоклеящиеся пленки "Диплен-дента"
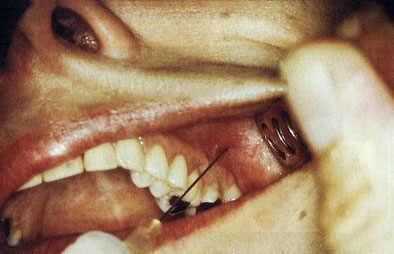
Рис. 1.4. Инъекции
Участок вмешательства при лечении пародонтита обычно закрывают пародонталъной повязкой - Periodontal Pack, Сое Pack, Voco Pack, Septo Pack. Когда необходимы наложение повязки на длительное время и визуальный контроль над течением раневого процесса (например, при
мукогингивальных операциях), используют светоотверж-даемую прозрачную повязку Barricade.
Самоклеящиеся пленки "Диплен-дента" с различными лекарственными включениями можно применять в качестве самостоятельного лечения, а также использовать в виде пародонтальной повязки для удержания введенных в карман или на краевой пародонт композиций из антисептиков, антибиотиков и противовоспалительных препаратов в более высокой, нежели в составе пленок, концентрации.
В данной работе вопросы имплантации, ортодонтиче-ского и ортопедического лечения - как вполне самостоятельные разделы стоматологии, а также весьма сложные и объемные - мы решили не затрагивать. Но при планировании пародонтологического лечения нужно учитывать необходимость перечисленных вмешательств. Поскольку не вызывает сомнений, что нарушения прикуса являются одной из причин травматической окклюзии, ортодонтическое лечение зачастую (до 30 %) является одним из обязательных этапов терапии пародонтита. Однако в таких случаях проблема состоит в другом: проводить ортодонтическое лечение можно только после предварительного лечения пародонтита и проведения регулярных поддерживающих курсов на этапах активного ортодонтического лечения и в период ретенции, причем при строгом соблюдении этапов как местной противовоспалительной терапии, так и проведения хирургических вмешательств, в частности коррекции мягких тканей преддверия полости рта, в соответствии с разработанным специалистами алгоритмом лечебных этапов (Кулаков А.А., Калюжный А.Б., 2006).

Рис. 1.5. Магнитно-резонансная томография нижней челюсти
Характерно, что, планируя ортодонтическое лечение при пародонтите, врачу-ортодонту, кроме решения своих сугубо ортодонтических проблем, необходимо самым внимательным образом учитывать анатомо-топографические особенности зубочелюстной системы пациента: количество костной ткани в области каждого зуба; толщину слизистой оболочки; наличие и выраженность кортикальной пластины. На сегодня максимальную, хотя и неполную, информацию по этому вопросу позволяет получить магнитно-резонансная томография (рис. 1.5).
1 "Экстренное лечение" нами было включено в качестве самостоятельного подраздела "начального лечения".
Болезни пародонта – это обобщающий термин, используемый для описания инфекционного воспалительного процесса, который может поражать один структурный элемент или комплекс составных элементов пародонта. Структуры, поддерживающие зуб, представлены альвеолярной костью, периодонтальной связкой и цементом корня. Заболевания пародонта в основном спровоцированы действием зубного налета или микробной биопленкой, представляющей собой гетерогенную структуру из патогенных микроорганизмов. Более 500 видов микроорганизмов считаются потенциальными этиологическими агентами, провоцирующими поражение тканей пародонта. Кроме них, вирусы и грибки тоже играют не последнюю роль в патогенетическом процессе. При возникновении и прогрессировании заболевания патогенные микроорганизмы колонизируют область десен, окружающую зуб, а вследствие их воздействия на ткани начинает формироваться пародонтальный карман. В глубоких пародонтальных карманах можно найти до 109 разновидностей бактерий, но несмотря на потенциал многих патогенов, которые ассоциируются с заболеваниями пародонта, лишь небольшое их количество связано с активной фазой заболевания.
Socransky и коллеги разделили патогенные микроорганизмы, участвующие в прогрессировании заболевания на две основные группы: "красный" и "оранжевый" комплексы. Красный комплекс включает в себя следующие грамотрицательные анаэробные бактерии: Porphyromonas gingivalis, Treponema denticola и Tanneralla forsythia, в то время как оранжевый комплекс состоит из Prevotella nigrescens, Peptostreptococcus micros, Campylobacter rectus, Centruroides gracilis, Campylobacter showae, Eubacterium nodatum и Streptococcus constellatus. Кроме них, с болезнями пародонта тесно ассоциируются Aggregatibacter actinomycetemcomitans и Eikenella corrodens. В результате многочисленных исследований было установлено, что для достижения успешного результата лечения, один из аспектов терапии должен быть направлен именно на нейтрализацию данных бактерий, жизнедеятельность которых напрямую связана с протеканием заболевания.
Антибиотики
Системная антибиотикотерапия должна рассматриваться как один из приемлемых вариантов лечения пациентов с пародонтитом. Данный подход актуален для пациентов, резистентных к обычной терапии заболевания, или у которых наблюдаются следующие проблемы со здоровьем: наличие абсцесса, компромиссное или ослабленное состояние иммунитета, неконтролируемый сахарный диабет, присутствие признаков и симптомов системных поражений, лихорадки и лимфаденопатии. Выбор наиболее подходящего системного антибиотика должен основываться на результатах культивирования микроорганизмов и тестирования их чувствительности к определенному препарату. Таким образом, удается узнать, во-первых, какие микроорганизмы присутствуют в области поражения, и, во-вторых, подобрать наиболее эффективный и действующий агент. Но следует помнить, что системная антибиотикотерапия не должна быть единственным методом лечения, а лишь представлять собой сегмент комплексного подхода обследования, диагностики и разработки адекватной системной терапии. Антибиотикотерапия, как и какой-либо другой метод лечения, имеет свои преимущества и недостатки. Поскольку прием данных препаратов является довольно таки известным методом лечения, пациенты, как правило, понимают основные ключевые моменты данного лечения, и без проблем соглашаются на предложенный алгоритм курса медикаментов. Но вместе с тем, пациенты часто могут путать официальные основные наименования лекарств, забывать дозу, время или даже сам факт их приема, нарушая тем самым эффект их действия. Системные антибиотики могут вызывать побочные эффекты и нарушения функционирования желудочно-кишечной системы в форме диареи или абдоминальных спазмов. Другие возможные негативные влияния препаратов связаны с аллергическими реакциями и возникновением резистентности бактерий к антибиотикам при их длительном и неконтролируемом приеме. Бактериальная резистентность является серьезной проблемой в медицине, поскольку она формирует ряд других научно-клинических дилемм относительно терапевтического соотношения риска лечения против потенциальной пользы от приема антибиотиков.
Системные антибиотики достигают тканей пародонта путем транссудации из сыворотки крови, после чего проходят через соединительный эпителий и выстилку десневого кармана, чтобы попасть в область десневой борозды. Эффективная концентрация антибиотика при достижении им десневой борозды во время курсового приема отличается от таковой в любой другой системе тканей или органе с признаками инфицирования, что связано со специфической структурой пародонта. Существует ряд уже хорошо апробированных схем приема антибиотиков для лечения заболеваний пародонта, которые, как правило, используются в сочетании с механическим удалением над- и поддесневых отложений и бактериального налета. Данный подход в комплексе с эффективной домашней гигиеной полости рта направлен на снижение бактериальной нагрузки в области тканей десны выше и ниже маргинальной границы. Некоторые врачи обычно назначают схемы антибиотикотерапии для лечения и управления заболеваниями пародонта на основе амоксициллина (375 мг) и метронидазола (500 мг) при приеме препаратов 3 раза в день в течение 7 дней в сочетании с проведением скейлинга ротовой полости и полной очисткой области корней в первые 48 часов. Такой подход помогает достичь уменьшения глубины карманов и снизить уровень кровотечения, что было обнаружено при сравнении результатов лечения в исследуемой и контрольной группах. Альтернативная схема лечения предусматривает прием азитромицина (500 мг) в течение 3 дней до проведения процедуры полного удаления зубного камня и очистки поверхности корней, чтобы уменьшить количество бактерий красного комплекса и снизить показатели гингивального индекса. При отсутствии возможностей проведения посева культуры бактерий и определения их чувствительности к антибиотикам, можно пользоваться эмпирическим принципом назначения препаратов для лечения пародонтита. Обоснованные варианты лечения включают в себя комбинацию амоксициллина и метронидазола (250 мг - 500 мг каждого) с приемом препаратов 3 раза в день в течение 8 дней, или комбинацию метронидазола и ципрофлоксацина (500 мг) в течение 8 дней по 2 раза в сутки.
Местная антибиотикотерапия является альтернативным адъюватным вариантом лечения, который также может применятся в ходе лечения поражений пародонта. Суть процедуры состоит в доставке антибиотика непосредственно в пародонтальный карман – то есть прямо в место колонизации патогенных бактерий, при этом концентрация антибиотика в области поражения по сравнению с системным приемом заметно увеличивается. Другим преимуществом является отсутствие потенциальных нарушений расстройств желудочно-кишечного тракта и аллергических реакций. Первым антибиотиком, используемым для местного лечения, был Actisite (пародонтальный тетрациклин). Он состоял из нерезорбируемых, пропитанных тетрациклином, волокон, которые помещались непосредственно в пародонтальный карман и оставались там в течение 10 дней – вплоть до следующего визита к стоматологу. Со временем проходило усовершенствование препаратов и методов их доставки в область пародонтального поражения. Таким образом, был разработан Atridox (Denmat), который является первым резорбируемым антибиотиком местного действия, состоящим из гелевой формы доксициклина. Данный препарат вводится в карман с помощью шприца, и при контакте со слюной – затвердевает, приобретая восковую консистенцию. Таким образом, антибиотик может выделятся из затвердевшей фазы на протяжении 21 дня. Arestin (Orapharma) также является представителем местных рассасывающихся препаратов антибактериального действия, который состоит из гранул миноциклина в форме порошка. Поставляется он в виде ампул, заряженных в шприц. Порошок вводится непосредственно в пародонтальный карман, высокий уровень его терапевтического действия продолжается в течении 14 дней, а сам препарат остается в кармане на протяжении 28 суток. Исследования доказали, что использование антибиотиков местного действия вместе с процедурой полного удаления зубного камня и очисткой поверхности корней позволяет добиться клинически эффективных результатов: наблюдается уменьшение глубины карманов и частичное восстановление нарушенного биологического прикрепления.
Противомикробные ополаскиватели полости рта
Противомикробные полоскания являются хорошо известными и приемлемыми процедурами, эффективно дополняющими комплексное лечение воспаления тканей десен. Примерами аргументированного их использования являются ситуации, когда пациент не в состоянии обеспечить оптимальный уход за полостью рта с помощью обычных гигиенических средств в домашних условиях, например, в послеоперационный период. Чтобы правильно выбрать ротовой ополаскиватель, который бы эффективно справлялся с воспалением десен и в то же время с профилактикой зубного налета, нужно узнать имеет ли он Сертификат одобрения Американской стоматологической ассоциацией. Если да, то данный продукт прошел через ряд клинических, биологических и лабораторных испытаний, которые доказали его противовоспалительную и антибактериальную эффективность. Однако, следует понимать, что данная оценка является рекомендательной, но никак не директивной в отношении препарата. Единственными ополаскивателями, доступными на рынке с соответствующей оценкой Ассоциации, являются представители с фенольными составляющими, по типу Listerine и других аналогичных версий. Золотым стандартом среди антимикробных ополаскивателей также считается хлоргексидин глюконат (0,12%), который в США отпускается лишь по рецепту и известен под коммерческими названиями Peridex и PerioGuard (Colgate-Palmolive). Хлоргексидин является наиболее эффективным антимикробным ополаскивателем, снижающим число бактерий и обеспечивающим эффективное лечение гингивита. Препарат более эффективен в отношении грамположительных бактерий и дрожжей, и менее эффективен в борьбе с грам-отрицательными патогенами. Его обычно назначают в послеоперационный период для снижения бактериальной нагрузки в период заживления. Хлоргексидин имеет высокую субстантивность, что обеспечивает его пролонгированное действие. Некоторые побочные эффекты, связанные с использованием хлоргексидина, включают потенциальное окрашивание зубов и спинки языка; изменение вкусовых восприятий; риск возможного образования наддесневого камня, формирование признаков мукозита и десквамации эпителия. Другими противомикробными ополаскивателями, доступными для широких масс, но менее часто рекомендованными специалистами, являются производные четвертичного аммония, такие как Cepacol (Reckitt Benckiser). Продукты на основе сангвинарина, по типу Viadent, больше широко не доступны на рынке. Продукты на основе оксигенатов, как пероксид водорода, рекомендуется чаще использовать в форме пасты. Они владеют противовоспалительными свойствами, благодаря которым уменьшаются признаки кровотечения. Последнее является важным критическим показателем для оценки воспаления пародонта. Однако данные представители имеют лишь небольшое влияние на уровень бактериальной контаминации, а в последнее время все чаще высказывается мнение об их возможном канцерогенном потенциале. Триклозан является еще одним антимикробным агентом, поставляющимся в форме зубных паст и ополаскивателей. Тем не менее, согласно данных исследований, он тоже демонстрирует минимальное влияние на микробную флору полости рта, а безопасность его использования до сих пор находится под вопросом.
Противовоспалительные агенты
Мы должны помнить, что заболевания пародонта имеют инфекционную природу, а воспалительные явления являются иммунным ответом организма на микробную контаминацию. В воспаленных тканях процесс размножения патогенных бактерий происходит быстрее, что приводит к прогрессированию патологических и разрушительных эффектов воспалительного процесса, посредством активации клеток иммунной системы организма (макрофагов и их предшественников, моноцитов, лимфоцитов, и полиморфноядерных лейкоцитов, таких как нейтрофилы). Компоненты микробной структуры, по типу липополисахарида, который находится в стенках клеток грамотрицательных анаэробных микроорганизмов, активируют макрофаги для продуцирования и секретирования провоспалительных цитокинов, таких как интерлейкин-1 (IL-1) и фактор некроза опухолей-альфа (TNF-alpha). Интерлейкин-1 стимулирует резорбцию кости, а также способствует высвобождению PGE2 клетками фибробластов, которые являются основными и наиболее распространенными типами клеток соединительной ткани. Фибробласты синтезируют коллаген – основной структурный белок соединительной ткани, который является также основным компонентом волокон десны и кости. Данные клетки и клетки воспалительной реакции (нейтрофилы и макрофаги) синтезируют матриксные металлопротеиназы (ММР), которые представляют собой ферменты или белки, участвующие в ряде биологических реакций. Например, ММР-1 и ММР-8 являются ферментами, которые принимают участие в деградации коллагена, что значительно ослабляет структуру пародонта. Активация иммунной системы по своей сути является защитной реакцией организма – ответом на бактериальную инвазию, однако в ходе механизма реализации иммунного ответа происходит разрушение тканей самого организма-хозяина. Данный феномен связан с высвобождением цитокинов, провоспалительных медиаторов и ММР, поскольку данные агенты действуют не только локально на ткани пародонта, но попадая в кровоток могут вызвать и нежелательные системные эффекты.
ММР являются группой протеолитических ферментов, обнаруженных в тканях пародонта, которые в своем составе имеют коллагеназу и желатиназу. Функция данных ферментов состоит в ремоделировании внеклеточного матрикса. Поскольку исследователями было обнаружено, что доксициклин имеет антиколлагенлитические свойства, они предложили использовать его в качестве модуляторного агента для лечения пародонтита. Субантимикробные дозы доксициклина (20 мг дважды в день) являются эффективными для ингибирования активности коллагеназы, и в то же время никак не влияют на фактор антимикробной резистентности при его использовании в сочетании с полным удалением зубного камня и очисткой поверхности корней. Такой подход обеспечивает максимальный эффект для восстановления биологического прикрепления тканей и снижения глубины пародонтальных карманов.
Пероральные лекарственные средства
Нестероидные противовоспалительные препараты (НПВП) также были изучены в качестве ингибиторов реакции организма хозяина при лечении заболеваний пародонта. Механизм их действия состоит в предотвращении продукции простагландинов. Простагландин Е2 (PGE2) напрямую ассоциирован с процессами воспаления и резорбции костной ткани, что подтверждено его верификацией в пораженных пародонтальных участках. В ходе изучения различных НПВП (флурбипрофен, ибупрофен, кеторолак, напроксен, аспирин), которые вводились системно или локально, было обнаружено, что при их сочетании с процедурой полного удаления зубного камня и очисткой поверхности корней, удавалось сохранить имеющуюся высоту альвеолярного гребня, предупреждая его резорбцию. Бисфосфонаты представляют собой класс препаратов, ингибирующих резорбцию альвеолярной кости, которые также были использованы в качестве хост-модулирующих агентов при лечении заболеваний пародонта. Исследования показали, что бисфосфонаты при использовании в сочетании с полной очисткой полости рта, обеспечивают снижение глубины пародонтальных карманов и уровня кровотечения во время зондирования, а также улучшают восстановление биологического прикрепления и обеспечивают сохранение высоты альвеолярного гребня. Однако, несмотря на потенциальные преимущества бисфосфонатов, исследования показали, что длительное применение и высокие дозы препаратов инициируют остеонекроз челюстей. Очевидно, что для аргументированных выводов необходимо проведение дальнейших более детализированных исследований, которые помогут определить соотношение потенциальной пользы препаратов и относительного риска осложнений в процессе лечения пародонтита.
Хост-модулирующая терапия
Локальное применение хост-модулирующих агентов, таких как эмалевые матриксные протеины, костные морфогенетические белки и тромбоцитарные факторы роста, может быть довольно эффективным в ходе комплексного лечения пародонтита. Эмалевые матриксные протеины доступны в форме препарата Emdogain (Straumann) и успешно используются в ходе восстановления пародонтальных дефектов. Данные белки играют роль модуляторов заживления, стимулируя регенерацию всех пародонтальных компонентов поддерживающего аппарата зуба. Костные морфогенетические белки способствуют модуляции и дифференциации мезенхимальных клеток в клетки-предшественники костной ткани. Они действуют в качестве каркаса, на который может наращиваться новая костная ткань, и часто используются при направленной костной регенерации во время аугментации альвеолярного гребня. Наконец, тромбоцитарные факторы роста усиливают хемотаксис нейтрофилов и моноцитов, стимулируют пролиферацию фибробластов, а соответственно и синтез внеклеточного матрикса, а также повышают уровень дифференциации мезенхимальных клеток-предшественников, фибробластов и эндотелиальных клеток. Именно тромбоцитарные факторы роста наиболее часто используется при хирургических вмешательствах на тканях пародонта с целью ускорения их регенерации.
Выводы
Новые знания относительно хост-бактериальных взаимодействий и иммунных реакций организма, которые провоцируют поражение тканей пародонта, станут полезными для разработки более новых и эффективных концепций лечения пародонтита с использованием системных и местных антибиотиков, антимикробных ополаскивателей и принципов хост-модулирующей терапии. Результаты дальнейших исследований могут пролить свет на вспомогательную адьювантную терапию, которая может быть использована для коррекции алгоритмов лечения с целью достижения наиболее успешного эффекта комплексной терапии поражений поддерживающего аппарата зуба.

Пародонтит – заболевание тканей, окружающих зуб, опасно тем, что может привести к утрате вполне здоровых зубов
Пародонтит – заболевание тканей, окружающих зуб, опасно тем, что может привести к утрате вполне здоровых зубов. Налет, образующийся в результате жизнедеятельности бактерий, медленно и планомерно разрушает мягкие ткани десен и даже костную ткань, в результате чего фиксация зуба значительно ослабляется.
Качественная диагностика пародонтита, а также последующее его лечение, должны быть осуществлены как можно раньше. То сделать и проще, и эффективнее.
В нашей стоматологический клинике “22 век” оказываются комплексные услуги диагностики и терапевтического лечения пародонтита. Данные методы показывают отличные результаты и применяются многими современными клиниками во всем мире.
Ниже приведем терапевтические методы лечения пародонтита.
Лечение пародонтита лазером

Данный метод заслуженно считается одним из самых эффективных
Данный метод заслуженно считается одним из самых эффективных. Поскольку причиной заболевания являются бактерии, то главная задача состоит в уничтожении этих микроорганизмов и всех их продуктов жизнедеятельности.
Лазерное лечение пародонтита позволяет выполнять стерилизацию пародотальных каналов максимально тщательно и при этом очень деликатно. Полоскание специальными стоматологическими растворами, а также механическая чистка не дает столь высоких результатов.
Лазер помогает эффективно бороться с патогенной микрофлорой и уже после первой процедуры дает ощутимый результат. Болезненность при жевании, а также кровоточивость десен значительно снижаются.
Принцип метода заключается в ведении в пораженный пародонтальный карман лазерного светодиода и обработке тканей. Результат: карман становится стерильным, а на его стенках образуется фотокоагуляционная пленка, препятствующая проникновению новых микроорганизмов.
Данная пленка также способствует закрытию кармана и скорейшему его заживлению.
Лазерный метод лечения пародонтита безопасен, бескровен и не сопровождается болезненными ощущениями. Этот метод настолько эффективен, что при своевременном лечении, когда болезнь находится еще на ранней стадии, может быть вполне достаточного одного сеанса.
Ультразвуковой метод

Лечение дёсен аппаратом “Вектор”
Стоматологическая клиника “22 век” предлагает своим пациентам современное физиотерапевтическое лечение пародонтита с применением ультразвука.
Ультразвуковая установка “Вектор” при пародонтите помогает эффективно бороться с бактериями и налетом, оказывающем пагубное воздействие на ткани, располагающиеся вокруг зуба.
Данный метод лечения обладает следующими положительными качествами:
- Ультразвук борется с патогенными микроорганизмами;
- Осуществляется бесконтактная чистка зуба от налета, поскольку воздействие оказывается через жидкость путем передачи звуковых волн;
- Ультразвук проникает даже в самые труднодоступные места (например, в фуркации, корневые ответвления), что помогает добиться самых высоких результатов чистки;
- Микробы из пародонтального кармана вымываются при помощи промывающего раствора.
Недостатком терапевтического лечения пародонтита при помощи ультразвукового метода считаются неприятные ощущения, которые испытывает пациент во время проведения процедуры.
Антибиотики

Антибиотические препараты удаляют бактерии из полости рта и препятствуют их размножению
После выполнения физиотерапевтических процедур, врач назначает антибиотики.
К средствам лечения пародонтита относится специальный гель, который закладывается в десневые карманы, а также растворы для полосканий.
Антибиотические препараты удаляют бактерии из полости рта и препятствуют их размножению. При этом они оказывают только локальное воздействие, не влияя на нормальную микрофлору организма.
Шинирование
Одна из основных опасностей пародонтита, как уже было указано ранее, — это риск утраты зубов. Игнорирование своего состояния, а также откладывание визита к стоматологу нередко приводят к их подвижности.
В случае если фиксация зубов ослабла, для эффективного лечения, а также предотвращения выпадения, следует выполнить шинирование.
Суть метода заключается в соединении нескольких зубов между собой при помощи шины. В результате такой фиксации подвижность снижается, что существенно упрощает процесс заживления.
Шинирование помогает перераспределить нагрузку на зубной ряд при пережевывании пищи и снизить давление на пораженные пародонтитом зубы.
Однако стоит учитывать, что шинирование осуществить нет возможности в случаях, когда подвижными становятся сразу несколько рядом стоящих зубов.
Лечение пародонтита в стоматологической клинике “22 век”
Мы рекомендуем Вам не откладывать лечение.
В клинике “22 век” практикуется строго индивидуальный подход к определению метода терапевтического лечения хронического и острого пародонтита для каждой отдельной ситуации, что позволяет добиться хороших результатов в короткий срок.
Обращайтесь! Консультация главного врача проводится бесплатно!
Р. Т. Буляков
д. м. н., доцент, заведующий кафедрой стоматологии общей практики ИПО БГМУ, главный внештатный стоматолог Министерства здравоохранения Республики Башкортостан, заслуженный врач Республики Башкортостан, главный врач АУЗ «Республиканская стоматологическая поликлиника» (Уфа)
О. А. Гуляева
к. м. н., ассистент кафедры стоматологии общей практики ИПО БГМУ, врач- пародонтолог АУЗ «РСП» (Уфа)
Д. Н. Тухватуллина
к. м. н., доцент кафедры стоматологии общей практики ИПО БГМУ, заместитель главврача по лечебной части АУЗ «РСП» (Уфа)
Г. А. Саляхова
к. м. н., доцент, завуч кафедры стоматологии общей практики ИПО БГМУ, заведующая лечебно-профилактическим отделением АУЗ «РСП» (Уфа)
Профилактика и лечение воспалительных заболеваний пародонта являются серьезной стоматологической, общемедицинской и социальной проблемой, решение которой остается основным направлением современной стоматологии ввиду того, что эти заболевания являются наиболее распространенными после кариеса в мире, отличаются рецидивирующим течением и сложно поддаются терапии, несмотря на совершенствование методов диагностики и внедрение новых технологий [10, 11, 13, 15]. Хронический генерализованный пародонтит резистентен уже на этапе проведения инициальной терапии.
Воспалительные заболевания пародонта не только являются основной из причин потери зубов, но и могут привести к осложнениям, связанным с угрозой жизни пациента. Хронический пародонтит является одним из факторов риска развития системного воспалительного ответа, провоцирующего поражение сосудов, возникновение или утяжеление атеросклероза, сахарного диабета, ишемической болезни сердца, он повышает опасность инсульта и инфаркта миокарда в три раза, а также риск осложнений во время беременности больше, чем алкоголь или курение [1, 2, 11, 15].
Основным причинным фактором возникновения воспалительных заболеваний пародонта можно назвать субгингивальную пародонтальную микрофлору. Уровень знаний об этиологии и патогенезе воспалительных заболеваний пародонта заставляет признать бактериальную модель возникновения и течения заболевания как одну из причин, которую необходимо рассматривать в комплексе с индивидуальной реакцией организма человека и воздействием внешних факторов.
Результаты эпидемиологических и клинико-лабораторных исследований подтверждают, что возникновение воспалительных заболеваний пародонта складывается из следующих факторов: бактерии, реакция макроорганизма, внешняя среда [10, 11, 13, 15].
Сложно недооценить роль поддесневой биопленки в возникновении и хроническом рецидивирующем течении воспалительных заболеваний пародонта — уровень научных знаний об этиопатогенезе пародонтита определяет пародонтальную микрофлору в составе биопленки в качестве доминирующего этиологического фактора. Биопленка — это организованные в микроколонии, взаимодействующие микроорганизмы, сгруппированные при помощи вырабатываемого ими защитного адгезивного липополисахаридного матрикса.
Сами бактерии составляют 5—35 % массы биопленки, остальная часть — межклеточный матрикс. Микроорганизмы в биопленке существуют и ведут себя не так, как бактерии в культуральной среде. К примеру, бактерия в биопленке может вырабатывать такие факторы вирулентности, которые она не продуцирует, будучи в культуральной среде, и иметь резистентность к препаратам губительным для нее в лабораторной культуре.
Матрица биопленки формирует экологическое убежище, эффективно защищающее бактериальные клетки как от действия лекарственных препаратов, так и от иммунных защитных факторов макроорганизма. Микроорганизмы в биопленке более устойчивы к антибиотикам, антимикробным средствам и другим активным агентам. Механизм увеличения устойчивости бактерий к антибиотикам в биопленках обусловлен как ограничением проникновения антибиотиков через биопленку, так и генной изменчивостью у персистирующих в биопленке бактерий.
Для достижения эффективности антибактериального или противомикробного препарата в биопленке (применяемого как местно, так и системно) может потребоваться значительное увеличение концентрации препарата. Например, время проникновения ципрофлоксацина внутрь биопленки Pseudomonas aerogenosa увеличивается в 30 раз по сравнению со временем, требуемым для проникновения препарата внутрь одиночной клетки, а устойчивость к антимикробным препаратам возрастает в 50—1000 раз по сравнению со свободными и «флоттирующими» микроорганизмами.
Говорить об успехе пародонтальной терапии, и рассчитывать на долговременность результатов лечения без физического разрушения биопленки не приходится.
Решающим для успешного пародонтального лечения являются постоянный контроль за реинфекцией в карманах и профилактические мероприятия. Только за счет точного мониторинга карманов и профессиональной гигиены в сочетании с удалением поддесневой бактериальной пленки можно избежать реинфекции или замедлить ее наступление [5, 7, 12, 13, 15].
Неотъемлемой частью всех схем лечения и профилактики воспалительных заболеваний пародонта на различных стадиях является рациональная индивидуальная гигиена полости рта.
Профессиональная же гигиена полости рта — не только составная часть лечебных мероприятий, но и краеугольный камень системы профилактики заболеваний пародонта [2—5, 7, 10, 11, 13, 15], базовая составляющая поддерживающей пародонтальной терапии (Supportive Periodontal Therapy — SPT).
В литературе имеется множество подтверждений эффективности методов воздействия на поддесневую биопленку в комплексе первичного пародонтального лечения. По данным ряда авторов, эти методы, в частности, ультразвуковая терапия с суспензией гидроксиапатита кальция — Vector (Durr, Германия) — и воздушно-абразивная субгингивальная терапия взвесью глицина —
Perio-Flow (EMS, Швейцария), — являются целенаправленными щадящими способами минимально инвазивной терапии, позволяющей добиться разрушения биопленки [3—6, 8, 9, 14].
Пародонтальная терапия будет неэффективной без поддержки. Cанация пародонтальных карманов позволяет подавить поддесневую микрофлору, вызывающую пародонтит, но в течение дней или месяцев контаминация пародонтальными патогенами может достичь того же уровня, что и до лечения. Реинфекция к началу поддерживающей пародонтальной терапии часто является следствием недостаточного первичного лечения. Тщательная SPT — ключ к успеху пародонтологического лечения [7, 12, 13, 15].
Поддерживающая пародонтальная терапия — часть пародонтологической терапии, проводимая пародонтологом либо гигиенистом под наблюдением стоматолога и включающая в себя:
- обновление медицинского и стоматологического анамнеза;
- внутриротовое и внеротовое обследование мягких тканей, слизистой оболочки (онкологическая настороженность);
- пародонтологическое обследование;
- обследование зубов, имплантатов;
- оценку состояния окклюзии;
- оценку эффективности индивидуальной гигиены полости рта с повторным инструктажем по гигиене;
- рентгенологическое исследование, отслеживание динамики;
- удаление поддесневого и наддесневого камня и налета;
- устранение микрофлоры из зубодесневой борозды и пародонтальных карманов;
- селективное сглаживание поверхности корня (по показаниям);
- полирование зубов;
- фторирование зубов;
- антимикробное, хирургическое лечение по показаниям;
- консультирование со смежными специалистами при необходимости;
- информирование пациента о настоящем статусе и определение сроков следующего этапа SPT [15].
При визите к стоматологу для проведения SPT проводится оценка следующих параметров пародонтологического статуса (к п. 3 вышеперечисленного списка манипуляций в рамках поддерживающей пародонтальной терапии):
- глубина карманов при зондировании;
- кровоточивость при зондировании;
- общий уровень налета и камня;
- степень вовлечения бифуркации;
- наличие экссудации;
- состояние окклюзии и подвижности зубов;
- рецессия десны;
- состояние протеза или абатмента (при наличии имплантатов);
- состояние окклюзии.
SPT начинается после окончания активного пародонтологического лечения (Американская академия пародонтологии, 2000), продолжается пожизненно, регулярно с подбираемой индивидуально периодичностью с целью оказания помощи пациенту в поддержании здорового состояния структур полости рта. Профилактические мероприятия проводят в области всех зубов и имплантатов. В случае прогрессирования заболевания SPT может быть временно прервана и переведена в активную фазу.
Доказано, что вероятность потери зубов обратно пропорциональна количеству посещений пародонтолога (или сеансов SPT) [Американская академия пародонтологии, 2000]. Через 10 лет после окончания активного пародонтологического лечения у пациентов, которые периодически подвергались SPT, глубина карманов при зондировании была значительно меньше, а случаи потери зубов реже по сравнению с пациентами, которым SPT не проводили [12].
Многие исследования продемонстрировали эффективность SPT, показав, что у пациентов, которые регулярно подвергаются SPT, наблюдается меньшая потеря прикрепления и зубов, чем у тех, кому сеансы проводят SPT проводят менее регулярно или не проводят вообще, а также что прогрессирование гингивита в пародонтит можно предотвратить или замедлить с помощью оптимальной индивидуальной гигиены или периодического проведения SPT [7]. Поскольку пациенты редко могут обеспечить эффективное удаление налета, процедуры SPT позволяют снизить риск потери прикрепления.
В современной пародонтологии, как и в автосервисе, интервалы между «инспекционными осмотрами» и объем поддерживающей терапии планируются в соответствии с уровнем индивидуального риска [10]. Апробированы различные подходы к тому, чтобы реализовать эту идею на практике, однако стандартная программа до сих пор не сложилась.
При выборе частоты SPT и объема мероприятий все еще служит клинический опыт. Учитываются следующие факторы и параметры [10]:
- количество зубов;
- количество карманов с глубиной более 5 мм;
- процент карманов с положительным тестом на кровоточивость;
- деструкция кости в области боковых зубов (учитывая возрастной фактор);
- соматический и генетический фактор;
- количество сигарет, выкуриваемых в течение дня;
- уровень психосоциального стресса.
Для большинства пациентов, страдающих гингивитом, но без потери пародонтального прикрепления в анамнезе достаточно посещать стоматолога каждые шесть месяцев. Пациентам, имеющим в анамнезе пародонтит, показано посещение стоматолога каждые три месяца, поскольку именно при наличии таких интервалов снижается вероятность прогрессирования заболевания по сравнению с пациентами, подвергающимся SPT реже.
Интервалы в 3 месяца между сеансами SPT считаются достаточными для проведения эффективной терапии и стойкого подавления потенциально патогенных микроорганизмов, но они могут варьироваться в зависимости от клинической ситуации. При повторном возникновении заболеваний пародонта необходимо рассмотреть возможность проведения дополнительных диагностических и лечебных мероприятий.
Промежутки между курсами SPT можно изменять в зависимости от данных новых исследований и публикаций, а также мнения стоматолога.
Несоблюдение рекомендованных интервалов SPT может повлиять на результат терапии. К сожалению, многолетний опыт ряда авторов говорит о том, что большинство пациентов (55—84 %) не склонны соблюдать предложенный режим визитов к пародонтологу, 28 % пациентов в рамках программы поддерживающей терапии не являются уже на первое посещение к врачу [12].
Цель исследования — оценка влияния методов воздействия на субгингивальную биопленку в комплексе поддерживающей пародонтальной терапии.
Материалы и методы
Объект исследования — 123 пациента пародонтологического подразделения хирургического отделения АУЗ «Республиканская стоматологическая поликлиника» г. Уфы, проходивших SPT, из них 72 (57,7 %) — женщины, 51 (42,3 %) — мужчины. 50,4 % (62) пациентов наблюдались с диагнозом «хронический генерализованный пародонтит средней степени тяжести», 30,9 % (38) — с пародонтитом тяжелой степени, 18,7 % (23) — с пародонтитом легкой степени.
После проведения комплексной базовой терапии проводились сеансы поддерживающей пародонтальной терапии с индивидуально подобранными интервалами: через 3—7 недель — 1-е посещение, через 2—3 месяца — 2-е, через 6 месяцев — 3-е и еще через 6 месяцев — 4-е.
В комплексе SPT 1-й группы наблюдаемых (группа V — 48 человек) проводили процедуру Vector в рамках регулярной профессиональной гигиены (рис. 1) , во 2-й группе (группа P — 31 человек) — процедуру Perio-Flow (рис. 2) , в 3-й группе (группа VP — 21 человек) эти две процедуры чередовали, в контрольной группе (23 человека) проводилась стандартная профессиональная гигиена пъезоэлектрическим скейлером и воздушно-абразивная полировка. Соотношение пациентов с пародонтитом легкой, средней и тяжелой степени в каждой группе составило 1 : 2 : 1.
Рис. 1. Обработка пародонтального кармана методом Perio-Flow в рамках SPT
Рис. 2. Проведение Vector-терапии на клиническом приеме
Рис. 3. Динамика изменения глубины пародонтального кармана за все время SPT
Для оценки состояния тканей пародонта и анализа результатов проводимой терапии заполнялась модифицированная нами пародонтограмма, где фиксировалась глубина пародонтального кармана (ПК) с определением следующих показателей:
- индекс гигиены полости рта Silness-Loe (S-L) (Silness, Loe, 1967),
- упрощенный индекс гигиены полости рта OHI-S (J. C. Green, J. K. Vermillion, 1963),
- оценка кровоточивости десен по индексу PBI (papilla bleeding index) (Мuhllemann-Sukser),
- пародонтологический индекс PMA (Schour, Massler) в модификации Parma для количественного определения степени выраженности воспаления.
Глубину ПК определяли с помощью стандартной методики, делая по 3 измерения с вестибулярной и небной поверхности 6 зубов у каждого из пациентов (1.6, 2.5, 2.6, 3.6, 3.1., 4.6) пародонтальным калибровочным зондом (D=0,5мм) со стандартным давлением 240 N/см, регистрируя глубину с точностью до 1 мм. Для оценки состояния костной ткани проводили цифровую ортопантомографию на аппарате TROPHYPAN eXpert DC. Статистический анализ данных осуществляли с использованием стандартных пакетов программ прикладной статистики.
При описании количественных признаков использовали среднюю арифметическую (М), стандартную ошибку средней (m), при описании качественных признаков вычислялись относительные доли и стандартная ошибка доли. Проверка статистических гипотез заключалась в сравнивании полученного уровня значимости (р) с пороговым уровнем 0,05. При р Результаты исследования
Изучение пародонтологического статуса пациентов в 1-е посещение достоверной статистически значимой разницы не выявило, гигиена полости рта и индексы воспаления десны остались на уровне (с незначительным сдвигом), зафиксированном после фазы активного лечения. Пациентам были проведены необходимые процедуры и повторный инструктаж по индивидуальной гигиене.
Через 3 месяца разница в степени выраженности воспаления в тканях пародонта (согласно индексу PMA) и кровоточивости десны между контрольной и основными группами увеличилась — значения индекса кровоточивости составили в группе V 1,21 ±0,06, в группе P 1,19 ±0,08, в группе VP 1,18 ±0,08, в контрольной 1,8 ±0,04.
Уровень индексов гигиены полости рта через 3 месяца увеличился во всех группах, но в контрольной более значимо, особенно индекс придесневого налета S-L: в основной группе он увеличился на 26,5 ± 2,9 % (в 3 основных в среднем на 9,8 ± 1,1 %) (p Заключение
Успешная пародонтальная терапия и регулярное проведение курсов SPT могут улучшить состояние пародонта и снизить вероятность потери зубов. Длительность ремиссии заболеваний пародонта также зависит от активного ухода во время проведения SPT.
Результат поддерживающей пародонтальной терапии — минимизация прогрессирования заболеваний пародонта у пациентов, подвергшихся лечению, увеличение вероятности своевременного выявления и лечения других заболеваний или состояний в полости рта. Несомненно, SPT является нужной и эффективной для пациентов с воспалительными заболеваниями пародонта и должна иметь приоритет в ежедневной стоматологической практике.
Поддерживающая пародонтальная терапия с постоянным контролем мотивации индивидуальной гигиены и применением методов разрушения биопленки этиопатогенетически обоснована и является залогом успешных результатов лечения и профилактики в клинике пародонтологии.
Список литературы находится в редакции
Болезни пародонта – это обобщающий термин, используемый для описания инфекционного воспалительного процесса, который может поражать один структурный элемент или комплекс составных элементов пародонта. Структуры, поддерживающие зуб, представлены альвеолярной костью, периодонтальной связкой и цементом корня. Заболевания пародонта в основном спровоцированы действием зубного налета или микробной биопленкой, представляющей собой гетерогенную структуру из патогенных микроорганизмов. Более 500 видов микроорганизмов считаются потенциальными этиологическими агентами, провоцирующими поражение тканей пародонта. Кроме них, вирусы и грибки тоже играют не последнюю роль в патогенетическом процессе. При возникновении и прогрессировании заболевания патогенные микроорганизмы колонизируют область десен, окружающую зуб, а вследствие их воздействия на ткани начинает формироваться пародонтальный карман. В глубоких пародонтальных карманах можно найти до 109 разновидностей бактерий, но несмотря на потенциал многих патогенов, которые ассоциируются с заболеваниями пародонта, лишь небольшое их количество связано с активной фазой заболевания.

Socransky и коллеги разделили патогенные микроорганизмы, участвующие в прогрессировании заболевания на две основные группы: "красный" и "оранжевый" комплексы. Красный комплекс включает в себя следующие грамотрицательные анаэробные бактерии: Porphyromonas gingivalis, Treponema denticola и Tanneralla forsythia, в то время как оранжевый комплекс состоит из Prevotella nigrescens, Peptostreptococcus micros, Campylobacter rectus, Centruroides gracilis, Campylobacter showae, Eubacterium nodatum и Streptococcus constellatus. Кроме них, с болезнями пародонта тесно ассоциируются Aggregatibacter actinomycetemcomitans и Eikenella corrodens. В результате многочисленных исследований было установлено, что для достижения успешного результата лечения, один из аспектов терапии должен быть направлен именно на нейтрализацию данных бактерий, жизнедеятельность которых напрямую связана с протеканием заболевания.
Антибиотики
Системная антибиотикотерапия должна рассматриваться как один из приемлемых вариантов лечения пациентов с пародонтитом. Данный подход актуален для пациентов, резистентных к обычной терапии заболевания, или у которых наблюдаются следующие проблемы со здоровьем: наличие абсцесса, компромиссное или ослабленное состояние иммунитета, неконтролируемый сахарный диабет, присутствие признаков и симптомов системных поражений, лихорадки и лимфаденопатии. Выбор наиболее подходящего системного антибиотика должен основываться на результатах культивирования микроорганизмов и тестирования их чувствительности к определенному препарату. Таким образом, удается узнать, во-первых, какие микроорганизмы присутствуют в области поражения, и, во-вторых, подобрать наиболее эффективный и действующий агент. Но следует помнить, что системная антибиотикотерапия не должна быть единственным методом лечения, а лишь представлять собой сегмент комплексного подхода обследования, диагностики и разработки адекватной системной терапии. Антибиотикотерапия, как и какой-либо другой метод лечения, имеет свои преимущества и недостатки. Поскольку прием данных препаратов является довольно таки известным методом лечения, пациенты, как правило, понимают основные ключевые моменты данного лечения, и без проблем соглашаются на предложенный алгоритм курса медикаментов. Но вместе с тем, пациенты часто могут путать официальные основные наименования лекарств, забывать дозу, время или даже сам факт их приема, нарушая тем самым эффект их действия. Системные антибиотики могут вызывать побочные эффекты и нарушения функционирования желудочно-кишечной системы в форме диареи или абдоминальных спазмов. Другие возможные негативные влияния препаратов связаны с аллергическими реакциями и возникновением резистентности бактерий к антибиотикам при их длительном и неконтролируемом приеме. Бактериальная резистентность является серьезной проблемой в медицине, поскольку она формирует ряд других научно-клинических дилемм относительно терапевтического соотношения риска лечения против потенциальной пользы от приема антибиотиков.
Системные антибиотики достигают тканей пародонта путем транссудации из сыворотки крови, после чего проходят через соединительный эпителий и выстилку десневого кармана, чтобы попасть в область десневой борозды. Эффективная концентрация антибиотика при достижении им десневой борозды во время курсового приема отличается от таковой в любой другой системе тканей или органе с признаками инфицирования, что связано со специфической структурой пародонта. Существует ряд уже хорошо апробированных схем приема антибиотиков для лечения заболеваний пародонта, которые, как правило, используются в сочетании с механическим удалением над- и поддесневых отложений и бактериального налета. Данный подход в комплексе с эффективной домашней гигиеной полости рта направлен на снижение бактериальной нагрузки в области тканей десны выше и ниже маргинальной границы. Некоторые врачи обычно назначают схемы антибиотикотерапии для лечения и управления заболеваниями пародонта на основе амоксициллина (375 мг) и метронидазола (500 мг) при приеме препаратов 3 раза в день в течение 7 дней в сочетании с проведением скейлинга ротовой полости и полной очисткой области корней в первые 48 часов. Такой подход помогает достичь уменьшения глубины карманов и снизить уровень кровотечения, что было обнаружено при сравнении результатов лечения в исследуемой и контрольной группах. Альтернативная схема лечения предусматривает прием азитромицина (500 мг) в течение 3 дней до проведения процедуры полного удаления зубного камня и очистки поверхности корней, чтобы уменьшить количество бактерий красного комплекса и снизить показатели гингивального индекса. При отсутствии возможностей проведения посева культуры бактерий и определения их чувствительности к антибиотикам, можно пользоваться эмпирическим принципом назначения препаратов для лечения пародонтита. Обоснованные варианты лечения включают в себя комбинацию амоксициллина и метронидазола (250 мг - 500 мг каждого) с приемом препаратов 3 раза в день в течение 8 дней, или комбинацию метронидазола и ципрофлоксацина (500 мг) в течение 8 дней по 2 раза в сутки.
Местная антибиотикотерапия является альтернативным адъюватным вариантом лечения, который также может применятся в ходе лечения поражений пародонта. Суть процедуры состоит в доставке антибиотика непосредственно в пародонтальный карман – то есть прямо в место колонизации патогенных бактерий, при этом концентрация антибиотика в области поражения по сравнению с системным приемом заметно увеличивается. Другим преимуществом является отсутствие потенциальных нарушений расстройств желудочно-кишечного тракта и аллергических реакций. Первым антибиотиком, используемым для местного лечения, был Actisite (пародонтальный тетрациклин). Он состоял из нерезорбируемых, пропитанных тетрациклином, волокон, которые помещались непосредственно в пародонтальный карман и оставались там в течение 10 дней – вплоть до следующего визита к стоматологу. Со временем проходило усовершенствование препаратов и методов их доставки в область пародонтального поражения. Таким образом, был разработан Atridox (Denmat), который является первым резорбируемым антибиотиком местного действия, состоящим из гелевой формы доксициклина. Данный препарат вводится в карман с помощью шприца, и при контакте со слюной – затвердевает, приобретая восковую консистенцию. Таким образом, антибиотик может выделятся из затвердевшей фазы на протяжении 21 дня. Arestin (Orapharma) также является представителем местных рассасывающихся препаратов антибактериального действия, который состоит из гранул миноциклина в форме порошка. Поставляется он в виде ампул, заряженных в шприц. Порошок вводится непосредственно в пародонтальный карман, высокий уровень его терапевтического действия продолжается в течении 14 дней, а сам препарат остается в кармане на протяжении 28 суток. Исследования доказали, что использование антибиотиков местного действия вместе с процедурой полного удаления зубного камня и очисткой поверхности корней позволяет добиться клинически эффективных результатов: наблюдается уменьшение глубины карманов и частичное восстановление нарушенного биологического прикрепления.
Противомикробные ополаскиватели полости рта
Противомикробные полоскания являются хорошо известными и приемлемыми процедурами, эффективно дополняющими комплексное лечение воспаления тканей десен. Примерами аргументированного их использования являются ситуации, когда пациент не в состоянии обеспечить оптимальный уход за полостью рта с помощью обычных гигиенических средств в домашних условиях, например, в послеоперационный период. Чтобы правильно выбрать ротовой ополаскиватель, который бы эффективно справлялся с воспалением десен и в то же время с профилактикой зубного налета, нужно узнать имеет ли он Сертификат одобрения Американской стоматологической ассоциацией. Если да, то данный продукт прошел через ряд клинических, биологических и лабораторных испытаний, которые доказали его противовоспалительную и антибактериальную эффективность. Однако, следует понимать, что данная оценка является рекомендательной, но никак не директивной в отношении препарата. Единственными ополаскивателями, доступными на рынке с соответствующей оценкой Ассоциации, являются представители с фенольными составляющими, по типу Listerine и других аналогичных версий. Золотым стандартом среди антимикробных ополаскивателей также считается хлоргексидин глюконат (0,12%), который в США отпускается лишь по рецепту и известен под коммерческими названиями Peridex и PerioGuard (Colgate-Palmolive). Хлоргексидин является наиболее эффективным антимикробным ополаскивателем, снижающим число бактерий и обеспечивающим эффективное лечение гингивита. Препарат более эффективен в отношении грамположительных бактерий и дрожжей, и менее эффективен в борьбе с грам-отрицательными патогенами. Его обычно назначают в послеоперационный период для снижения бактериальной нагрузки в период заживления. Хлоргексидин имеет высокую субстантивность, что обеспечивает его пролонгированное действие. Некоторые побочные эффекты, связанные с использованием хлоргексидина, включают потенциальное окрашивание зубов и спинки языка; изменение вкусовых восприятий; риск возможного образования наддесневого камня, формирование признаков мукозита и десквамации эпителия. Другими противомикробными ополаскивателями, доступными для широких масс, но менее часто рекомендованными специалистами, являются производные четвертичного аммония, такие как Cepacol (Reckitt Benckiser). Продукты на основе сангвинарина, по типу Viadent, больше широко не доступны на рынке. Продукты на основе оксигенатов, как пероксид водорода, рекомендуется чаще использовать в форме пасты. Они владеют противовоспалительными свойствами, благодаря которым уменьшаются признаки кровотечения. Последнее является важным критическим показателем для оценки воспаления пародонта. Однако данные представители имеют лишь небольшое влияние на уровень бактериальной контаминации, а в последнее время все чаще высказывается мнение об их возможном канцерогенном потенциале. Триклозан является еще одним антимикробным агентом, поставляющимся в форме зубных паст и ополаскивателей. Тем не менее, согласно данных исследований, он тоже демонстрирует минимальное влияние на микробную флору полости рта, а безопасность его использования до сих пор находится под вопросом.
Противовоспалительные агенты
Мы должны помнить, что заболевания пародонта имеют инфекционную природу, а воспалительные явления являются иммунным ответом организма на микробную контаминацию. В воспаленных тканях процесс размножения патогенных бактерий происходит быстрее, что приводит к прогрессированию патологических и разрушительных эффектов воспалительного процесса, посредством активации клеток иммунной системы организма (макрофагов и их предшественников, моноцитов, лимфоцитов, и полиморфноядерных лейкоцитов, таких как нейтрофилы). Компоненты микробной структуры, по типу липополисахарида, который находится в стенках клеток грамотрицательных анаэробных микроорганизмов, активируют макрофаги для продуцирования и секретирования провоспалительных цитокинов, таких как интерлейкин-1 (IL-1) и фактор некроза опухолей-альфа (TNF-alpha). Интерлейкин-1 стимулирует резорбцию кости, а также способствует высвобождению PGE2 клетками фибробластов, которые являются основными и наиболее распространенными типами клеток соединительной ткани. Фибробласты синтезируют коллаген – основной структурный белок соединительной ткани, который является также основным компонентом волокон десны и кости. Данные клетки и клетки воспалительной реакции (нейтрофилы и макрофаги) синтезируют матриксные металлопротеиназы (ММР), которые представляют собой ферменты или белки, участвующие в ряде биологических реакций. Например, ММР-1 и ММР-8 являются ферментами, которые принимают участие в деградации коллагена, что значительно ослабляет структуру пародонта. Активация иммунной системы по своей сути является защитной реакцией организма – ответом на бактериальную инвазию, однако в ходе механизма реализации иммунного ответа происходит разрушение тканей самого организма-хозяина. Данный феномен связан с высвобождением цитокинов, провоспалительных медиаторов и ММР, поскольку данные агенты действуют не только локально на ткани пародонта, но попадая в кровоток могут вызвать и нежелательные системные эффекты.
ММР являются группой протеолитических ферментов, обнаруженных в тканях пародонта, которые в своем составе имеют коллагеназу и желатиназу. Функция данных ферментов состоит в ремоделировании внеклеточного матрикса. Поскольку исследователями было обнаружено, что доксициклин имеет антиколлагенлитические свойства, они предложили использовать его в качестве модуляторного агента для лечения пародонтита. Субантимикробные дозы доксициклина (20 мг дважды в день) являются эффективными для ингибирования активности коллагеназы, и в то же время никак не влияют на фактор антимикробной резистентности при его использовании в сочетании с полным удалением зубного камня и очисткой поверхности корней. Такой подход обеспечивает максимальный эффект для восстановления биологического прикрепления тканей и снижения глубины пародонтальных карманов.
Пероральные лекарственные средства
Нестероидные противовоспалительные препараты (НПВП) также были изучены в качестве ингибиторов реакции организма хозяина при лечении заболеваний пародонта. Механизм их действия состоит в предотвращении продукции простагландинов. Простагландин Е2 (PGE2) напрямую ассоциирован с процессами воспаления и резорбции костной ткани, что подтверждено его верификацией в пораженных пародонтальных участках. В ходе изучения различных НПВП (флурбипрофен, ибупрофен, кеторолак, напроксен, аспирин), которые вводились системно или локально, было обнаружено, что при их сочетании с процедурой полного удаления зубного камня и очисткой поверхности корней, удавалось сохранить имеющуюся высоту альвеолярного гребня, предупреждая его резорбцию. Бисфосфонаты представляют собой класс препаратов, ингибирующих резорбцию альвеолярной кости, которые также были использованы в качестве хост-модулирующих агентов при лечении заболеваний пародонта. Исследования показали, что бисфосфонаты при использовании в сочетании с полной очисткой полости рта, обеспечивают снижение глубины пародонтальных карманов и уровня кровотечения во время зондирования, а также улучшают восстановление биологического прикрепления и обеспечивают сохранение высоты альвеолярного гребня. Однако, несмотря на потенциальные преимущества бисфосфонатов, исследования показали, что длительное применение и высокие дозы препаратов инициируют остеонекроз челюстей. Очевидно, что для аргументированных выводов необходимо проведение дальнейших более детализированных исследований, которые помогут определить соотношение потенциальной пользы препаратов и относительного риска осложнений в процессе лечения пародонтита.
Хост-модулирующая терапия
Локальное применение хост-модулирующих агентов, таких как эмалевые матриксные протеины, костные морфогенетические белки и тромбоцитарные факторы роста, может быть довольно эффективным в ходе комплексного лечения пародонтита. Эмалевые матриксные протеины доступны в форме препарата Emdogain (Straumann) и успешно используются в ходе восстановления пародонтальных дефектов. Данные белки играют роль модуляторов заживления, стимулируя регенерацию всех пародонтальных компонентов поддерживающего аппарата зуба. Костные морфогенетические белки способствуют модуляции и дифференциации мезенхимальных клеток в клетки-предшественники костной ткани. Они действуют в качестве каркаса, на который может наращиваться новая костная ткань, и часто используются при направленной костной регенерации во время аугментации альвеолярного гребня. Наконец, тромбоцитарные факторы роста усиливают хемотаксис нейтрофилов и моноцитов, стимулируют пролиферацию фибробластов, а соответственно и синтез внеклеточного матрикса, а также повышают уровень дифференциации мезенхимальных клеток-предшественников, фибробластов и эндотелиальных клеток. Именно тромбоцитарные факторы роста наиболее часто используется при хирургических вмешательствах на тканях пародонта с целью ускорения их регенерации.
Выводы
Новые знания относительно хост-бактериальных взаимодействий и иммунных реакций организма, которые провоцируют поражение тканей пародонта, станут полезными для разработки более новых и эффективных концепций лечения пародонтита с использованием системных и местных антибиотиков, антимикробных ополаскивателей и принципов хост-модулирующей терапии. Результаты дальнейших исследований могут пролить свет на вспомогательную адьювантную терапию, которая может быть использована для коррекции алгоритмов лечения с целью достижения наиболее успешного эффекта комплексной терапии поражений поддерживающего аппарата зуба.
Читайте также:

