Спирт который используется в парфюмерной промышленности входит в состав кремов помад зубных паст
Опубликовано: 17.04.2024
В составе веществ, образующих клетки всех живых организмов (бактерий, растений, животных, человека), обнаружено более 70 химических элементов. Их принято делить на две большие группы: макро- и микроэлементы.
Макроэлементы содержатся в клетках в больших количествах. Это углерод, водород, кислород и азот, которые в сумме составляют 98% всего содержимого клетки. К макроэлементам также относят магний, калий, кальций, натрий, фосфор, серу и хлор. Суммарное содержание их в клетке составляет 1,9%. Таким образом, на долю всех остальных элементов приходится около 0,1%. Эти элементы называют микроэлементами. К ним относятся железо, цинк, марганец, бор, медь, кобальт, иод, бром, фтор и др.
Как можно отметить, в клетках живых организмов, в том числе и человека (рис. 31), нет каких-либо особых химических элементов, характерных только для живой природы, т. е. на атомном уровне различий между живой и неживой природой нет. Эти различия начинаются лишь на уровне сложных веществ — на молекулярном уровне. Так, наряду с неорганическими веществами (водой и минеральными солями) клетки живых организмов содержат вещества, характерные только для них, — органические вещества (белки, жиры, углеводы, нуклеиновые кислоты, витамины, гормоны и др.).

Относительный состав клеток живых организмов обобщенно можно представить так: вода— 70—80%, минеральные соли — 1, белки — 10—20, нуклеиновые кислоты — 1—6, жиры — 1—5, углеводы — 1—2%.
В то время как неорганические вещества встречаются и в неживой природе, органические соединения характерны только для живых организмов, долгое время служивших единственным источником их получения.
Основу цепочки природных взаимопревращений органических веществ, в состав молекул которых входит кислород, т. е. кислородсодержащих органических соединений, составляет уже знакомая вам реакция фотосинтеза:

Растворы, содержащие углеводы (например, глюкозу), под действием особых веществ природного происхождения — ферментов — превращаются в этиловый спирт. Такой процесс называют спиртовым брожением:

Получение этилового спирта — одна из древнейших химических реакций, открытых и используемых человечеством.
Со спиртами мы уже встречались не раз. Впервые вы познакомились с ними при изучении алкенов. Этиловый спирт С2Н5ОН — это продукт реакции гидратации этилена, а также исходное вещество для лабораторного способа получения этилена реакцией дегидратации. При изучении этилена вы познакомились еще с одним представителем спиртов — двухатомным спиртом этиленгликолем НОСН2—СН2ОН, образующимся в результате окисления этилена раствором перманганата калия.
Нетрудно заметить, что особенность химического строения спиртов заключается в наличии в составе их молекулы особой функциональной группы атомов — гидроксильной группы —ОН.

Число гидроксильных групп в молекуле спирта определяат его атомность. Знакомство со спиртами мы начинаем с простейших — с предельных одноатомных спиртов или алканолов.

Начинает гомологический ряд предельных одноатомных спиртов метиловый спирт, или метанол,
Вторым членом гомологического ряда является хорошо знакомый вам из курса основной школы этиловый спирт, или этанол,
Формуле третьего члена гомологического ряда алкано- лов С3Н7ОН будут соответствовать уже два пропиловых спирта, или пропанола. Дело в том, что, начиная со спиртов этого состава, появляется еще один вид изомерии, который называют изомерией положения функциональной группы. Формулы изомерных пропиловых спиртов:

Как вы помните, пропанол-2 можно получить гидратацией пропена, которая протекает в соответствии с правилом Марковникова.
Спирты состава С4Н9ОН существуют уже в виде четырех изомеров, различающихся не только положением функциональной группы:

но и строением углеродного скелета:

На этих примерах вы смогли познакомиться со способами образования названий предельных одноатомных спиртов.

Названия одноатомных спиртов образуются от названий соответствующих (по числу атомов и строению углеродной цепи) углеводородов с прибавлением суффикса . Положение гидроксильной группы в главной цепи молекулы указывают цифрой после суффикса .
Отметим, что для спиртов характерен еще один вид изомерии, с которым вы уже встречались, — межклассовая изомерия: предельные одноатомные спирты изомерны простым эфирам. Например, изомерны этиловый спирт С2Н5ОН и диметиловый эфир СН3—О—СН3. Именно этот пример мы приводили в § 2.
Так как с представителями простых эфиров, как учащиеся непрофильных классов, вы больше не встретитесь, подчеркнем, что их состав может быть отражен общей формулой R—О—R'.
Уже первые члены гомологического ряда предельных одноатомных спиртов, несмотря на небольшие значения относительных молекулярных масс, представляют собой жидкости. Это объясняется образованием между молекулами особой химической водородной связи.

За счет водородной связи молекулы низших спиртов ассоциированы в жидкости (рис. 32):

Первые представители гомологического ряда алкано- лов прекрасно растворяются в воде, так как образуют водородные связи с молекулами воды (рис. 33).
Познакомимся с химическими свойствами предельных одноатомных спиртов.
Как и все органические соединения, спирты горят:

Последнюю реакцию применяют не только в хорошо известных вам спиртовках, но также и в двигателях внутреннего сгорания. На рисунке 34 изображена автозаправочная станция в Бразилии, которая предлагает в качестве топлива на выбор бензин, смесь бензина с этиловым спиртом и просто этиловый спирт с добавкой метанола, чтобы водители его не пили. Машины с двигателями, работающими на этаноле, используются в Бразилии уже более 10 лет.
Наличие в молекулах спиртов гидроксильной группы определяет общие свойства представителей этого класса соединений.

Спирты взаимодействуют с металлическим натрием, образуя соли с общим названием — алкоголяты:

Спирты вступают в реакцию дегидратации:
а) внутримолекулярная дегидратация — это хорошо знакомый вам лабораторный способ получения этилена:

б) межмолекулярная дегидратация приводит к образованию уже знакомых вам простых эфиров:

Оксидом меди (И) спирты окисляются в соответствующие альдегиды (рис. 35):

С карбоновыми кислотами спирты вступают в реакцию этерификации, образуя при этом сложные эфиры, с которыми вы будете подробно знакомиться в § 13:

Рассмотрим отдельных представителей одноатомных и многоатомных спиртов.
Метанол (метиловый спирт) СН3ОН (рис. 36) — бесцветная жидкость с характерным запахом, tкип = 64,7 °С, горит чуть голубоватым пламенем.
Историческое название метанола — древесный спирт — объясняется одним из старых способов его получения — перегонкой дерева. Метанол — прекрасный растворитель, его используют также для производства формальдегида, некоторых лекарственных веществ. Метанол наряду с этанолом можно добавлять в моторное топливо для увеличения октанового числа.
Метанол очень ядовит! Он является нервно-сосудистым ядом.

При попадании в организм от 5 до 10 мл этого вещества наступает паралич зрения вследствие поражения сетчатки глаз, доза в 30 мл и более вызывает смерть.
Этанол (этиловый спирт) С2Н5ОН (рис. 37) — бесцветная жидкость с характерным запахом, tкип = 78,3 °С, смешивается с водой в любых соотношениях.
При попадании в организм человека этилового спирта происходит снижение болевой чувствительности и блокировка процессов торможения в коре головного мозга — наступает состояние опьянения. На этой стадии действия этанола увеличивается водоотделение в клетках и, следовательно, ускоряется мочеотделение, в результате чего происходит обезвоживание организма. Кроме того, этанол вызывает расширение кровеносных сосудов. Усиление потока крови в кожных капиллярах приводит к покраснению кожи и ощущению теплоты.
В больших количествах этанол угнетает деятельность головного мозга (стадия торможения), вызывает нарушение координации движений. Промежуточный продукт окисления этанола в организме — ацетальдегид — ядовит и вызывает тяжелые отравления. Систематическое употребление этилового спирта и содержащих его напитков приводит к стойкому снижению продуктивности работы головного мозга, гибели клеток печени и замене их соединительной тканью — циррозу печени.
Помимо производства алкогольной продукции, этанол находит широкое применение в различных отраслях промышленности (рис. 38, 39).


Глицерин — это представитель трехатомных спиртов (рис. 40). Его формула


В отличие от уже знакомого вам двухатомного спирта этиленгликоля, глицерин не ядовит. Он неограниченно растворим в воде, более того, очень гигроскопичен. Если оставить глицерин в открытом сосуде, его масса увеличивается до 40% за счет поглощения влаги из воздуха. Это свойство широко используют в парфюмерной промышленности: глицерин входит в состав кремов, помад, зубных паст, предотвращая их от высыхания и способствуя увлажнению и смягчению кожи.

Глицерин используют как пищевую добавку при изготовлении кондитерских изделий и напитков. При производстве пластмасс глицерин применяют в качестве пластификатора — компонента, придающего материалу гибкость и эластичность. В кожевенном производстве и текстильной промышленности глицерин используют для предохранения кож от высыхания и придания тканям мягкости и шелковистости.
Значительное количество глицерина используют для изготовления взрывчатых веществ, в частности три- нитрата глицерина. Несмотря на взрывоопасность этого вещества, в очень малых дозах его применяют в медицине в качестве сосудорасширяющего средства при сердечно-сосудистых заболеваниях.
Качественной реакцией на многоатомные спирты является их взаимодействие со свежеполученным осадком гидроксида меди (II), который растворяется с образованием ярко-синего раствора (рис. 41).


1. На каком уровне начинается различие между живой и неживой природой? Какие факты говорят о единстве живой и неживой природы?
2. Сравните между собой состав и строение растительной и животной клеток.
3. На какие две группы делят химические элементы, образующие вещества живых клеток? Попробуйте доказать относительность такого деления элементов.
4. Какова роль макро- и микроэлементов в организации жизни на нашей планете?
5. Какие вещества называют спиртами?
6. Как определяют атомность спирта?
7. Что такое функциональная группа?
8. Какие свойства предельных одноатомных спиртов определяются наличием в их молекуле гидроксильной функциональной группы, а какие — нет?
9. Приведите примеры неорганических веществ, между молекулами которых образуется водородная связь.
10. Какие свойства метанола и этанола лежат в основе их применения?
11. Какие свойства глицерина лежат в основе его применения?
12. В трех пробирках находятся бесцветные жидкости: вода, этанол и раствор глицерина. Как их распознать?
13. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) этилен----> этанол----> этаналь;
б) этанол----> этилен----> этиленгликоль.
14. При взаимодействии 3 г предельного одноатомного спирта с необходимым количеством натрия выделилось 0,56 л (н. у.) водорода. Выведите формулу спирта, запишите формулы возможных изомеров и дайте их названия.
- Единство химической организации живых организмов на Земле. Спирты. Ответы
Муниципальное общеобразовательное учреждение
«Горская средняя общеобразовательная школа»
Красненского района Белгородской области
Тест по химии в 10 классе по теме
Фролова Мария Сергеевна,
учитель химии и биологии
МОУ «Горская средняя общеобразовательная школа
Красненского района, Белгородской области»
Тест по химии в 10 классе по теме
Работа состоит из 1 части и включает 12 заданий, базового уровня. К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл. Максимальное количество баллов – 12. На выполнение работы отводится 15 минут.
Баллы, полученные за выполненные задания, суммируются.
Система оценивания работы.
12 -11 баллов – «5»
10 - 9 баллов – «4»
6 и менее баллов – «2»
Тест по химии 10 класс
1. В состав молекулы спирта входит функциональная группа
а) – CHO ; б) – COOH ; в) - NH 2; г) - OH .
2. Уберите «лишнее» вещество.
3. Спирт, структурная формула которого CH3- CH 2- CH - CH 2- OH
а) 2-метилпропанол; б) пентанол-1;
в) 2-метилбутанол-1; г) метилбутанол-1;
4. С увеличением относительной молекулярной массы растворимость спиртов
а) ухудшается; б) не изменяется; в) улучшается; г) изменяется.
5.С2Н5О N а можно получить взаимодействием этанола с:
а) Na Н; б) NaI ; в) Na ; г) Na О H .
6. Реакция этерификации это реакция взаимодействия между:
а) спиртом и кислотой; б) альдегидом и кислородом;
в) двумя одинаковыми спиртами; г) спиртом и основанием.
7. Этанол НЕ реагирует с
а) водой; б) гидроксидом меди ( II ); в) оксидом меди ( II ); г) кислородом.
8. При нагревании выше 140 о C в присутствии Н2 SO 4 из этанола получается:
а) метан; б) этиленгликоль; в) этилен; г) ацетилен.
9. Водородные связи НЕ устанавливаются между молекулами:
а) метанола; б) пропанола; в) воды; г) водорода.
10. При дегидратации изопропилового спирта образуется:
а) этилен; б) ацетилен; в) пропилен; в) пропин.
11.Сырьем для многих химических производств является:
а) метанол; б) этанол; в) пропанол; в) бутанол.
12 .Укажите пару, в которой оба вещества содержат функциональную группу - OH
а) ацетальдегид, фенол; б) метанол, фенол; в) пропанол, бензол;
г) формальдегид, этанол.
Тест по химии 10 класс
1. В состав молекулы спирта входит функциональная группа
а) – CHO ; б) - OH ; в) - NH 2; г) – COOH .
2. Вещество CH 3 – CH – CH 2 OH называется:
а) 2 – метилпропанол – 1;
г) 2,2 – диметилэтанол.
3. Классифицируйте вещество CH 3- CH 2- CH - CH 3
а) одноатомный вторичный предельный спирт;
б) двуатомный первичный предельный спирт;
в) одноатомный первичный непредельный спирт;
г) одноатомный вторичный непредельный спирт.
4. Спирты, содержащие в молекуле до 15 углеродных атомов являются:
а) твердыми; б) все жидкостями; в) жидкостями и твердыми веществами;
г) в основном жидкостями.
5. Какой вид изомерии НЕ характерен для спиртов:
а) изомерия углеродного скелета; б) изомерия положения гидроксогруппы
в) межклассовая изомерия; г) изомерия положения связей.
а) горения; б) гидратации; в) дегидратации; г) гидрирования.
7.Какое соединение образуется при взаимодействии этилового спирта и бутановой кислоты:
8.Продуктами реакции в реакции горения являются:
а) углекислый газ и вода; б) простой эфир; в) сложный эфир; г) соль.
9. Из спирта нельзя получить
а) сложный эфир; б) простой эфир; в) алкен; г) галоген.
10. В молекуле СН3О N а имеются следующие виды химической связи:
а) только ковалентная; б) ковалентная полярная и ковалентная неполярная;
в) только ионная; г) ковалентная полярная и ионная.
11. Каким веществом метанол окисляется в формальдегид:
а) водородом; б) натрием; в) оксидом меди ( II ); г) пероксидом водорода.
12. Этиловый спирт НЕ используется:
а) в медицине; б) в косметической промышленности;
в) пищевой промышленности; г) в сельском хозяйстве.
Список использованной литературы:
1.Рудзитис,Г.Е. Химия. Органическая химия: учебник для 10 класса общеобразовательных учреждений [Текст] / Г.Е.Рудзитис, Ф.Г.Фельдман. – М.: Просвещение, 2009.
2.Гаврусейко Н.П. Проверочные работы по органической химии. Дидактический материал. Пособие для учителя. [Текст]/ Н.П.Гаврусейко. – М.:Просвещение, 1988.-48 с.:ил. – ISBN 5-09-000638-4.




- 16 предметов
- Для учеников 1-11 классов и дошкольников
- Бесплатные наградные документы для учеников и учителей


Розыгрыш ЦЕННЫХ ПРИЗОВ среди ВСЕХ участников
- Все материалы
- Статьи
- Научные работы
- Видеоуроки
- Презентации
- Конспекты
- Тесты
- Рабочие программы
- Другие методич. материалы
- Фролова Мария СергеевнаНаписать 132815 20.12.2015
Номер материала: ДВ-274897
- Химия
- 10 класс
- Тесты
-
20.12.2015 1551
-
20.12.2015 369
-
20.12.2015 507
-
20.12.2015 1810
-
20.12.2015 655
-
20.12.2015 491
-
20.12.2015 518
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.

Как вы представляете себе спирт в косметике? Если в составе косметики вы видите слово Alcohol, это не всегда будет связано негативным воздействием на кожу, такими как высушивание или покраснения.
Далеко не все спирты являются «плохими», а некоторые наоборот, значительно улучшают состояние кожи. Спирты в косметических средствах выполняют много функций: растворение, эмульгирование, консервация, антисептик, стабилизатор и тому подобное.
Чаще всего используются простые, ароматические и жирные спирты.
— ПРОСТЫЕ СПИРТЫ действительно нежеланный гость в косметике. Это бесцветная жидкость с характерным запахом алкоголя. Вы можете найти их под названиями: Methanol, Ethyl Alcohol (этиловый спирт, часто указан просто как Alcohol), Isopropyl Alcohol, Isopropanol, Alcohol Denat, Propylene glycol, Butylene Glycol.
Для чего их добавляют в косметику? Для консервирования. Для растворения других компонентов, которые не растворяются в воде или маслах. Для улучшения проникновения компонентов в кожу. Для матирующего эффекта.
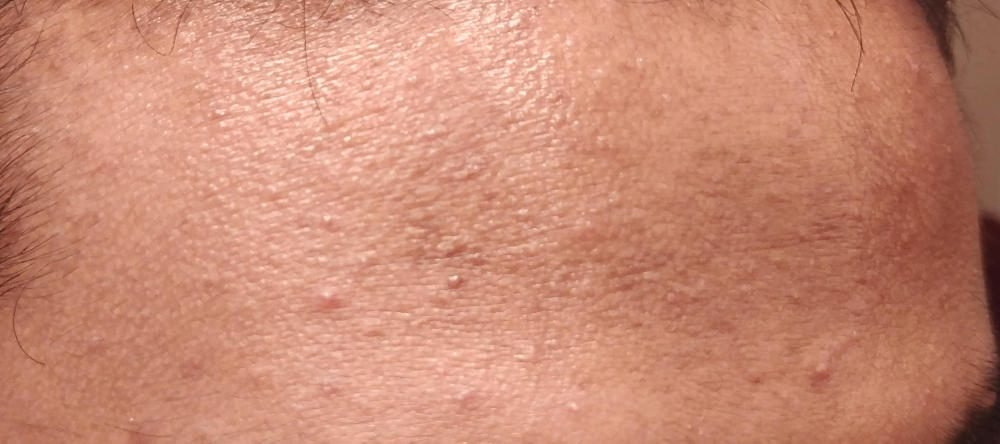
Что ожидать от простых спиртов? Раздражения, обезвоживания и ухудшения состояния кожи.
Простые спирты растворяют гидролипидную мантию кожи, нарушая барьерную функцию кожи. Сначала кожа выглядит более матовой и менее жирной, но за несколько часов сальные железы начинают вырабатывать себум с удвоенной силой, пытаясь восстановить липидный слой кожи. Вот почему после спиртовых тоников кожа становится жирной и обостряются все высыпания.
— АРОМАТИЧЕСКИЕ СПИРТЫ выполняют функции простых спиртов, но имеют менее раздражающее действие, поскольку очень летучие и испаряются частично еще до того, как попадут на кожу. Их можно встретить в виде эфиров или даже в свободном состоянии в эфирных маслах, полученных из жасмина, гиацинта, иланг-иланга, поэтому они имеют насыщенный цветочный запах.
Вы можете найти их под названиями:
Benzyl Alcohol (бензиловый спирт) — органический спирт, используется преимущественно для консервирования и ароматизации косметики. В чистом виде и при высоких концентрациях раздражает кожу, но при добавлении его в малом количестве (до 1%) является безопасным. Разрешен в органической косметике.
Cinnamyl Аlcohol — это коричный спирт, имеющий хороший приятный аромат гиацинта. И хотя этот спирт имеет натуральное происхождение, при постоянном использовании значительно высушивает и раздражает кожу. Его не стоит добавлять в косметику, которая наносится на кожу и не смывается.

И самая приятная группа спиртов в косметике — ЖИРНЫЕ СПИРТЫ, которые получают из растительных масел. Они не пересушивают и не раздражают кожу, а наоборот, смягчают и удерживают влагу.
Для чего они нужны? Это эмульгаторы, которые соединяют воду с маслами и превращают это все в крем. Жирные спирты — вид липидов, которые очень необходимы нашей коже.
Вы можете найти их под названиями: Behenyl Alcohol, Caprylic Alcohol, Cetearyl Alcohol, Cetyl Alcohol, Decyl alcohol, Lauryl Alcohol, Myristyl Alcohol, Stearyl Alcohol, Isostearyl Alcohol, Oleyl Alcohol.
Поэтому спирты — это не всегда страшно, если понимать какой именно спирт использован и в каком количестве. Как и с другими компонентами косметики, конкретный спирт нужно рассматривать в рецептуре комплексно, а не «вырывать» его из состава и искать запросы о вреде на организм и кожу.
Так, бензиловый спирт в чистом виде очень опасен, но в косметических средствах его должно быть совсем незначительная часть, которая в сочетании с хорошей рецептурой не будет проявлять заявленного опасного действия. Тот самый нежелательный денатурированный спирт (Alcohol Denat), добавленный в крем, будет менее раздражать кожу, чем в составе водной косметики (тоники, сыворотки), так как жирные спирты и кислоты крема будут смягчать его действие на кожу.
Кстати, глицерин — это тоже трехатомных спирт. Безопасный. Благодаря свойству поглощать из воздуха до 40-50% воды по отношению к его начальной массе, он получил широкое распространение в косметике, как вещество, которое быстро отбирает воду из животной и растительной ткани. Он применяется почти во всех косметических препаратах как смягчающее средство и является одним из основных видов сырья для изготовления зубных паст.
Д-пантенол — спиртовая форма пантотеновой кислоты. Смягчает кожу, восстанавливает клетки кожи.

Содержание спирта в средствах по уходу за кожей вызывает много путаницы. Так ли страшен Alcohol?
Большинство людей считают, что этот ингредиент плох для кожи, поскольку высушивает ее. Это утверждение отчасти верно и зависит от конкретного спирта и его количества в продукте. Однако существует несколько различных типов спиртов с очень разными свойствами.

Ася Козлова
Автор статьи. Химик-технолог косметики Sativa
Какую функцию выполняет спирт в косметических продуктах?
Спирт может применяться в качестве:
- растворителя (растворяет гидрофобные ингредиенты или разбавляет смесь);
- эмульгатора (позволяет смешивать два разных вещества);
- антисептика (убивает бактерии);
- буфера (уравновешивает рН);
- стабилизатора (предотвращает разделение или нежелательные реакции);
- консерванта (минимизирует рост бактерий или порчу);
- усилителя проникновения (улучшает доставку ингредиента в кожу);
- фиксатора аромата.
Таким образом, спирт является универсальным ингредиентом, который может выполнять целый ряд функций.
Виды спирта в косметике
В химии «спиртом» называется сложная молекула, у которой есть одна или несколько гидроксильных групп — присоединенных хвостиков -OH. Свойства спирта зависят от количества этих самых -OH и от основной молекулы, к которой они крепятся.
Существует 3 главных вида спирта, которые чаще всего используются в косметике:
Разберем подробнее каждый вид и узнаем, где для кожи враг, а где — друг.
Простые спирты
Простые спирты в основном используются в качестве антисептика — для получения продуктом антибактериальных качеств. Их получают путём сбраживания сахара, крахмалов и других углеводов. Такие спирты по консистенции часто напоминают воду.
Вот некоторые примеры простых спиртов:
- Метанол/Methanol
- Этанол (= этиловый спирт)/Ethanol (=Ethyl Alcohol);
- Изопропиловый спирт/Isopropyl Alcohol (Isopropanol);
- Денатурированный спирт (= SD-спирт или спирт-денат)/Alcohol Denat
Производители любят использовать этот тип спирта для ухода за кожей по нескольким причинам:
- Они работают как «растворители» в формуле, тем самым спирты помогают всем остальным ингредиентам, особенно тем, которые обычно не растворяются в воде, хорошо смешиваться, поэтому конечный продукт представляет собой гомогенный крем или жидкость.
- Стягивающие вещества: в некоторые продукты, такие как тонеры и очищающие средства, включены спирты для достижения краткосрочного эффекта уменьшения размера пор и стянутости кожи.
- Улучшение абсорбции: спирты помогают коже лучше поглощать другие ингредиенты, поэтому изготовители предпочитают добавлять их в увлажняющие кремы для облегчения проникновения ингредиентов (эффект достигается за счет разрушения верхнего рогового слоя кожи, что в свою очередь облегчает проникновение таких продуктов, как ретинол и витамин С — плохо-плохо-плохо).
- Консерванты: спирты обладают антисептическими свойствами, поэтому их иногда используют в качестве консерванта в косметических продуктах.
В любом случае считается, что все это очень спорная практика при долгосрочном использовании таких продуктов. Почему и что же не так с простыми спиртами?
Вот что делают с кожей простые спирты:
- Сушат и раздражают. Они «срывают» естественную кислотную оболочку кожи, обезвоживая клетки, и потенциально увеличивают шанс появления мимических морщин. Использование этанола связано с раздражением кожи или контактным дерматитом.
- Нарушают барьерную функцию. Кожа имеет естественный барьер, который помогает запирать влагу внутри и защищать от стрессов окружающей среды и других повреждающих элементов. Спирт нарушает этот барьер, оставляя кожу более уязвимой для воздействия раздражителей, аллергенов, бактерий и вирусов. В исследовании, проведенном в 2003 году, ученые отметили, что это верно в отношении врачей, которые используют моющие средства на спиртовой основе, дабы обеззаразить кожу рук. Они обнаружили, что такие антисептики удаляют «барьерные липиды» (здоровые жиры на коже), тем самым заставляя кожу терять влагу.
- Ухудшают состояние акне. Многие препараты против акне содержат спирт из-за его бактерицидных и матирующих свойств. Однако эти временные улучшения не стоят долгосрочных проблем. В исследовании 2011 года, например, было обнаружено, что препараты против угревой сыпи с содержанием спирта со временем фактически не решают проблему, потому что они вызывают раздражение и сухость, при этом кожа жирного типа на такой раздражитель вырабатывает еще большее количество сала, усугубляя состояние акне.
Ниже некоторые примеры.
Этанол (= этиловый спирт)
Рейтинг: неудовлетворительный.
Категория: растворитель, консервант, фиксатор аромата.
Как действует: ускоряет впитывание в кожу крема, легко испаряется с поверхности кожи. Хорошо растворяет в себе эфирные масла, концентрируя их запахи и сохраняя их стойкость. В связи с этим часто используется в производстве духов. Помимо этого он обладает антисептическими, дезинфицирующими, подсушивающими свойствами.
Местно нанесенный этанол действует как усилитель проникновения в кожу и может способствовать трансдермальному поглощению ксенобиотиков (например, канцерогенных загрязнителей в косметических препаратах). Этот вид спирта (низкомолекулярный спирт) растворяет поверхностное сало, тем самым мгновенно высушивая кожу, потому что он быстро испаряется.
Изопропиловый спирт
Рейтинг: неудовлетворительный.
Категория: растворитель, пеногаситель, консервант, парфюмерный ингредиент.
Как действует: в косметике используется как растворитель в смываемых косметических средствах. Используется в лосьонах, ополаскивателях, кремах после бритья. В рецептурах может выступать заменителем этилового спирта.
Денатурированный спирт
Рейтинг: удовлетворительный.
Категория: обезжиривающий агент, антисептик, растворитель, пеногаситель.
Как действует: в косметике чаще всего используется как растворитель в смываемых косметических средствах. Встречается в шампунях, лосьонах, ополаскивателях, кремах после бритья. В рецептурах может выступать заменителем этилового спирта. Может быть натурального происхождения, без примесей, тогда является безопасным в допустимой концентрации. Остерегаться стоит плохо очищенного спирта технического происхождения.
Денатурированный спирт не следует наносить в одиночку на кожу, однако в сочетании с другими ингредиентами и в небольших количествах этот ингредиент совершенно безопасен. В органической косметике часто используется в качестве проводника для доставки активных ингредиентов в кожу.
Трудно оценить точное содержание спирта в продукте, ведь процентные концентрации никогда не указываются на упаковке. Однако можно дать приблизительную его оценку. Ингредиенты в составе перечислены в порядке от самой высокой концентрации до самой низкой. Большая часть продукта обычно состоит из первых 6-10 ингредиентов.
Но даже если спирт включен в первую десятку, это не означает, что он высушит кожу. Это зависит от того, что еще находится в формуле. Могут быть некоторые смягчающие или жирные ингредиенты, которые сглаживают высушивающий эффект. Лучшим решением будет попробовать продукт на коже. При избытке жестких спиртов вы сразу почувствуете так называемый «охлаждающий эффект» — результат быстрого испарения спирта с поверхности кожи.
Правильной рекомендацией послужит полное избегание средств, направленных на проблемы подростковой кожи, изобилующих на полках в аптеках. Они содержат большое количество простого спирта, потому что они ориентированы на быстрое достижение матирования и подсушивания воспалений и акне, что в долгосрочной перспективе приводит к нарушению кожного барьера и раздражению.
Ароматические спирты
Этот вид спирта выполняет аналогичную функцию простого спирта, но обладает ароматом. Он действует как консервант либо как компонент ароматической добавки или эфирного масла.
Разберем их подробнее.
Бензиловый спирт/Benzyl Alcohol
Рейтинг: удовлетворительный.
Категории: консерванты.
Как работает: его главная функция в косметике — консервирующая. Это органический спирт, который встречается естественным образом в некоторых фруктах (абрикосах, клюкве) и чаях. Высокое содержание бензилового спирта может придать заметный цветочный аромат косметическим продуктам, поскольку он является частью ароматического состава некоторых эфирных масел, таких как жасминовое.
В больших количествах бензиловый спирт может вызвать серьезное раздражение, однако в минимальных количествах в косметике главным образом считается безопасным.
Циннамиловый спирт/Cinnamylalcohol
Рейтинг: неудовлетворительный.
Категории: ароматизатор.
Как работает: это летучий ароматизатор, содержащий экстракты корицы и бальзама Перу, способен в значительной степени высушить кожу.
Жирные спирты
А вот теперь мы добрались до самого интересного. Есть целый класс веществ, которые по своей химической сути являются «спиртами», но при этом они отличаются по своему внешнему виду и воздействию на кожу.
Жирные спирты не высушивают и обладают смягчающими и окклюзионными свойствами (замедляющими испарение воды). В отличие от простых спиртов, они имеют густую, восковую текстуру. Некоторые из них даже находятся в твердом агрегатном состоянии.
Жирные спирты используются, чтобы придать продуктам мягкое, бархатистое ощущение и более приятное скольжение по поверхности кожи.
Вот некоторые примеры:
- Бегениловый спирт/Behenyl Alcohol
- Каприловый спирт/Caprylic Alcohol
- Цетеариловый спирт/Cetearyl Alcohol
- Цетиловый спирт/Cetyl Alcohol
- Децильный спирт/Decyl alcohol
- Лауриловый спирт/Lauryl Alcohol
- Миристиловый спирт/Myristyl Alcohol
- Стеариловый спирт/Stearyl Alcohol
- Изуостеариловый спирт/Isostearyl Alcohol
- Олеиловый спирт/Oleyl Alcohol
Применяются в качестве:
- Эмульгаторов. Эти спирты помогают смешивать воду с маслами для создания приятных по консистенции, однородных кремов и лосьонов.
- Смягчающих средств. Поскольку эти ингредиенты обладают естественными увлажняющими свойствами, они включены во многие кремы и лосьоны.
- Загустителей. Потребители любят густые, богатые кремы, особенно это касается зимних продуктов. Жирные спирты помогают сгустить формулу до правильной консистенции.
К некоторым жирным спиртам есть только одна небольшая претензия — они могут вызывать реакцию раздражения у чувствительной кожи. В частности, коко- и лаурилогликозиды, которые представляют собой смеси жирных спиртов и глюкозы. Но это лишь небольшое исключение.
В качестве примеров безопасных и эффективных жирных спиртов можно привести:
Стеариловый спирт
Рейтинг: удовлетворительный.
Категория: загуститель/эмульгатор, смягчающее средство.
Как работает: жирный спирт используется в качестве смягчающего средства и способствует консервации других ингредиентов в составе.
Стеарил Стеарат
Рейтинг: удовлетворительный.
Категории: смягчающее средство, улучшитель текстуры продукта.
Как работает: это растительный воск, приготовленный из натуральных жирных кислот в сочетании с синтетическими жирными спиртами. Функционирует в качестве смягчающего, окклюзионного агента для увлажнения кожи.
Лаурил Лаурат
Рейтинг: лучший.
Категории: смягчающее средство, улучшитель текстуры продукта.
Как работает: представляет собой смягчающий ингредиент, который может помочь биоактивным ингредиентам лучше интегрироваться в поверхность кожи (более мягкий вариант усилителей проникновения). Он считается безопасным для использования в косметике.
Кстати, многие знакомые нам ингредиенты на самом деле тоже являются спиртами.
Пантенол
Рейтинг: лучший.
Категории: витамины.
Как работает: представляет собой спиртовую форму пантотеновой кислоты. Иногда называемый провитамином B5, пантенол легко смешивается со многими различными типами ингредиентов, делая его универсальным ингредиентом, улучшающим внешний вид кожи. Пантенол используется в средствах по уходу за кожей как увлажняющий агент из-за его способности притягивать и удерживать влагу.
Глицерин
Рейтинг: лучший.
Категории: эмульгатор, растворитель, активы.
Как работает: представляет собой простейший представитель трехатомных спиртов. Увлажняет кожу.
Фитосфингозин
Рейтинг: лучший.
Категория: консерванты, питание и восстановление кожи.
Как работает: обладает восстанавливающими свойствами и подходит для ослабленной кожи.
Какой из всего этого можно сделать вывод?
Все гораздо сложнее, чем кажется на первый взгляд. Не всегда слово «спирт» обозначает классический в нашем понимании простой спирт. И не всегда отсутствие слова «спирт» означает, что в составе спирты отсутствуют совсем и полностью.
В составе веществ, образующих клетки всех живых организмов (бактерий, растений, животных, человека), обнаружено более 70 химических элементов. Их принято делить на две большие группы: макро- и микроэлементы.
Макроэлементы содержатся в клетках в больших количествах. Это углерод, водород, кислород и азот, которые в сумме составляют 98% всего содержимого клетки. К макроэлементам также относят магний, калий, кальций, натрий, фосфор, серу и хлор. Суммарное содержание их в клетке составляет 1,9%. Таким образом, на долю всех остальных элементов приходится около 0,1%. Эти элементы называют микроэлементами. К ним относятся железо, цинк, марганец, бор, медь, кобальт, иод, бром, фтор и др.
Как можно отметить, в клетках живых организмов, в том числе и человека (рис. 31), нет каких-либо особых химических элементов, характерных только для живой природы, т. е. на атомном уровне различий между живой и неживой природой нет. Эти различия начинаются лишь на уровне сложных веществ — на молекулярном уровне. Так, наряду с неорганическими веществами (водой и минеральными солями) клетки живых организмов содержат вещества, характерные только для них, — органические вещества (белки, жиры, углеводы, нуклеиновые кислоты, витамины, гормоны и др.).

Относительный состав клеток живых организмов обобщенно можно представить так: вода— 70—80%, минеральные соли — 1, белки — 10—20, нуклеиновые кислоты — 1—6, жиры — 1—5, углеводы — 1—2%.
В то время как неорганические вещества встречаются и в неживой природе, органические соединения характерны только для живых организмов, долгое время служивших единственным источником их получения.
Основу цепочки природных взаимопревращений органических веществ, в состав молекул которых входит кислород, т. е. кислородсодержащих органических соединений, составляет уже знакомая вам реакция фотосинтеза:

Растворы, содержащие углеводы (например, глюкозу), под действием особых веществ природного происхождения — ферментов — превращаются в этиловый спирт. Такой процесс называют спиртовым брожением:

Получение этилового спирта — одна из древнейших химических реакций, открытых и используемых человечеством.
Со спиртами мы уже встречались не раз. Впервые вы познакомились с ними при изучении алкенов. Этиловый спирт С2Н5ОН — это продукт реакции гидратации этилена, а также исходное вещество для лабораторного способа получения этилена реакцией дегидратации. При изучении этилена вы познакомились еще с одним представителем спиртов — двухатомным спиртом этиленгликолем НОСН2—СН2ОН, образующимся в результате окисления этилена раствором перманганата калия.
Нетрудно заметить, что особенность химического строения спиртов заключается в наличии в составе их молекулы особой функциональной группы атомов — гидроксильной группы —ОН.

Число гидроксильных групп в молекуле спирта определяат его атомность. Знакомство со спиртами мы начинаем с простейших — с предельных одноатомных спиртов или алканолов.

Начинает гомологический ряд предельных одноатомных спиртов метиловый спирт, или метанол,
Вторым членом гомологического ряда является хорошо знакомый вам из курса основной школы этиловый спирт, или этанол,
Формуле третьего члена гомологического ряда алкано- лов С3Н7ОН будут соответствовать уже два пропиловых спирта, или пропанола. Дело в том, что, начиная со спиртов этого состава, появляется еще один вид изомерии, который называют изомерией положения функциональной группы. Формулы изомерных пропиловых спиртов:

Как вы помните, пропанол-2 можно получить гидратацией пропена, которая протекает в соответствии с правилом Марковникова.
Спирты состава С4Н9ОН существуют уже в виде четырех изомеров, различающихся не только положением функциональной группы:

но и строением углеродного скелета:

На этих примерах вы смогли познакомиться со способами образования названий предельных одноатомных спиртов.

Названия одноатомных спиртов образуются от названий соответствующих (по числу атомов и строению углеродной цепи) углеводородов с прибавлением суффикса . Положение гидроксильной группы в главной цепи молекулы указывают цифрой после суффикса .
Отметим, что для спиртов характерен еще один вид изомерии, с которым вы уже встречались, — межклассовая изомерия: предельные одноатомные спирты изомерны простым эфирам. Например, изомерны этиловый спирт С2Н5ОН и диметиловый эфир СН3—О—СН3. Именно этот пример мы приводили в § 2.
Так как с представителями простых эфиров, как учащиеся непрофильных классов, вы больше не встретитесь, подчеркнем, что их состав может быть отражен общей формулой R—О—R'.
Уже первые члены гомологического ряда предельных одноатомных спиртов, несмотря на небольшие значения относительных молекулярных масс, представляют собой жидкости. Это объясняется образованием между молекулами особой химической водородной связи.

За счет водородной связи молекулы низших спиртов ассоциированы в жидкости (рис. 32):

Первые представители гомологического ряда алкано- лов прекрасно растворяются в воде, так как образуют водородные связи с молекулами воды (рис. 33).
Познакомимся с химическими свойствами предельных одноатомных спиртов.
Как и все органические соединения, спирты горят:

Последнюю реакцию применяют не только в хорошо известных вам спиртовках, но также и в двигателях внутреннего сгорания. На рисунке 34 изображена автозаправочная станция в Бразилии, которая предлагает в качестве топлива на выбор бензин, смесь бензина с этиловым спиртом и просто этиловый спирт с добавкой метанола, чтобы водители его не пили. Машины с двигателями, работающими на этаноле, используются в Бразилии уже более 10 лет.
Наличие в молекулах спиртов гидроксильной группы определяет общие свойства представителей этого класса соединений.

Спирты взаимодействуют с металлическим натрием, образуя соли с общим названием — алкоголяты:

Спирты вступают в реакцию дегидратации:
а) внутримолекулярная дегидратация — это хорошо знакомый вам лабораторный способ получения этилена:

б) межмолекулярная дегидратация приводит к образованию уже знакомых вам простых эфиров:

Оксидом меди (И) спирты окисляются в соответствующие альдегиды (рис. 35):

С карбоновыми кислотами спирты вступают в реакцию этерификации, образуя при этом сложные эфиры, с которыми вы будете подробно знакомиться в § 13:

Рассмотрим отдельных представителей одноатомных и многоатомных спиртов.
Метанол (метиловый спирт) СН3ОН (рис. 36) — бесцветная жидкость с характерным запахом, tкип = 64,7 °С, горит чуть голубоватым пламенем.
Историческое название метанола — древесный спирт — объясняется одним из старых способов его получения — перегонкой дерева. Метанол — прекрасный растворитель, его используют также для производства формальдегида, некоторых лекарственных веществ. Метанол наряду с этанолом можно добавлять в моторное топливо для увеличения октанового числа.
Метанол очень ядовит! Он является нервно-сосудистым ядом.

При попадании в организм от 5 до 10 мл этого вещества наступает паралич зрения вследствие поражения сетчатки глаз, доза в 30 мл и более вызывает смерть.
Этанол (этиловый спирт) С2Н5ОН (рис. 37) — бесцветная жидкость с характерным запахом, tкип = 78,3 °С, смешивается с водой в любых соотношениях.
При попадании в организм человека этилового спирта происходит снижение болевой чувствительности и блокировка процессов торможения в коре головного мозга — наступает состояние опьянения. На этой стадии действия этанола увеличивается водоотделение в клетках и, следовательно, ускоряется мочеотделение, в результате чего происходит обезвоживание организма. Кроме того, этанол вызывает расширение кровеносных сосудов. Усиление потока крови в кожных капиллярах приводит к покраснению кожи и ощущению теплоты.
В больших количествах этанол угнетает деятельность головного мозга (стадия торможения), вызывает нарушение координации движений. Промежуточный продукт окисления этанола в организме — ацетальдегид — ядовит и вызывает тяжелые отравления. Систематическое употребление этилового спирта и содержащих его напитков приводит к стойкому снижению продуктивности работы головного мозга, гибели клеток печени и замене их соединительной тканью — циррозу печени.
Помимо производства алкогольной продукции, этанол находит широкое применение в различных отраслях промышленности (рис. 38, 39).


Глицерин — это представитель трехатомных спиртов (рис. 40). Его формула


В отличие от уже знакомого вам двухатомного спирта этиленгликоля, глицерин не ядовит. Он неограниченно растворим в воде, более того, очень гигроскопичен. Если оставить глицерин в открытом сосуде, его масса увеличивается до 40% за счет поглощения влаги из воздуха. Это свойство широко используют в парфюмерной промышленности: глицерин входит в состав кремов, помад, зубных паст, предотвращая их от высыхания и способствуя увлажнению и смягчению кожи.

Глицерин используют как пищевую добавку при изготовлении кондитерских изделий и напитков. При производстве пластмасс глицерин применяют в качестве пластификатора — компонента, придающего материалу гибкость и эластичность. В кожевенном производстве и текстильной промышленности глицерин используют для предохранения кож от высыхания и придания тканям мягкости и шелковистости.
Значительное количество глицерина используют для изготовления взрывчатых веществ, в частности три- нитрата глицерина. Несмотря на взрывоопасность этого вещества, в очень малых дозах его применяют в медицине в качестве сосудорасширяющего средства при сердечно-сосудистых заболеваниях.
Качественной реакцией на многоатомные спирты является их взаимодействие со свежеполученным осадком гидроксида меди (II), который растворяется с образованием ярко-синего раствора (рис. 41).


1. На каком уровне начинается различие между живой и неживой природой? Какие факты говорят о единстве живой и неживой природы?
2. Сравните между собой состав и строение растительной и животной клеток.
3. На какие две группы делят химические элементы, образующие вещества живых клеток? Попробуйте доказать относительность такого деления элементов.
4. Какова роль макро- и микроэлементов в организации жизни на нашей планете?
5. Какие вещества называют спиртами?
6. Как определяют атомность спирта?
7. Что такое функциональная группа?
8. Какие свойства предельных одноатомных спиртов определяются наличием в их молекуле гидроксильной функциональной группы, а какие — нет?
9. Приведите примеры неорганических веществ, между молекулами которых образуется водородная связь.
10. Какие свойства метанола и этанола лежат в основе их применения?
11. Какие свойства глицерина лежат в основе его применения?
12. В трех пробирках находятся бесцветные жидкости: вода, этанол и раствор глицерина. Как их распознать?
13. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) этилен----> этанол----> этаналь;
б) этанол----> этилен----> этиленгликоль.
14. При взаимодействии 3 г предельного одноатомного спирта с необходимым количеством натрия выделилось 0,56 л (н. у.) водорода. Выведите формулу спирта, запишите формулы возможных изомеров и дайте их названия.
- Единство химической организации живых организмов на Земле. Спирты. Ответы
Читайте также:

