Гематотимусный барьер находится в красной пульпе
Опубликовано: 20.04.2024
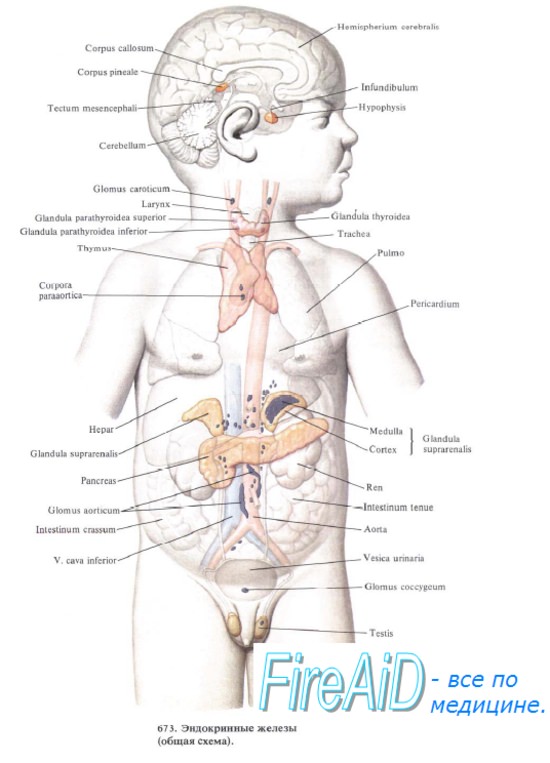
Тимус — центральный орган лимфоидного кроветворения и иммунной защиты организма. В тимусе происходит антигеннезависимая дифференцировка костномозговых предшественников Т-лимфоцитов в иммунокомпетентные клетки — Т-лимфоциты. Последние осуществляют реакции клеточного иммунитета и участвуют в регуляции гуморального иммунитета, что происходит, однако, не в тимусе, а в периферических органах кроветворения и иммунной защиты. Кроме того, в экстрактах тимуса обнаружено более 20 биологически активных веществ, в том числе дистантного действия, что позволяет отнести тимус к железам эндокринной системы.
Развитие тимуса. Тимус закладывается на 2-м месяце эмбриогенеза в виде небольших выпячиваний стенок 3-й и 4-й пар жаберных карманов. На 6-й неделе зачаток железы имеет отчетливо выраженный эпителиальный характер. На 7-й неделе он утрачивает связь со стенкой головной кишки. Эпителий закладки железы, образуя выросты в мезенхиму, приобретает сетевидное строение. Вначале плотная эпителиальная закладка железы разрыхляется благодаря заселению ее лимфоцитами. Число их быстро нарастает, и железа приобретает структуру лимфоэпителиалъного органа.
Врастающая мезенхима с кровеносными сосудами подразделяет тимус на дольки. В каждой дольке различают корковое и мозговое вещество. В гистогенезе тимуса в мозговом веществе долек образуются слоистые эпителиальные образования — эпителиальные жемчужины, или тельца Гассаля. В их составе определяются плотные эпителиальные клетки, концентрически наслаивающиеся друг на друга.
Строение тимуса. Снаружи вилочковая железа покрыта соединительнотканной капсулой. Отходящие от нее перегородки — септы — подразделяют тимус на дольки. Основу дольки составляют отростчатые эпителиальные клетки — эпителиоретикулоциты, в сетевидном остове которых находятся тимические лимфоциты (тимоциты). Источником развития Т-лимфоцитов являются костномозговые стволовые кроветворные клетки. Далее предшественники Т-лимфоцитов (претимоциты) поступают с кровью в тимус и превращаются здесь в лимфобласты.
В корковом веществе тимуса одни из них под действием выделяемых эпителиальными клетками пептидных гормонов — тимозина, тимопоэтина и др., а также макрофагов превращаются в антиген-реактивные Т-лимфоциты — приобретают рецепторы к строго определенным антигенам. Они выходят из тимуса, не попадая в мозговое вещество, и заселяют тимусзависимые зоны лимфатических узлов и селезенки. Здесь в периферических органах иммуногенеза происходит их дальнейшее созревание в Т-киллеры (цитотоксические), Т-хелперы, после чего они способны к рециркуляции, клонированию (пролиферации), образованию клеток-памяти.
Другие Т-лимфобласты превращаются в аутоиммунокомпетентные клетки, реактивные к аутоантигенам. Они подвергаются разрушению путем апоптоза (примерно 95% клеток) и фагоцитируются макрофагами.
Процесс специализации Т-лимфоцитов в корковом веществе долек тимуса происходит в условиях, предохраняющих от избыточного действия на них антигенов. Это достигается за счет образования гематотимического гистиона (барьера), состоящего из эндотелия гемокапилляров с отчетливо выраженной непрерывной базальной мембраной, перикапиллярного пространства с межклеточным веществом и макрофагами, а также из эпителиоретикулоцитов с их базальной мембраной. Корковое вещество тимуса имеет самостоятельное микроциркуляторное русло. Напротив, в мозговом веществе тимуса капиллярная сеть не выполняет барьерной роли, и через эндотелий этих капилляров зрелые лимфоциты могут уходить и возвращаться в тимус, т. е. рециркулировать.
В тимусе эти лимфоциты находятся в мозговом веществе. Зрелые лимфоциты покидают тимус через стенку посткапиллярной венулы.
Мозговое вещество тимуса имеет более светлую окраску, так как лимфоцитов здесь меньше, чем в корковом веществе. Эпителиальный остов выступает более отчетливо, а эпителиоретикулоциты здесь более крупные и многочисленные. В средней части мозгового вещества встречаются слоистые эпителиальные тельца Гассаля. С возрастом количество и размеры их увеличиваются. В строме тимуса кроме эпителиоретикулоцитов находятся макрофаги, дендритные клетки костномозгового происхождения, нейроэндокринные клетки — производные нервного гребня, а также миоидные клетки.
Возрастные изменения и реактивность тимуса.
После 20 лет происходит возрастная инволюция тимуса. Это сопровождается уменьшением количества лимфоцитов и развитием жировой ткани. В тех случаях, когда вилочковая железа не подвергается обратному развитию, возникает пониженная сопротивляемость организма к инфекциям и интоксикациям.
Ткани тимуса являются высокореактивными структурами. При действии повреждающих факторов (интоксикации, травмы и др.) наблюдаются выброс Т-лимфоцитов в кровь и массовая их гибель преимущественно в корковом веществе. Возникающая при таких стресс-воздействиях инволюция тимуса называется временной, быстропроходящей, или акцидентальной. Наблюдаемые при этом явления лимфоцитолиза и фагоцитоза макрофагами гибнущих лимфоцитов рассматриваются как возможные способы высвобождения факторов роста и ДНК, необходимых для восстановительных процессов в тканях. С гибелью лимфоцитов в этих условиях связывают также селекцию Т-лимфобластов.
Реактивные изменения вилочковой железы находятся в тесной корреляции с функциональными изменениями коры надпочечников и уровнем глюкокортикоидов в крови. В тимусе выявлены адренергические и холинергические нервные волокна, входящие в орган вместе с сосудами.
1. Стенка капилляра: эндотелиоциты с непрерывной утолщенной базальной мембраной
2. Перикапиллярное пространство, представленное тканевой жидкостью, макрофагами и лимфоцитами.
3. Опорные эпителиоретикулоциты, или точнее их цитоплазма, и базальная мембрана этих клеток.
Этот барьер существует только в корковом веществе дольки, он предотвращает взаимодействие циркулирующих в крови антигенов и созревающих Т-лимфоцитов.
Глубокая сеть капилляров, представленная меньшим их количеством, уходит в мозговое вещество, не образуя барьера.
Отток осуществляется из коркового вещества в подкапсулярные вены, а из мозгового вещества – в посткапиллярные венулы с высоким эндотелием, а затем в междольковые вены.
Возрастные особенности тимуса
К моменту рождения тимус морфологически и функционально сформирован и достигает максимального развития к 3-5 годам. С течением времени железа запрограммирована на физиологическую атрофию – инволюцию. Первые признаки ее появляются в 8 лет в виде разрастания междольковой соединительной ткани и снижения доли коркового вещества. К 15 годам разрастается жировая ткань, уменьшается количество коркового вещества. К 20 годам корковое вещество практически исчезает. Вес в возрасте 30 лет – 10 гр, а в 70 лет 2 гр. Функционально в период инволюции снижается клеточный и гуморальный иммунитет, гормональная активность железы.
В тоже время существует акцидентальная (моментальная) инволюция тимуса, наблюдающаяся у людей в связи с воздействием различных, очень сильных раздражителей (травма, инфекция, интоксикация и т.д.). При акциденитальной инволюции происходит массовая миграция лимфоцитов из коркового вещества, падение веса железы, исчезновение границы между корой и медуллой. Начальная стадия такой инволюции обратима, а поздняя приводит к летальному исходу.
Контрольные вопросы по теме:
1. Перечислите органы кроветворения и иммуногенеза, как они классифицируются.
2. Охарактеризуйте строение миелоидной и лимфоидной ткани.
3. Перечислитеэтапы становления (развития) кроветворения.
4. Красный костный мозг: строение, кровоснабжение, регенерация, функции.
5. Перечислите этапы развития тимуса.
6. Тимус: строение, кровоснабжение, регенерация, инволюция, функции.
7. Расскажите строение гематотимусного барьера, определите иго морфофункциональное значение.
8. Что такое антигеннезависимая дифференцировка лимфоцитов?
Тема лекции: МОРФОЛОГИЯ ПЕРИФЕРИЧЕСКИХ ОРГАНОВ ГЕМОПОЭЗА И ИММУНОГЕНЕЗА
План лекции:
Морфология селезенки
Функции селезенки
Развитие селезенки
Строение селезенки: белая и красная пульпа
Особенности кровоснабжения селезенки
Регенерация селезенки
Морфология лимфатических узлов
Функции лимфатических узлов
Развитие лимфатических узлов
Строение лимфатических узлов
Особенности кровоснабжения лимфатических узлов
Ток лимфы в лимфатическом узле
Морфология селезенки
Селезенка (splen, lien) - периферический орган лимфопоэза и иммуногенеза, где происходит антигензависимаядифференцировка Т-лимфоцитов, а также элиминация отживших или поврежденных ФЭК (эритроцитов и тромбоцитов).
Функции:
1. Гемопоэтическая - процессы лимфопоэза с антигензависимой дифференцировкой Т-лимфоцитов и пролиферацией либо Т-, либо В-лимфоцитов, в зависимости от вида антигена, в условиях патологии. В эмбриогенезе является органом миелоидного кроветворения.
2. Иммунорегуляторная – образованные иммуноциты выполняют функцию генетического контроля протекающей крови, в ответ на антигенную стимуляцию запускаются реакции клеточного и гуморального иммунитета.
3. Депонирующая – селезенка является депо крови 1 порядка (преимущественно эритроциты и тромбоциты).
4. Элиминирующая - разрушение старых форменных элементов крови, в основном эритроцитов
5. Регуляторная - выделяет вещества, регулирующие кроветворение в ККМ, вещества, стимулирующие метаболизм и фагоцитарную активность клеток (спленин, тафтсин). Участвует в поддержании уровня кальция в крови.
6. Антибластическая функция (вырабатывают антитела, которые тормозят развитие опухолей).
7. Синтетическая- селезенка участвует в обмене белков и синтезирует альбумин, глобин (белковый компонент гемоглобина), фактор VIII свертывающей системы крови.
Развитие селезенки
Закладка селезенкипроисходит на 5-6 неделе в виде скопления мезодермальных клеток внутри большого сальника вблизи большой кривизны желудка. Ответвляясь от воротной вены, в место закладки врастает слепозаканчивающаяся первичная вена, которая формирует в дальнейшем синусные капилляры. На 7 неделе эмбриогенеза в этот участок входят стволовые клетки двух типов: 1 - механобласты, оседающие вокруг сосудов и дифференцирующиеся в ретикулярную ткань и стволовые клетки крови, дифференцирующиеся в клетки миелоидного ряда – так формируется красная пульпа селезенки и начинается миелопоэз.
На 4м месяце эмбриогенеза в пульпу врастают соединительнотканные трабекулы с кровеносными сосудами, в том числе и артериального типа, образуя строму. В строме селезеночная артерия разветвляется, открываясь в синусы. Из тимуса в селезенку заносятся Т-лимфоциты, окружая артерии и В-лимфоциты из ККМ. Формируется белая пульпа селезенки, активно развивается лимфопоэз. Первые развитые фолликулы образуются к 1 году жизни ребенка, а увеличение их количества активно продолжается до 20 летнего возраста, в дальнейшем начинается инволюция органа.
Строение селезенки
Селезенкаимеет бобовидную форму, вес ее 140-200 гр., является паренхиматозным органом, снаружи покрыта соединительнотканной капсулой, в которой много коллагеновых волокон, в небольшом количестве эластиновые волокна и гладкие миоциты, что позволяет ей легко растягиваться и сокращаться, так же устроены и трабекулы – соединительнотканные перегородки, идущие от капсулы вглубь органа. Снаружи капсулу покрывает висцеральный листок брюшины (расположена интраперитонеально), основу которого образует плотная волокнистая ткань, снаружи покрытая мезотелием (однослойным плоским секреторным эпителием).
Там где входят кровеносные сосуды капсула подворачивается и образуются ворота селезенки. Капсула и трабекулы выполняют роль опорно-двигательного аппарата, обеспечивая выброс депонированной крови. Капсула формируется к 14 годам, трабекулы – к 20 годам, в общем, строма органа занимает 5-7% от общего объема органа.
Между трабекулами расположена паренхима, называемая пульпой, основу которой образует ретикулярная ткань.
Большая ее часть имеет красный цвет и называется красная пульпа – 70-80% паренхимы. Окраску ей придают кровеносные сосуды (артериальные капилляры и венозные синусы) и селезеночные тяжи Бильрота. Последние представлены тяжами клеток: макрофагов, эритроцитов, тромбоцитов, гранулоцитов, лимфоцитов и плазмоцитов. В селезеночных тяжах происходит уничтожение старых эритроцитов. Находящиеся там макрофаги способны распознавать наличие на поверхности мембран эритроцитов сиаловых кислот, и если их нет, то эритроцит подвергается фагоцитозу.
Белая пульпа 15-20% паренхимы - это комплекс лимфоидной ткани, расположенный по ходу кровеносных сосудов, она представлена двумя компонентами:
1. Периартериальное лимфоидное влагалище – Т-зависимая зона, как муфта окружает пульпарную артерию, содержит 3-5 рядов Т-лимфоцитов СD4 + – хелперов на разных этапах антигензависимой дифференцировки, среди Т-лимфоцитов находятся интердигитирующие клетки – разновидность макрофагов, которые не обладают фагоцитарной активностью, но вырабатывают гуморальные факторы, активирующие процессы пролиферации Т-лимфоцитов.
2. Лимфоидные фолликулы – скопление лимфоидной ткани округлой или овальной формы называемые тельца Мальпиги. В них, чаще эксцентрично, расположена центральная артерия, а основу составляет ретикулярная ткань и сеть аргирофильных волокон (в центре мальпигиевого тельца они тонкие, а по периферии толстые и грубые, расположены концентрическими пластами). У взрослого человека диаметр тельца достигает 0,3 мм., у новорожденного ребенка до 30-90 мкм. Существуют первичные лимфоидные фолликулы, которые встречаются только в эмбриональном периоде, и вторичные, которые образуются при контакте с антигенами. На срезе фолликула морфологически выделяют четыре зоны:
1) периартериальная Т-зависимая зона– является продолжением лимфоидного влагалища, расположена вокруг центральной артерии.
2) герминативный центр (центр размножения) В-зависимая зона – содержит В-лимфоциты на разных стадиях дифференцировки, дендритные клетки, поставляющие антигены, ретикулоциты. При микроскопии она выглядит как светлый участок в центре фолликула. Размеры и строение этой зоны резко меняется при воспалительных и инфекционных заболеваниях.
3) мантийная зона (корона) В-зависимая зона – содержит В-клетки памяти, лежащие концентрическими слоями, разделенные аргирофильными волокнами.
4) краевая зона (маргинальная) расположена на границе с красной пульпой отделенная от нее маргинальным синусом, самая тонкая. В ней располагаются рыхло лежащие Т- и В-лимфоциты, активно фагоцитирующие макрофаги, а также венозные синусы с высоким эндотелием. Здесь происходит миграция иммунокомпетентных клеток и происходит захват антигенов. У человека она может отсутствовать.
Нормальная деятельность головного мозга возможна лишь в условиях биохимического и электролитного гомеостаза (равновесия). Поэтому жизненно необходимо, чтобы мозг был надежно защищен от попадания веществ, способных изменить работу центральной нервной системы. Для этого и существует гематоэнцефалический барьер, или сокращенно ГЭБ.
Для чего нам нужен ГЭБ
ГЭБ — это полупроницаемая мембрана, которая отделяет мозг от кровеносного русла. Этот барьер состоит из эндотелиальных клеток, астроцитов и перицитов. Мембрана имеет особо «плотное» расположение капилляров, что и является основой барьера, предохраняющего мозг от проникновения большинства веществ, циркулирующих в крови.
ГЭБ сохраняет специфическую внеклеточную среду вокруг нейронов, поддерживая концентрацию аминокислот, аскорбиновой и фолиевой кислот даже при снижении их концентрации в сыворотке крови.
Кроме того, абсолютно необходимо, чтобы никакие патогенные микробы не могли попасть в головной мозг. Иначе наступает катастрофа. Типичный пример: микроб менингита, так называемый менингококк, вполне мирно может проживать в носоглотке, но при ослаблении защитных сил (и нарушении проницаемости ГЭБ) менингококк попадает в центральную нервную систему, поражая оболочки головного мозга и вызывая потенциально смертельную болезнь — гнойный менингит.

Повышение проницаемости ГЭБ также характерно и для других заболеваний нервной системы. Например, при рассеянном склерозе активированные Т-лимфоциты легко преодолевают ГЭБ и вызывают поражение мозга.
Как ГЭБ работает на практике
Проницаемость гематоэнцефалического барьера напрямую зависит от величины молекул. Маленькие молекулы кислорода, углекислого газа проходят вообще без проблем. Но чем крупнее молекула вещества, тем труднее ей пробраться. Впрочем, существуют способы облегчить эту задачу. Например, давно замечено, что жирорастворимые вещества диффундируют через барьер на ура. Это свойство используется при создании некоторых лекарств, например снотворных барбитуратов.
Интересна ситуация с таким важным веществом, как глюкоза. Пониженный ее уровень — гипогликемия мозга — проявляет себя в виде головной боли, нарушений внимания, спутанности сознания и эпилептических приступов. При этом концентрация сахара в крови может оставаться нормальной (!). Тут «заупрямился» ГЭБ и возникли нарушения в системе переноса глюкозы.
Кстати, все больше и больше свидетельств, что классическая эпилепсия, происхождение которой в известной мере остается загадкой для врачей, является «болезнью ГЭБ», когда нарушен транспорт глюкозы в тканях мозга.
ГЭБ и фармакология

Давайте сразу уясним, что большинству лекарств незачем преодолевать этот барьер. К примеру, средство от расстройства желудка должно держаться подальше от мозга и заниматься своим прямым делом в пищеварительном тракте. Но если возникло серьезное поражение центральной нервной системы, «тогда мы идем к вам!».
Антибиотикам желательно добраться до мозга при инфекционных поражениях, противоконвульсивным препаратам — для лечения судорог и, уж конечно, нейролептикам — для купирования острых психозов. Эффективность вышеперечисленных препаратов напрямую зависит от проницаемости ГЭБ.
А вот при болезни Паркинсона, для которой характерен недостаток допамина в мозге, не удастся восполнить этот дефицит ни таблетками, ни уколами, потому что допамин через ГЭБ, к сожалению, не проходит. Хотя, например, предшественник допамина — Л-допа — способен преодолеть ГЭБ. Но все-таки это не совсем то, что нужно.
Кстати, похожая ситуация при депрессиях, в патогенезе которых большую роль играет глютамат. Глютамат также не проникает через через ГЭБ. Поэтому глотать его бессмысленно.
Когда ГЭБ может рухнуть?
Существует ряд ситуаций, при которых страдает ГЭБ и мозг остается незащищенным. Это может случиться при высоком артериальном давлении, поэтому стоит держать его под контролем. Внутривенное введение гиперосмолярных растворов также несет в себе угрозу нарушения барьера. Длительное воздействие микроволнового излучения и радиации доказанно считается причинами нарушений ГЭБ. Инфекции центральной нервной системы типично дают сбои в работе барьера. Также нарушения возможны при травмах мозга, его ишемии, воспалении и инсультах.
А если ГЭБ не пускает, но нам очень нужно?

Существует ряд заболеваний головного мозга, когда жизненно важно пропихнуть лекарство в определенный участок мозга. Чаще всего это онкология. Для этого используется метод «локального открытия ГЭБ». Лучше всего работают маннитол и его аналоги, которые вводятся в артерию мозга под контролем компьютерного томографа.
Маннитол открывает ГЭБ примерно на час, и за это время опухоль подвергается воздействию химиотерапии. С уходом маннитола дверь в мозг закрывается. И правильно — нельзя оставлять мозг без защиты.
Подобным эффектом открытия ГЭБ обладают Лейкотриен С4 и брадикинин. В определенной дозе ГЭБ открывает и гистамин. Кстати, «закрыть дверь» за гистамином можно его антиподом — цимедином. Имейте в виду, что все эти препараты вводятся прицельно в надлежащий кровеносный сосуд. Если принимать их в виде таблеток или инъекций, результата не будет.
Информация для простого пациента
Не ведитесь на рекламу деятелей «народной медицины», утверждающих, что нашли средства, улучшающие состояние психики. Далеко не всякая таблетка, вами проглоченная, вообще доберется до головы. На страже вашего мозга стоит ГЭБ, и чаще всего это только на пользу.
При COVID-19 у 30–80% больных наблюдаются неврологические симптомы, и это не только широко известная потеря обоняния, но и «банальные» головная боль, боли в мышцах, тошнота и рвота, а также нарушения сознания. Это означает, что вирус непосредственно воздействует на центральную нервную систему. Но вот как он это делает, ведь пока непосредственно в тканях мозга SARS-CoV-2 не удалось обнаружить? Оказывается, все дело в гематоэнцефалическом барьере – удивительном «фильтре» между кровью и мозгом, призванном не пропускать в него токсины и «незваных гостей»
COVID-19 имеет самые разнообразные клинические проявления, от полной бессимтомности до тяжелых, в том числе летальных нарушений работы многих органов. В первую очередь страдают легкие в результате развития пневмонии и, в тяжелых случаях, острого респираторного дистресс-синдрома. Кроме того, характерное для этой болезни нарушение свертываемости крови влияет на ее микроциркуляцию, что пагубно отражается на работе почек, сердца, кишечника, селезенки, печени.
На сегодня все больше данных указывает на то, что решающее влияние на тяжесть течения болезни оказывает воспаление кровеносных сосудов. И это неудивительно, ведь молекулы белка АПФ2 (ангиотензинпревращающего фермента 2, ACE2), которые чаще всего используются вирусом для проникновения в организм человека, в большом количестве находятся на мембранах клеток, образующих внутреннюю выстилку сосудов – эндотелий.
Ученые из Медицинской школы им. Льюиса Каца Университета Темпла (США) на основе изучения посмертных тканей мозга человека показали, что мембранный белок-рецептор АПФ2 широко представлен во всех кровеносных сосудах лобной коры головного мозга. Кстати сказать, его количество намного больше у людей, страдающих гипертонической болезнью или деменцией – оба эти состояния служат фактором риска при COVID-19.
Эндотелий сосудов большинства тканей содержит открытые промежутки и межклеточные щели, через которые свободно циркулируют вода с растворенными в ней веществами. Однако эндотелий сосудов головного мозга отличается плотными контактами между соседними клетками. Так образуется своеобразная «перегородка» между кровью и клетками мозга – гематоэнцефалический барьер, который предотвращает свободное перемещение молекул, иммунных клеток и патогенов. С использованием клеточных культур и тканеинженерных конструкций, имитирующих капилляры мозга человека, исследователи обнаружили, что в присутствии белка-шипа вируса SARS-CoV-2 гематоэнцефалический барьер нарушается. Интересно, что хотя из двух субъединиц этого белка с рецептором ACE2 связывается лишь одна, на функцию защитного барьера мозга влияют обе. Так что механизм этого воздействия не связан с процессом присоединения вируса.

Вирусный белок не оказывает видимого влияния на жизнеспособность самих клеток эндотелия сосудов головного мозга, однако он увеличивает активность ферментов, которые поддерживают каскад воспалительной реакции. В результате развития воспаления проницаемость гематоэнцефалического барьера повышается, и это в прямом смысле слова «открывает ворота» в мозг инфицированным иммунным клеткам (и, возможно, вирусным частицам), что в свою очередь подстегивает воспалительный процесс. Все эти события могут объяснить неврологические симптомы при COVID-19, при этом долгосрочные эффекты подобного нарушения гематоэнцефалического барьера не изучены.
Кстати сказать, нарушения гематоэнцефалического барьера сопутствуют целому ряду заболеваний, от сахарного диабета и рассеянного склероза до опухолей головного мозга. Его эндотелий также является обычной мишенью для так называемых нейроинвазивных вирусов, способных проникать в ткани мозга. Среди них – вирусы бешенства и герпеса, ВИЧ и вирус Западного Нила, вирус Зика и наш «старый знакомец», возбудитель гриппа.
По мнению исследователей, SARS-CoV-2 также является потенциально нейроинвазивным, так как включает механизм, способствующий миграции инфицированных иммунных клеток в виде «троянских коней» в ткани мозга, и в ближайшее время они планируют заняться выяснением этого вопроса.
В представленной статье обобщены современные данные о строении и функции эпидермального барьера, рассмотрены вопросы его роли в развитии атопического дерматита.
This article summarizes current data on the structure and function of the epidermal barrier, we also considered its role in development of atopic dermatitis.
С тех пор как наземная жизнь стала угрожать млекопитающим обезвоживанием, все более становятся актуальными исследования структурных, клеточных, биохимических и регуляторных механизмов организма, участвующих в поддержании гомеостаза проницаемости эпидермального барьера [1].
Кожа обеспечивает жизненно важную функцию, защищая позвоночных от повседневных и экстремальных влияний факторов внешней среды, таких как воздействие антигенов, ультрафиолетового света, моющих средств, микроорганизмов, токсинов, наночастиц и иных повреждений [2]. Таким образом, эпидермальный барьер, являясь физическим барьером [3], обеспечивает защиту организма на границе двух сред, ограничивая как потерю воды из организма, так и попадание патогенных микроорганизмов в организм [4].
Важнейшая составная часть эпидермального барьера, от которой зависит проникновение раздражителей и аллергенов, находится в нижней части рогового слоя [5]. Несмотря на минимальные размеры (толщина около 7–35 мкм), он играет определяющую роль в формировании защитного барьера и способствует предотвращению чрезкожного проникновения патогенов. Кроме роли физического барьера, роговой слой участвует в терморегуляции, газообмене, гидратации, обеспечении врожденного иммунитета, а создавая определенную pH поверхности кожи (слегка кислую), обеспечивает дополнительную защиту от болезнетворных микроорганизмов [6].
Во время терминальной дифференцировки кератиноциты зернистого слоя «заменяют» свою клеточную мембрану на нерастворимый белковый слой — роговую оболочку [7]. Она придает прочность корнеоцитам и является «платформой» для прикрепления липидов. Роговая оболочка в основном сформирована структурными белками, такими как лорикрин, инволюкрин, филаггрин (ФЛГ) и малыми пролин-богатыми белками. Особенно важен филаггрин, объединяющий кератиновые волокна клеток, «скручивая» кератиноциты в уплощенные диски с большой площадью поверхности [8].
Вокруг корнеоцитов расположены холестерин, фосфолипиды и церамиды, создавая многослойную мембрану из липидных пластинок [3, 9]. Последние играют важную роль в регуляции водного гомеостаза кожи, помогают сохранять воду в организме, а также предотвращают проникновение патогенных микроорганизмов и аллергенов [10].
На границе между роговым и зернистым слоями происходит секреция ламеллярных телец, содержащих предшественники липидов, а также необходимые ферменты для переработки этих прекурсоров в зрелые составляющие липидной матрицы [11]. Перед секрецией происходит сборка ламеллярных телец в пластинчатом комплексе, посредством дифференцированной их упаковки с различным содержимым [12]. Кроме вышеупомянутых метаболитов липидов, липидные тельца доставляют в межклеточное пространство рогового слоя протеолитически активные ферменты, такие как сериновые протеазы семейства калликреина, а также их ингибиторов, в том числе и лимфоэпителиальный ингибитор сериновых протеаз типа Kazal-5 (LEKTI) [13].
Единство между корнеоцитами рогового слоя зависит прежде всего от корнеодесмосом. Подобно десмосомам, они поддерживают целостность тканей посредством молекул межклеточной адгезии с помощью кальций-зависимых взаимодействий между двумя представителями семейства кадгерина, внеклеточных трансмембранных гликопротеинов — десмоглеина и десмоколлина. Внутри корнеоцитов десмоглеин и десмоколлин соединяют кератиновые филламенты корнеодесмосом посредством «соединительной бляшки», состоящей из плакоглобина, десмоплакина и плакофиллина. Десмоглеин и десмоколлин перемещаются от оболочки корнеоцитов в липидную пластину между корнеоцитами и связывают воедино белки соседних клеток. Кроме того, в процессе кератинизации эпителия экспрессируется специфический белок с молекулярной массой 52 кДа — корнеодесмосин [8, 14]. После секреции в экстрацеллюлярное пространство корнеодесмосин перемещается в область между зернистым и роговым слоями и проникает в десмосому. Появление корнеодесмосина знаменует переход от десмосом к корнеодесмосомам [3, 12].
Во время «нормальной» десквамации рогового слоя самые поверхностные корнеоциты «уходят» с поверхности кожи, замещаясь кератиноцитами, подвергшимися терминальной дифференцировке [14, 15]. Таким образом, существует «тонкий» баланс между базальной клеточной пролиферацией и десквамацией рогового слоя. Это обеспечивает постоянное обновление клеток эпидермиса, а также способствует поддержанию одинаковой толщины эпителия [14, 16]. Caubet и соавт. [15] описали несколько деградационных протеаз, которые разрушают внеклеточные корнеодесмосомальные адгезивные белки, связывающие корнеоциты вместе.
В роговом слое среди протеаз, вовлеченных в процесс десквамации, присутствуют хемотрипсиновые (SCCE) и трипсиновые ферменты (SCTE), которые экспрессируются кератиноцитами зернистого слоя и находятся во внеклеточном пространстве рогового слоя [14]. Данные протеазы гидролизуют корнеодесмосин и десмоколлин [15]. Их активность контролируется семейством специфических ингибиторов, в которое входит LEKTI [17]. При этом скорость десквамации коррелирует с количеством ингибиторов протеаз, поступивших из ламеллярных телец [3].
На барьерную функцию эпидермиса влияют структура, дифференцировка, функциональная активность кератиноцитов, качественный и количественный состав липидов рогового слоя эпидермиса, наличие веществ, относящихся к естественному увлажняющему фактору, а также рН поверхности кожи [18]. При изменении каких-либо из перечисленных показателей барьерная функция эпидермиса нарушается, что приводит к усиленному испарению воды через роговой слой. У человека эпидермальный барьер восстанавливается на 60% через 12 часов, а полное восстановление занимает 72 часа [19]. Полагают, что быстрое восстановление эпидермального барьера происходит за счет массового выброса из клеток готовых ламеллярных телец. В медленную фазу восстановления усиливается синтез жирных кислот, холестерина, церамидов, а также образование новых ламеллярных гранул. Нарушение восстановления кожного барьера приводит к обезвоживанию эпидермиса и развитию выраженной сухости кожи, что и наблюдается при развитии атопического дерматита (АД) [20].
Повреждение эпидермального барьера способствует проникновению через кожу микробов, аллергенов и различных поллютантов (токсины, раздражающие и загрязняющие вещества). Проникновение агентов с антигенными свойствами увеличивает риск сенсибилизации, поскольку взаимодействие аллергенов и аллерген-представляющих клеток кожи инициирует воспаление [14]. Степень дисфункции барьера коррелирует со степенью воспаления и тяжестью АД [11]. Впервые Y. Werner и M. Lindberg (1985 г.) привели доказательства нарушений барьерной функции кожи, измерив трансэпидермальную потерю воды (ТЭПВ) у лиц с АД. Авторам удалось показать, что у больных АД нарушения эпидермального барьера отмечаются не только в очагах активного воспаления, но и на клинически неизмененной коже [10, 21].
Изменения в свойствах эпидермального барьера, которые наблюдаются при АД, включают увеличение ТЭПВ, изменения рН поверхности кожи, повышение ее проницаемости, увеличение бактериальной колонизации, изменение в экспрессии антимикробных пептидов, а также нарушение его целостности. При аномалии эпидермального барьера аллергены, раздражающие и другие вещества могут проникать через кожу, способствуя обострению АД [6].
В настоящее время нарушение функции кожного барьера является одним из ведущих этиопатогенетических факторов АД. По данным разных авторов у 30–66% больных АД протекает без изменения уровня общего IgE в сыворотке крови и специфичных IgE к аллергенам. Полагают, что именно у этих пациентов нарушение функции кожного барьера играет ведущую роль в развитии и прогрессировании заболевания [22].
В последние годы определен ряд генетических мутаций, приводящих к изменениям в роговом слое эпидермиса. Так, у больных АД определяются мутации гена профилаггрина [23], способствующие нарушению синтеза белка ФЛГ — одного из компонентов цитокератинового скелета, обеспечивающего ороговение кератиноцитов. В результате изменения терминальной дифференцировки кератиноцитов развивается их функциональная несостоятельность [24]. Кроме того, снижение экспрессии гена ФЛГ уменьшает уровень «натурального увлажняющего фактора» [25]. Дефицит ФЛГ и/или продуктов его деградации способствует сухости кожи, что коррелирует с клинической картиной нарушения эпидермального барьера при АД [26]. Более того, при уменьшении ФЛГ усиливается «раздражающий» эффект аллергенов на дендритные клетки, понижая при этом порог их чувствительности к воспалению, что демонстрирует важность этого белка в предотвращении пенетрации аллергенов [27].
Кроме того, у больных АД выявлены полиморфные варианты гена SPINK5, приводящие к дизрегуляции синтеза ингибитора сериновой протеазы LEKTI, который в норме блокирует избыточную продукцию SCCE [28]. Активность деградационных протеаз также значимо связана с дефектом кожного барьера при АД [23]. Разбалансировка функционирования этих ферментов ведет к усиленному отшелушиванию клеток и истончению рогового слоя, увеличивая проницаемость эпидермального барьера [14]. Установлено, что у больных АД изменена липидная мантия рогового слоя, предупреждающая ТЭПВ. Отмечается низкий уровень церамидов первого и третьего типов в сочетании с повышением уровня свободного холестерола [29]. Повышение уровня рН на поверхности кожи приводит к снижению синтеза липидов и активизации ферментов (в частности, SCCE), повреждающих корнеодесмосомы. Уменьшение количества веществ, относящихся к «натуральному увлажняющему фактору», также способствует нарушению функционирования эпидермального барьера [30].
Таким образом, у больных АД отмечается комплекс нарушений, приводящих к дисфункции кожного барьера, усилению ТЭПВ и обезвоживанию кожных покровов [14]. Из вышеуказанного следует, что пациенты с АД могут иметь дефект кожного барьера, в основе которого лежат как генетические, так и приобретенные механизмы. Этот дефект способны спровоцировать внешние факторы, такие как царапины, использование моющих средств, микробная колонизация, а также воздействие протеаз различных аллергенов (в частности, протеаз клещей домашней пыли) [10]. Распознание конкретных механизмов, участвующих в патогенезе воспалительных заболеваний кожи, в частности, АД, безусловно, будет способствовать поиску и разработке новых, более эффективных методов воздействия на патологический процесс с минимальным количеством системных эффектов [8].
Литература
- Elias P. M. The skin barrier as an innate immune element // Semin. Immunopathol. 2007. Vol. 29 (1); р. 3–14.
- De Benedetto A., Kubo А., Beck L. A. Skin barrier disruption — a requirement for allergen sensitization? // J. Invest. Dermatol. 2012. Vol. 132 (3); р. 949–63.
- Danby S. G., Cork M. J. New understanding of atopic dermatitis: the role of epidermal barrier dysfunction and subclinical inflammation. // J. Clin. Dermatol. 2010. Vol. 1 (2); р. 33–46.
- Котлуков В. К., Кузьменко Л. Г., Антипова Н. В. Наружные дерматологические средства серии «Бепантен» в практике педиатра // Медицинский совет. 2012. Т. 5; с. 81–85.
- Madison K. С. Barrier function of the skin: «la raison d’etre» of the epidermis // J. Invest. Dermatol. 2003. Vol. 121; р. 231–241.
- Lorena S. T., Morello III A. P., Mack Correa M. C. et al. The infant skin barrier: can we preserve, protect, and enhance the barrier? // Dermatol. Res. Pract. 2012. Doi: 10.1155/2012/198789.
- Candi E., Schmidt R., Melino G. The cornified envelope: a model of cell death in the skin // Nat. Rev. Mol. Cell Biol. 2005. Vol. 6; р. 328–340.
- Michael J. C., Simon G. D., Yiannis V. et al. Epidermal barrier dysfunction in atopic dermatitis // J. Invest. Dermatol. 2009. Vol. 129; р. 1892–908.
- Ревякина В. А. Современные тенденции в комплексной наружной терапии атопического дерматита у детей // Лечащий Врач. 2014. № 6, с. 38.
- De Benedetto А., Agnihothri R., McGirt L. Y. et al. Atopic dermatitis: a disease caused by innate immune defects? // J. Invest. Dermatol. 2009. Vol. 129; р. 14–30.
- Roelandt T., Thys B., Heughebaert C. et al. LEKTI-1 in sickness and in health // Int. J. Cosmetic Sci. 2009. Vol. 31 (4); р. 247–254.
- Ishida-Yamamoto A., Simon M., Kishibe M. et al. Epidermal lamellar granules transport different cargoes as distinct aggregates // J. Invest. Dermatol. 2004. Vol. 122; р. 1137–1144.
- Ishida-Yamamoto A., Deraison C., Bonnart C. et al. LEKTI is localized in lamellar granules, separated from KLK5 and KLK7, and is secreted in the extracellular spaces of the superficial stratum granulosum // J. Invest. Dermatol. 2005. Vol. 124; р. 360–366.
- Cork M. J., Robinson D. A., Vasilopoulos Y. et al. New perspectives on epidermal barrier dysfunction in atopic dermatitis: gene-environment interactions // J. Allergy Clin. Immunol. 2006. Vol. 118; р. 3–21.
- Caubet C., Jonca N., Brattsand M. et al. Degradation of corneodesmosome proteins by two serine proteases of the kallikrein family, SCTE/KLK5/hK5 and SCCE/KLK7/hK7 // J. Invest. Dermatol. 2004. Vol. 122; Р. 1235–1244.
- Goldstein A. M., Abramovits W. Ceramides and the stratum corneum: structure, function, and new methods to promote repair // Int. J. Dermatol. 2003. Vol. 42; р. 256–59.
- Chavanas S., Bodemer C., Rochat A. Mutations in SPINK5, encoding a serine protease inhibitor, cause Netherton syndrome // Nat. Genet. 2000. Vol. 25; р. 141–142.
- Мурашкин Н. Н. Нарушения дермального барьера как фактор хронизации дерматозов в детском возрасте, подходы к терапии: теоретические и практические инновации // Лечащий Врач. 2014. № 6, с. 19.
- Эрнандес Е., Марголина А., Петрухина А. Липидный барьер кожи и косметические средства // Косметика и медицина. 2005. Т. 6; с. 35–38.
- Тамразова О. Б. Синдром сухой кожи // Дерматология. Приложение к журналу Consilium Medicum. 2014. Т. 3; с. 25–31.
- Хлебникова А. Н. Увлажняющие средства в терапии хронических дерматозов // Клиническая дерматология и венерология. 2010. Т. 4; с. 32–39.
- Palmer C. N., Irvine A. D., Terron-Kwiatkowski A. et al. Common loss-of-function variants of the epidermal barrier protein filaggrin are a major predisposing factor for atopic dermatitis // Nat. Genet. 2006. Vol. 38 (4); р. 441–446.
- Молочков А. В., Тамразова О. Б. Ксероз кожи — основной патогенетический фактор развития атопического дерматита // Дерматология. Приложение к журналу Consilium Medicum. 2014. Т. 4; с. 48–54.
- Vasilopoulos Y., Cork M. J., Murphy R. et al. Genetic association between an AACC insertion in the 3’UTR of the stratum corneum chymotryptic enzyme gene and atopic dermatitis // J. Invest. Dermatol. 2004. Vol. 123; р. 62–66.
- Smith F. J., Irvine A. D., Terron-Kwiatkowski A. et al. Loss-of-function mutations in the gene encoding filaggrin cause ichthyosis vulgaris // Nat. Genet. 2006. Vol. 38 (3); р. 337–342.
- Nemoto-Hasebe I., Akiyama M., Nomura T. et al. Clinical severity correlates with impaired barrier in? laggrin-related eczema // J. Invest. Dermatol. 2009. Vol. 129 (3); р. 682–689.
- Fallon P. G., Sasaki T., Sandilands A. et al. A homozygous frameshift mutation in the mouse Flg gene facilitates enhanced percutaneous allergen priming // Nat. Genet. 2009. Vol. 41 (5); р. 602–608.
- Kato A., Fukai K., Oiso N. et al. Association of SPINK5 gene polymorphisms with atopic dermatitis in the Japanese population // Br. J. Dermatol. 2003. Vol. 148; р. 665–669.
- Пампура А. Н., Чусляева А. А. Современные подходы к терапии атопического дерматита у детей // Медицинский вестник Башкортостана. 2014. Т. 9 (1); с. 93–98.
- Eberlein-Konig B., Schafer T., Huss-Marp J. et al. Skin surface pH, stratum corneum hydration, transepidermal water loss and skin roughness related to atopic eczema and skin dryness in a population of primary school children // Acta Dermatol. Venereol. 2000. Vol. 80; р. 188–191.
С. В. Левашева 1 , кандидат медицинских наук
Э. И. Эткина, доктор медицинских наук, профессор
Л. Л. Гурьева, кандидат медицинских наук
Л. И. Бабенкова, кандидат медицинских наук
Л. Я. Данилова
С. Э. Якута
ГБОУ ВПО БГМУ МЗ РФ, Уфа
Читайте также:

