Метод клинической диагностики состояния периапикальных тканей зубов
Опубликовано: 16.05.2024
В прошлой статье была рассмотрена общая характеристика апикального периодонтита и более углублено особенности течения острого апикального периодонтита. В этой статье мы подробно рассмотрим хронический апикальный периодонтит, клинику, диагностику и особенности лечения. А также коснемся особенностей клиники и лечения травматического и медикаментозного периодонтитов.
Вспомним классификацию. Согласно некоторым классификациям, апикальные периодонтиты бывают:
Классификация МКБ – 10
К 04.4 Острый апикальный периодонтит пульпарного происхождения
К 04.5 Хронический апикальный перодонтит
К 04.6 Периапикальный абсцесс со свищём
- Дентальный
- Дентоальвеолярный
- Периодонтальный абсцесс пульпарного происхождения
К 04.60 Имеющий сообщение с ВЧ пазухой
К 04.61 Имеющий сообщение с полостью носа
К 04.62 Имеющий сообщение с полостью рта
К 04. 63 Имеющий сообщение с кожей
К 04.69 Периапикальный абсцесс со свищём неуточненный
К 04.7 Периапикальный абсцесс без свища
- Дентальный
- Дентоальвеолярный
- Периодонтальный абсцесс пульпарного происхождения
- Периапикальный абсцесс без свища неуточненный
К 04.8 Корневая киста
К 04.89 Корневая киста неуточненная
К 04.9 Другие неуточненные заболевания пульпы и периапикальный тканей
Классификация периодонтитов по И. Г. Лукомскому
- Острые периодонтиты
- Серозный
- Гнойный
- Хронические периодонтиты
- Фиброзный
- Гранулирующий
- Гранулематозный
- Обострение хронического периодонтита
Хронический апикальный периодонтит
Хронический апикальный периодонтит – чаще всего бессимптомное воспаление в тканях апикального периодонта, которое проявляется рентгенологическими изменениями на верхушках корней зуба.
Многие стоматологи используют клинически удобную классификацию И. Г. Лукомского. Она упрощает постановку диагноза.
Хронический фиброзный периодонтит
Возникает как исход острого периодонтита или излечение гранулирующего и гранулематозного периодонтитов. Имеет значение и травматическая этиология из-за перегрузки, которая наступает при утрате большого количества зубов или нефизиологической артикуляции.
Хронический фиброзный периодонтит выявляется на рентген-снимке как расширение периодонтальной щели в области апекса и почти никогда не сопровождается деструкцией прилежащей кости.

Хронический гранулирующий периодонтит
Является наиболее активной формой среди всех хронических периодонтитов, является исходом острого процесса.
Пациент жалуется на неприятные, слегка болезненные ощущения при накусывании на причинный зуб.
Внешне пациент выглядит как обычно, иногда имеются увеличение поднижнечелюстных лимфатических узлов. В ротовой полости видим гиперемированную слизистую в области зуба, болезненную при пальпации. Отличительной чертой этого вида периодонтита является наличие свища в проекции верхушки корня. Из него может выделяться гной или выбухать грануляции. Молодая грануляционная ткань прорастает через поврежденный цемент или даже дентин в костномозговые пространства, нередко растет по стенкам свищевого хода. Зуб разрушен или интактен. Перкуссия слабоположительная.
На рентгенограмме видим очаг просветления вследствие деструкции кости в области верхушки корня. Очаг имеет нечеткие контуры, бывает разных размеров.

Хронический гранулематозный периодонтит
Этот вид периодонтита протекает бессимптомно, проявляется клинически только при обострениях. Эти проявления могут быть по типу гранулирующего периодонтита в виде свищей и гиперемии слизистой.
Отличие гранулематозного периодонтита от гранулирующего состоит в наличии на рентгенограмме очага просветления на верхушках корней четкой округлой формы (апикальная гранулема).
В настоящее время врачи отходят от градации размеров очага (0,5 см-гранулема, 0,6-0,8 см-кистогранулема, более 0,8 см-радикулярная киста.

Киста-что это и почему
Киста — это полость, которая имеет эпителиальную выстилку и кистозное содержимое. Существует две разновидности кист- истинная и карманная.
Истинная полностью закрыта эпителиальной выстилкой, а карманная сообщается с корневым каналом, она как бы растёт из него.
Формирование кисты происходит в 3 этапа.
На первом этапе вероятнее всего эпителиальные клетки островков Малассе пролиферируют под воздействием факторов роста.
Во время второго этапа образуется эпителиальная полость.
Эти эпителиальные клетки направляются от своего источника питания, гибнут, нейтрофилы тянут их остатки в область некроза. Формируются микрополости, которые затем сливаются в одну и становятся ограниченными многослойным плоским эпителием.
Существует и другая теория- теория о закрытии эпителием всех открытых соединительнотканный участков, в следствие некроз.
На третьей стадии формирования кисты после гибели нейтрофилов, имеются запасы простагландинов, а также цитокины, вырабатываемые макрофагами и Т лимфоцитами. Вместе они активируют остеокласты и запускают резорбцию кости.
Карманные кисты имеют иной механизм развития. Около апикального отверстия наблюдается большое скопление нейтрофилов в ответ на инфекцию корневого канала. Клетки, как и раньше, гибнут, и этот микроабсцесс закрывается пролиферирующим эпителием. Образуется, так называемое, эпителиальное кольцо. Нейтрофилы, которые остались за пределами канала, погибая, формируют микрополость. Присутствие инфекции за пределами канала ещё больше притягивает нейтрофилов, расширяя микрополость до больших размеров. Карманная киста называется таковой из-за подобия расширения корневого канала увеличению периодонтального кармана.


Травматический периодонтит
Травма периодонта – один из инициирующих факторов возникновения кровоизлияния и развития ишемии, которая напрямую ведет к образованию некроза пульпы. Очаг некроза притягивает к себе бактерии, колонизирует их и инфицирует периодонт. С ростом количества микроорганизмов начинается острое воспаление. Развивается травматический периодонтит.
При хронической длительной травме перестройка периодонта происходит постепенно, сначала в силу своей адаптации, затем как хроническое воспаление с лакунарной резорбцией компактной пластинки.
Основной причиной развития патологии является воспалительный ответ. Вследствие окклюзионной травмы в пульпе вырабатываются медиаторы воспаления, их считают защитной реакцией на механическую агрессию. Они нарушают микроциркуляцию и повышают проницаемость сосудов. Пульпа погибает.
Когда некроз пульпы достигает апикальный периодонт, из-за своего цитотоксического действия интерлейкинами, активирует остеокласты и резорбцию кости.
Медикаментозный периодонтит
Медикаментозный периодонтит развивается при попадании в периодонт агрессивных жидкостей или лекарственных средств, таких как мышьяковистая паста, формалин, три крезол формалин, фенол. Проникновение в периодонт происходит через корневой канал.
Сюда же относится периодонтит, развивающийся в ответ на выведение в периодонт при лечении пульпита фосфат-цемента, резорцин-формалиновой пасты, штифтов и других пломбировочных материалов. К медикаментозному периодонтиту относят и периодонтит по причине аллергии в результате применения препаратов, способных вызвать местный иммунный ответ (антибиотики, эвгенол и др.).

Инородные тела
Гуттаперча, бумажные пины, остатки кальция и другие самые разнообразные вещи можно встретить в периапикальных тканях.
Апикальный периодонт всегда реагирует на инородные тела. Они могут попасть через корневой канал, через травмированную слизистую оболочку или периодонтальный карман.
В случае проникновение бумажного пина, следует помнить, что человеческий организм не умеет перерабатывать целлюлозу, поэтому инородное тело окружает бактериальная бляшка, которая поддерживает воспаление.
Гуттаперча — биосовместимый материал. Однако, в тоже время может давать реакцию со стороны верхушечного периодонта. В исследованиях на морских свинках показано, что большие частицы гуттаперчи инкапсулируются, их окружают коллагеновые волокна, а мелкие частицы поддерживают локальную тканевую реакцию. А магний и кремний, которые содержатся в избытке гуттаперчи, способны вызывать резорбцию.

Диагностика хронического апикального периодонтита
Диагностика хронического апикального периодонтита сходна с таковой в случае острого апикального периодонтита. А значит используем основные, дополнительные методы диагностики.
К основным относят выяснение жалоб пациента, анамнеза, зондирование, перкуссия, пальпация и определение подвижности зуба.
Жалобы пациента чаще всего отсутствуют, но могут жаловаться на неприятные ощущения во время еды при накусывании.
Зондирвоание безболезненное, пальпацмя слизистой в области верхушки также безболезненная. Перкуссия слабоположительная.
К дополнительным специальным методам относят определение электровозбудимости пульпы (снижена до 200мкА), определение окклюзии (наличие или отсутствие травмирующего фактора), свищевого хода, температурные тесты.
NB! Обязательно проводим рентгенологическое исследование.

Лечение хронического апикального периодонтита, травматического и медикаментозного периодонтитов
После диагностики приступают к составлению плана лечения хронического апикального периодонтита, основываясь на данных клинической и рентгенологической картин.
Лечение травматического периодонтита начинают с выявления и устранения травмирующего фактора.
Лечение медикаментозного периодонтита заключается в антисептической обработки системы корневых каналов, перепломбировке при выявлении инородного тела в апикальном периодонте. При воздействии агрессивных жидкостей за пределами апекса, на устья кладут ватный шарик или помещают ватную турунду в канал, смоченную антидотом (например, для мышьяковистого ангидрида антидотом является 5% р-р унитиола или 2-3% настойка йода). При мышьяковистых периодонтитах наблюдается болевой синдром при накусывании на зуб, со стороны слизистой редко бывают патологические изменения.
При выведении гипохлорита натрия за верхушку наблюдается резкая распирающая боль, кровоподтеки, отек на стороне поражения. Корневые каналы обильно промывают физраствором, область верхушки корня обкалывают физраствором количеством, превышающим объем гипохлорита в 10 раз. К пломбировке приступают в следующее посещение при отсутствии прогрессирования патологического процесса.
Назначают антибиотики, противовоспалительные и антигистаминные препараты.
Общим среди лечения у всех видов апикальных периодонтитов является эндодонтическое лечение причинного зуба.
Что является основным определяющим фактором для стоматолога при выборе алгоритма вмешательства в ходе эндодонтического лечения: имеющиеся знания, опыт или результаты КЛКТ-анализа? В данной статье описан клинический случай лечения 10-летнего пациента с периапикальной патологией, который подтверждает мысль о том, что эндодонтически пораженные зубы не всегда следует удалять. Даже в случаях корней с очень изогнутой морфологией успешного результата лечения можно достичь, используя специальные никель-титановые файлы.
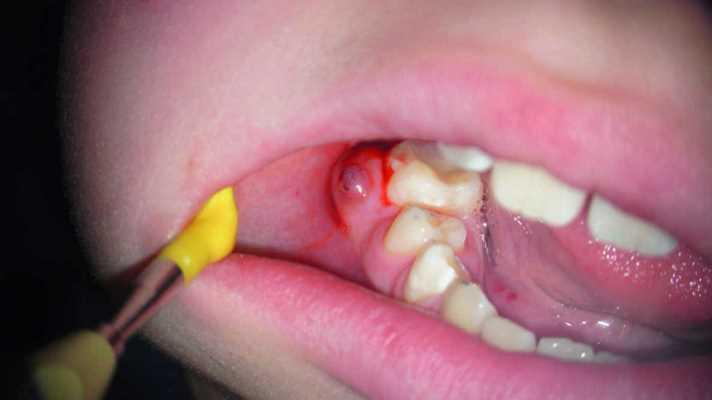
Хотя клиническая стоматология и богата полученными доказательствами в пользу разных алгоритмов лечения, но в большинстве своих случаев такие доказательства являются весьма низкого качества. В конце концов врачи больше ориентируются на свой собственный опыт. Даже простой клинический случай можно лечить разными методами с достаточно хорошим прогнозом. Обсуждение подобных тематик является весьма распространенным в социальных сетях. Исследование, недавно проведенное в Гентском университете в Бельгии, показало, что стоматологи часто оказываются предвзятыми и совершают ошибки при принятии необходимых клинических решений. Например, в случаях персистирующего и хронического асимптоматического апикального поражения эндодонтист скорее всего предпочтет проведение повторного эндодонтического лечения или же апикальной хирургии, вместо экстракции с последующей имплантацией. Ортопеды и хирурги, наоборот, будут склонятся к последнему алгоритму вмешательства. На самом деле выбор метода лечения должен учитывать пожелания пациента после подписания им информированного согласия относительного того, что он полностью ознакомлен со всеми возможными вариантами реабилитации. В данной статье мы обсудим, как же лучше всего проводить выбор алгоритма лечения при наличие определенного апикального поражения.
Эндодонтическое лечение
Последние данные из Гентского университета и других эпидемиологических исследований показывают, что в 22% случаев врачи выбирают экстракцию как метод лечения периапикального поражения размером более 1 см. Если же размер патологии превышал 1 см – более 50% врачей склонялись к необходимости его удаления. В принципе выбор такой тактики вмешательства логичен: врачи ведь не знают истинной гистологической картины поражения (киста ли это, или же периапикальная гранулема), следовательно, алгоритм лечения базируется на полученных рентгенологических данных. Naïr указывает на то, что провести дифференциальную диагностику между кистозными и некистозными поражениями по данным лишь рентгенограмм попросту невозможно. Аналогично в ходе динамического мониторинга сложно сказать, увеличивается ли поражения после лечения, или наоборот уменьшается.
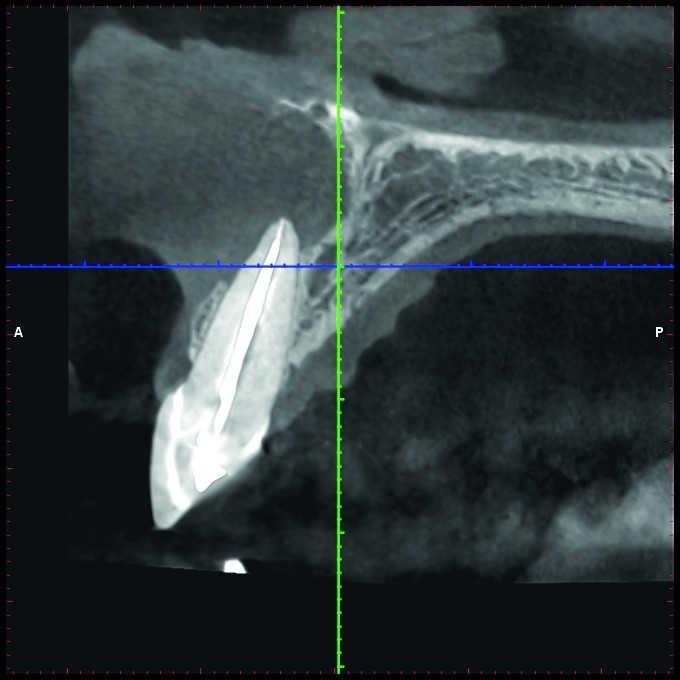
Более того, нужно учитывать ограничения 2-D рентгенограмм в ходе планирования клинического вмешательства. Wu и соавторы показали, что прицельные снимки часто указывают на здоровое состояние области апекса или же ее интенсивное заживление, когда же на самом деле результаты КЛКТ-контроля демонстрируют выраженные признаки апикального периодонтита (фото 1 и 2).
Фото 1. Рентгенограмма с визуализацией эндодонтически пролеченного зуба №11 и чувствительным на холод зуба №12.
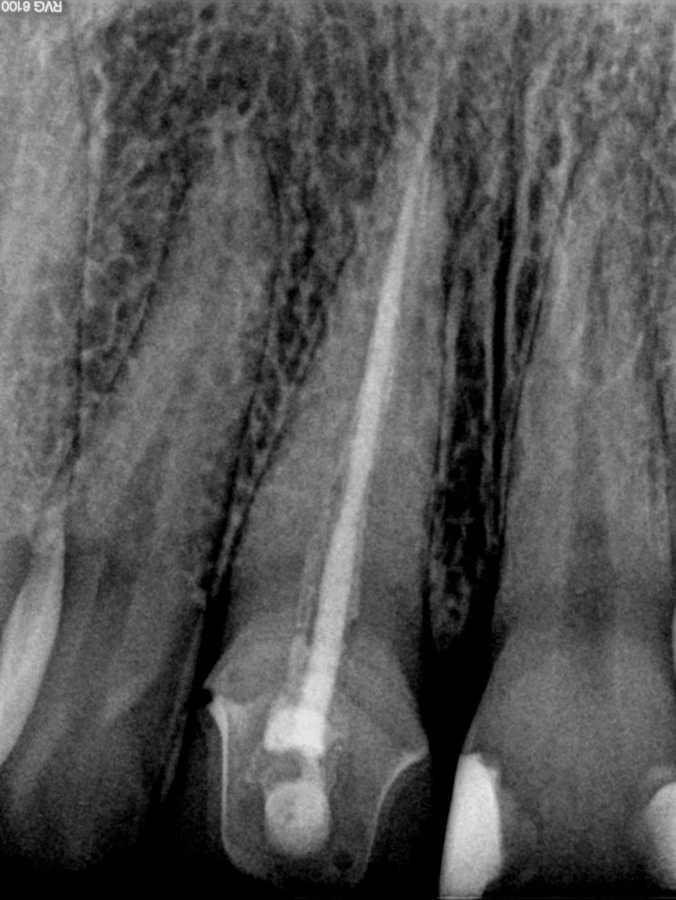
Фото 2. КЛКТ-данные той же исследуемой области, указывающие на наличие огромного апикального дефекта.
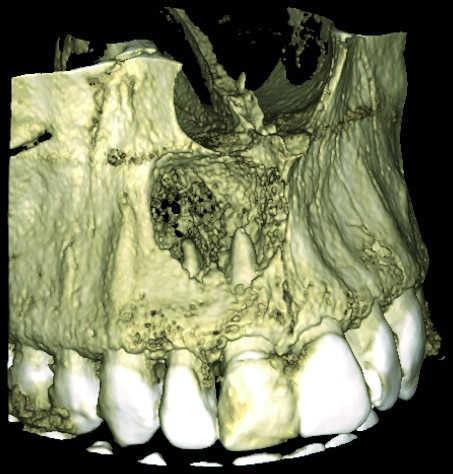
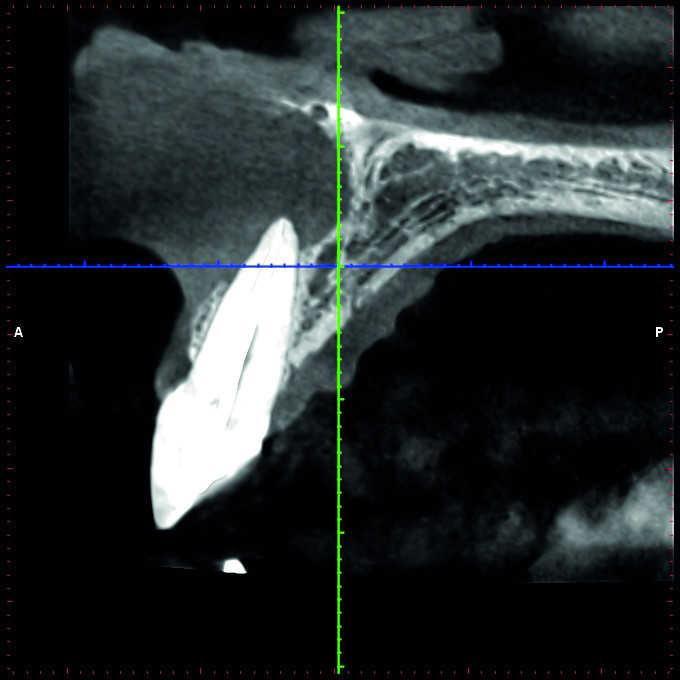
Хотя КЛКТ и позволяет более точно определить наличие и размер апикального очага поражения, однако пока проведено недостаточное количество исследований, аргументирующих необходимость КЛКТ-сканирования как стандартного метода диагностики в эндодонтической практике. Morris и коллеги пришли к выводу, что эндодонтическое лечение зубов с дальнейшим выполнением прямых и непрямых реставраций, обеспечивает достижение довольно прогнозированных результатов реабилитации, что, в свою очередь, обосновывает возможность выбора эндолечения как первого варианта выбора.
Размер имеет значение?
В целом, данные литературы говорят о том, что чем больше периапикальное поражение, тем меньше благоприятных условий для его заживления. В принципе все логично: чем больше патологический очаг, тем больше ему потребовалось времени, чтобы вырасти. Чем длительнее развивалась бактериологическая ассоциация, тем больше разных бактерий входит в ее состав, а значит тем сложнее будет вылечить такую патологию. Конечно, надо еще провести ряд дополнительных исследований, но в целом увеличение очага периапикального поражения на каждый миллиметр снижает прогноз успешного лечения на 14 процентов по сравнению с клиническими случаями эндолечения, в которых рентгенологические признаки периапикальной патологии отсутствуют вовсе. Аналогичная тенденция отмечается и в периапиклаьной хирургии: существует негативная корреляция между размером апикального очага и возможностью полного заживления области вмешательства. В ходе проведения ортоградного эндодонтического вмешательства размер апикального участка поражения более 2 мм категоризируется как фактор риска необходимости проведения повторного эндодонтического лечения в будущем. При этом, однако, надо помнить, что размер образования на периапикальных снимках во многом зависит от их качества и угла позиционирования. Хотя ранее считалось, что чем больше периапикальный очаг, тем более вероятна его кистозная структура, однако подобные выводы неаргументированные без дополнительного проведения гистологических исследований. Большие по размеру периапикальные образования характеризуются тенденцией к увеличению с возможностью вовлечения в процесс смежных анатомических структур. Это не означает, что лечение таких очагов невозможно, однако его прогнозированность становиться гораздо меньшей.
Клинический случай: молодой пациент с хроническим апикальным абсцессом
10-летний пациент был направлен на эндодонтическое лечение правого моляра нижней челюсти. В области зуба №46 было отмечено наличие свищевого хода с небной стороны. Пациент и его родители были информированы о том, что успешность будущего эндодонтического вмешательства является сниженной, учитывая огромный размер периапикального поражения. Однако, все же они не хотели удалять проблемный зуб. После клинического осмотра и рентгенологического контроля был поставлен диагноз некроза пульпы и хронического апикального абсцесса (фото 3-4).
Фото 3. Рентгенограмма области зуба №46 с визуализацией периапикальной области поражения.
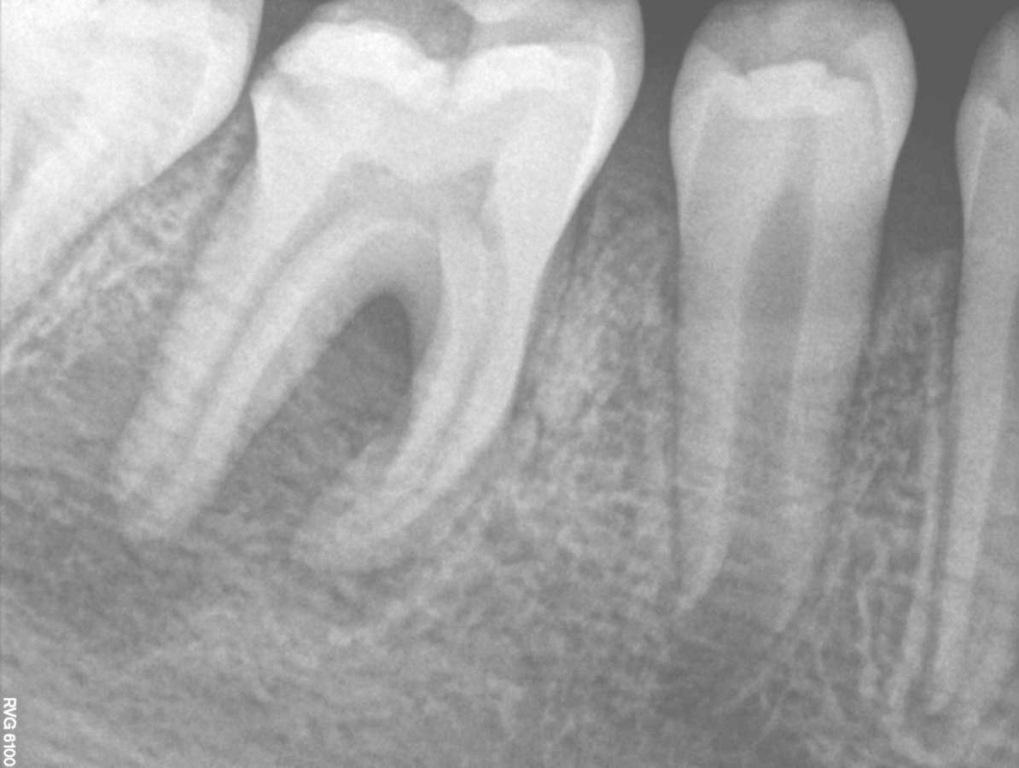
Фото 4. Клинический вид области поражения.
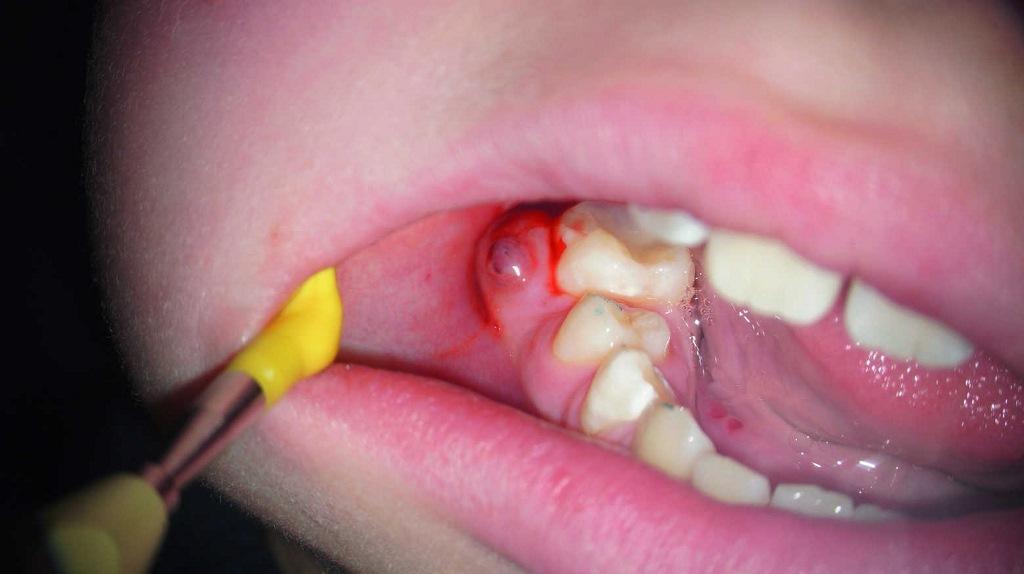
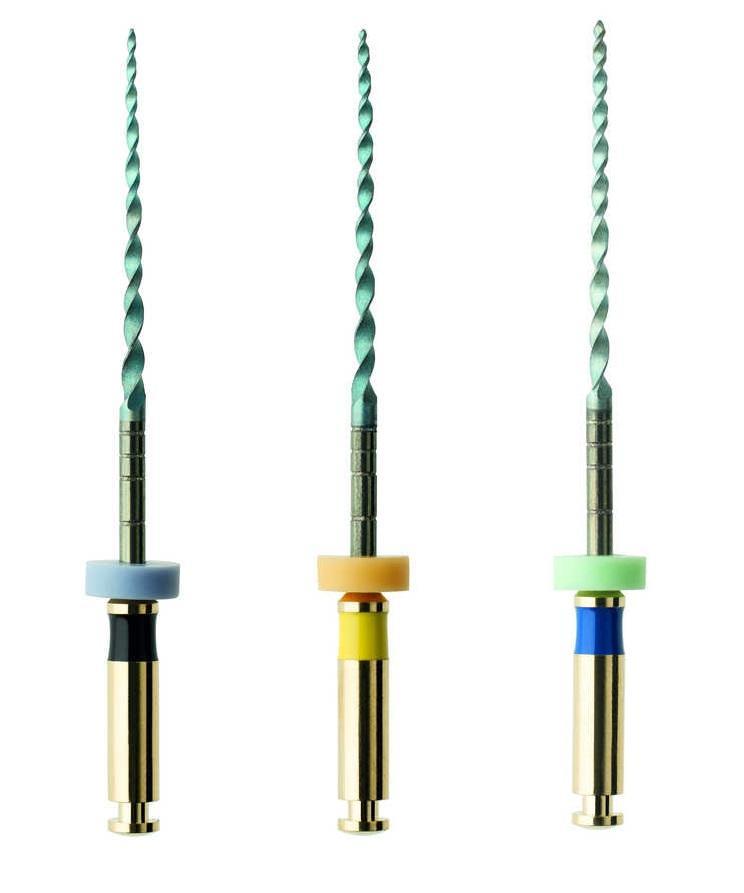
Зондирование свищевого хода подтвердило его направленность в сторону апекса. Выбор эндодонтического метода лечения также был обоснован необходимостью проведения корректирующих ортодонтических и ортопедических вмешательств в случаях выполнения процедуры экстракции зуба в таком молодом возрасте. В ходе первого визита зуб был изолирован посредством коффердама, после чего врач провел очистку всего имеющегося кариеса. Для обработки каналов использовали NiTi-файлы (HyFlex EDM) швейцарского производителя COLTENE (фото 5). Обработка каналов проводилась до размеров 40/04. В ходе лечения использовалась именно эта система, поскольку она характеризуется высокой гибкостью инструментов, что было крайне важно в имеющихся у пациента каналах с изогнутой морфологией. Кроме того, для обработки всего эндопространства потребовалось всего лишь несколько инструментов. Химическая обработка каналов проводилась посредством 5,25% раствора гипохлорита натрия и ультразвуковой активации. После размещения промежуточной эндодонтической повязки с ненасыщенным гидроксидом кальция зуб в дальнейшем был восстановлен с помощью композитной реставрации. Для минимизации эффекта микроподтекания между визитами зуб закрывали тефлоновой лентой.
Фото 5. Последовательность файлов HyFlex EDM.
Разработка каналов до размера файла 60/02
В ходе второго визита было отмечено, что у пациента продолжает присутствовать свищевой ход, однако припухлость уже почти полностью прошла (фото 6). Зуб снова изолировали посредством коффердама, после чего провели обработку системы медиальных каналов до 50/03, а дистального – до 60/02. Медикаментозная обработка канала выполнялась посредством гипохлорита натрия и лимонной кислотой (40%). Поскольку после высушивания никаких выделений из эндопространства не отмечалась, мезиальные каналы были обтурированы биокерамикой. Дистальный же канал заполнили пробкой из МТА. Сверху зуб перекрыли композитной реставрацией (фото 7). Через три месяца было отмечено отсутствие свищевого хода, а рентгенограмма подтверждала заживления периапикального участка (фото 8-9).
Фото 6. Заживления свищевого хода.
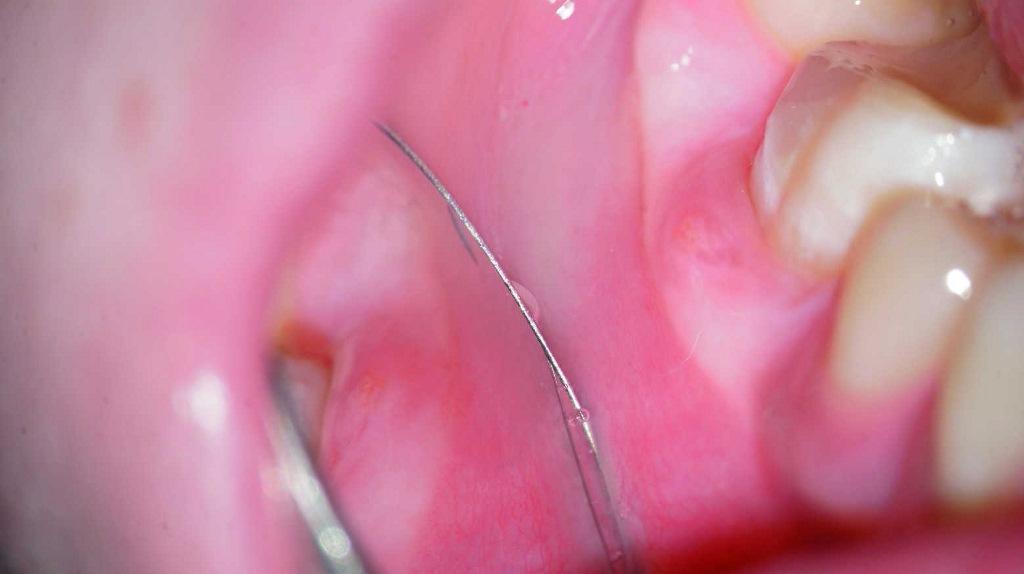
Фото 7. Контроль качества обтурации.
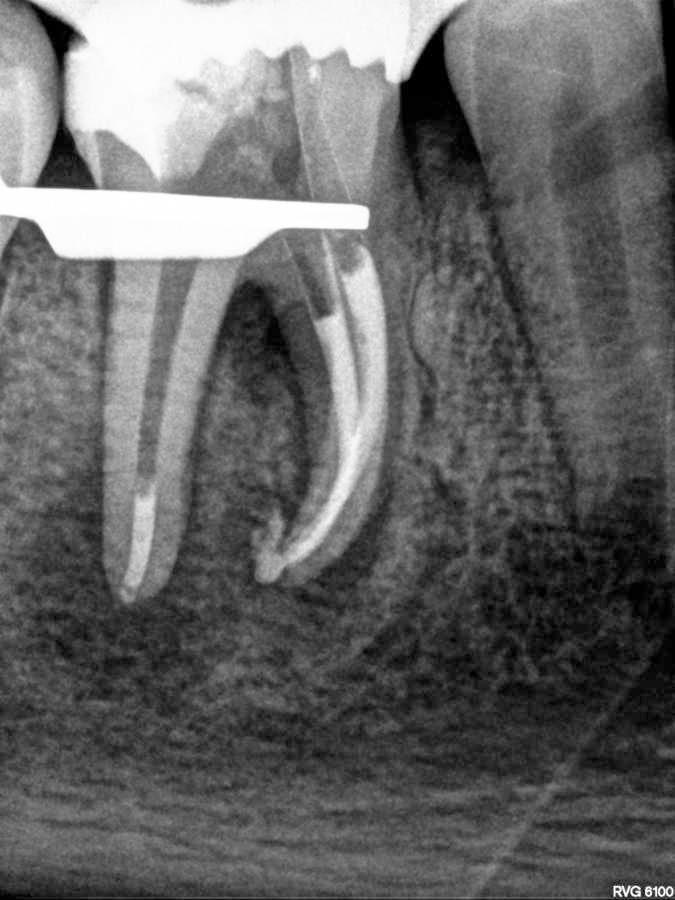
Фото 8. Рентгенограмма через 3 месяца.
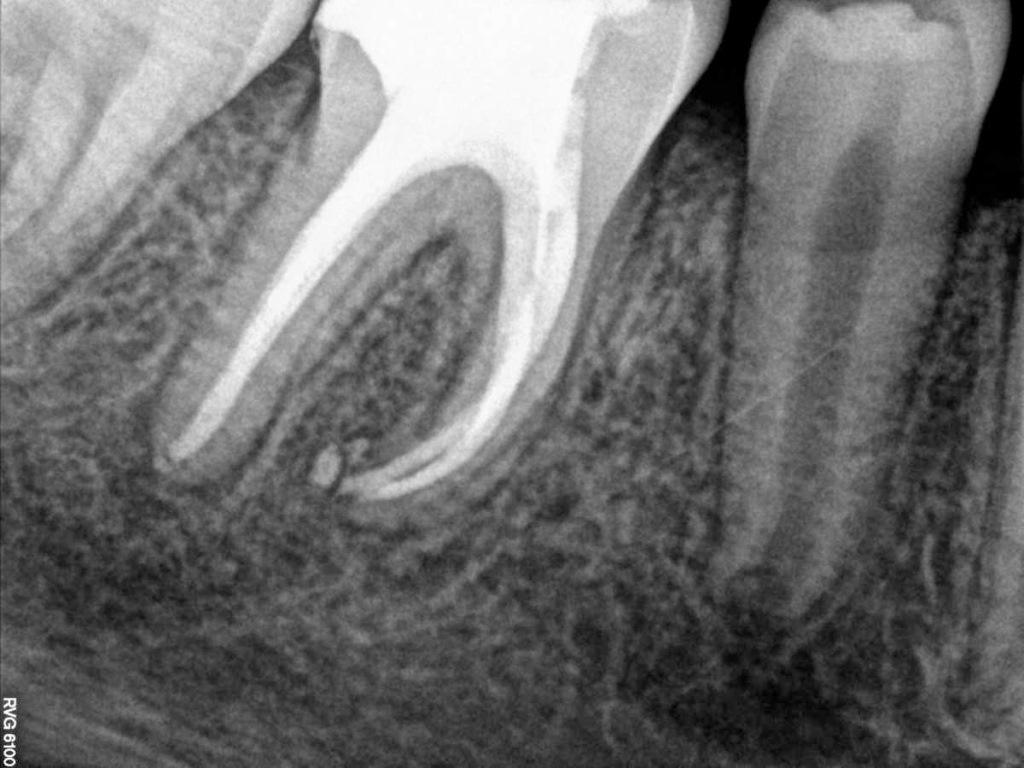
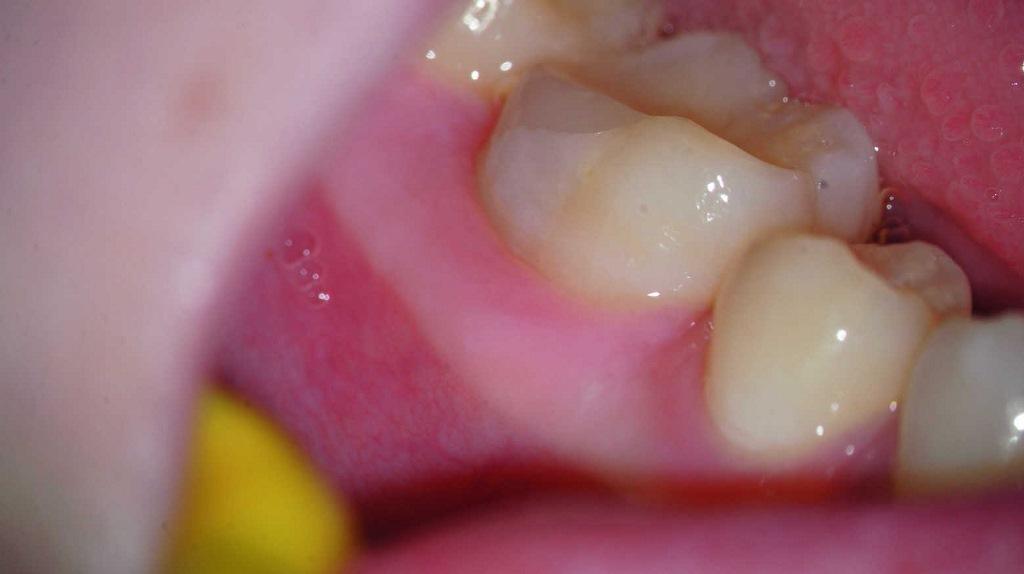
Фото 9. Клинический вид зуба через 3 месяца.
При этом врач всегда должен помнить об основных параметрах, которые аргументируют целесообразность проведения экстракции вместо эндодонтического лечения:
- сомнения относительно успешности эндолечения со стороны стоматолога, который направил пациента;
- большой по площади участок поражения на полученной рентгенограмме;
- отсутствие признаков заживления свищевого хода после установки повязки из кальция гидроксида;
- компрометированный исходный пародонтальный статус;
- учет ассоциированных с возрастом особенностей клинического алгоритма эндодонтического лечения.
Радиографический успех – это все?
Учитывая исследования, упомянутые в этой статье, представленный случай показывает, что предрассудки и субъективная диагностика не должны мешать нам проводить эндодонтическое лечения даже в случаях большого апикального поражения. При осознанном согласии и правильной мотивации со стороны пациента терапия корневых каналов всегда должна быть первым вариантом выбора ятрогенного вмешательства. Хотя обычная 2-D визуализация, которая используется для ранней диагностики, может скрывать наличие затяжного апикального периодонтита, однако КЛКТ позволяет объективизировать все необходимые параметры периапикального очага поражения. При этом, ни двухмерные, ни трехмерные методы диагностики не позволяют дифференцировать разницы между рубцовой тканью в области «заживающего» апекса и инфекционным процессом в области пораженного апекса при отсутствии соответствующих клинических симптомов. Исходя из этого, успех на рентгенограмме - это не всегда успех клинический.
Заключение
Объединение нескольких инструментов визуализации помогает эндодонтистам поставить правильный диагноз и выбрать наиболее подходящий для каждого отдельного клинического случая алгоритм лечения. С помощью современных систем NiTi-файлов можно эффективно проводить обработку корневых каналов даже с очень изогнутой морфологией. В конечном счете, все это способствует тому, что те зубы, которые были категоризированы как безуспешные и планировались на удаление, оказывается, еще можно полечить, если правильно подойти к этапам диагностики и планирования.
Автор: Dr Christophe Verbanck (Бельгия)
В прошлой статье была рассмотрена общая характеристика апикального периодонтита и более углублено особенности течения острого апикального периодонтита. В этой статье мы подробно рассмотрим хронический апикальный периодонтит, клинику, диагностику и особенности лечения. А также коснемся особенностей клиники и лечения травматического и медикаментозного периодонтитов.
Вспомним классификацию. Согласно некоторым классификациям, апикальные периодонтиты бывают:
Классификация МКБ – 10
К 04.4 Острый апикальный периодонтит пульпарного происхождения
К 04.5 Хронический апикальный перодонтит
К 04.6 Периапикальный абсцесс со свищём
- Дентальный
- Дентоальвеолярный
- Периодонтальный абсцесс пульпарного происхождения
К 04.60 Имеющий сообщение с ВЧ пазухой
К 04.61 Имеющий сообщение с полостью носа
К 04.62 Имеющий сообщение с полостью рта
К 04. 63 Имеющий сообщение с кожей
К 04.69 Периапикальный абсцесс со свищём неуточненный
К 04.7 Периапикальный абсцесс без свища
- Дентальный
- Дентоальвеолярный
- Периодонтальный абсцесс пульпарного происхождения
- Периапикальный абсцесс без свища неуточненный
К 04.8 Корневая киста
К 04.89 Корневая киста неуточненная
К 04.9 Другие неуточненные заболевания пульпы и периапикальный тканей
Классификация периодонтитов по И. Г. Лукомскому
- Острые периодонтиты
- Серозный
- Гнойный
- Хронические периодонтиты
- Фиброзный
- Гранулирующий
- Гранулематозный
- Обострение хронического периодонтита
Хронический апикальный периодонтит
Хронический апикальный периодонтит – чаще всего бессимптомное воспаление в тканях апикального периодонта, которое проявляется рентгенологическими изменениями на верхушках корней зуба.
Многие стоматологи используют клинически удобную классификацию И. Г. Лукомского. Она упрощает постановку диагноза.
Хронический фиброзный периодонтит
Возникает как исход острого периодонтита или излечение гранулирующего и гранулематозного периодонтитов. Имеет значение и травматическая этиология из-за перегрузки, которая наступает при утрате большого количества зубов или нефизиологической артикуляции.
Хронический фиброзный периодонтит выявляется на рентген-снимке как расширение периодонтальной щели в области апекса и почти никогда не сопровождается деструкцией прилежащей кости.

Хронический гранулирующий периодонтит
Является наиболее активной формой среди всех хронических периодонтитов, является исходом острого процесса.
Пациент жалуется на неприятные, слегка болезненные ощущения при накусывании на причинный зуб.
Внешне пациент выглядит как обычно, иногда имеются увеличение поднижнечелюстных лимфатических узлов. В ротовой полости видим гиперемированную слизистую в области зуба, болезненную при пальпации. Отличительной чертой этого вида периодонтита является наличие свища в проекции верхушки корня. Из него может выделяться гной или выбухать грануляции. Молодая грануляционная ткань прорастает через поврежденный цемент или даже дентин в костномозговые пространства, нередко растет по стенкам свищевого хода. Зуб разрушен или интактен. Перкуссия слабоположительная.
На рентгенограмме видим очаг просветления вследствие деструкции кости в области верхушки корня. Очаг имеет нечеткие контуры, бывает разных размеров.

Хронический гранулематозный периодонтит
Этот вид периодонтита протекает бессимптомно, проявляется клинически только при обострениях. Эти проявления могут быть по типу гранулирующего периодонтита в виде свищей и гиперемии слизистой.
Отличие гранулематозного периодонтита от гранулирующего состоит в наличии на рентгенограмме очага просветления на верхушках корней четкой округлой формы (апикальная гранулема).
В настоящее время врачи отходят от градации размеров очага (0,5 см-гранулема, 0,6-0,8 см-кистогранулема, более 0,8 см-радикулярная киста.

Киста-что это и почему
Киста — это полость, которая имеет эпителиальную выстилку и кистозное содержимое. Существует две разновидности кист- истинная и карманная.
Истинная полностью закрыта эпителиальной выстилкой, а карманная сообщается с корневым каналом, она как бы растёт из него.
Формирование кисты происходит в 3 этапа.
На первом этапе вероятнее всего эпителиальные клетки островков Малассе пролиферируют под воздействием факторов роста.
Во время второго этапа образуется эпителиальная полость.
Эти эпителиальные клетки направляются от своего источника питания, гибнут, нейтрофилы тянут их остатки в область некроза. Формируются микрополости, которые затем сливаются в одну и становятся ограниченными многослойным плоским эпителием.
Существует и другая теория- теория о закрытии эпителием всех открытых соединительнотканный участков, в следствие некроз.
На третьей стадии формирования кисты после гибели нейтрофилов, имеются запасы простагландинов, а также цитокины, вырабатываемые макрофагами и Т лимфоцитами. Вместе они активируют остеокласты и запускают резорбцию кости.
Карманные кисты имеют иной механизм развития. Около апикального отверстия наблюдается большое скопление нейтрофилов в ответ на инфекцию корневого канала. Клетки, как и раньше, гибнут, и этот микроабсцесс закрывается пролиферирующим эпителием. Образуется, так называемое, эпителиальное кольцо. Нейтрофилы, которые остались за пределами канала, погибая, формируют микрополость. Присутствие инфекции за пределами канала ещё больше притягивает нейтрофилов, расширяя микрополость до больших размеров. Карманная киста называется таковой из-за подобия расширения корневого канала увеличению периодонтального кармана.


Травматический периодонтит
Травма периодонта – один из инициирующих факторов возникновения кровоизлияния и развития ишемии, которая напрямую ведет к образованию некроза пульпы. Очаг некроза притягивает к себе бактерии, колонизирует их и инфицирует периодонт. С ростом количества микроорганизмов начинается острое воспаление. Развивается травматический периодонтит.
При хронической длительной травме перестройка периодонта происходит постепенно, сначала в силу своей адаптации, затем как хроническое воспаление с лакунарной резорбцией компактной пластинки.
Основной причиной развития патологии является воспалительный ответ. Вследствие окклюзионной травмы в пульпе вырабатываются медиаторы воспаления, их считают защитной реакцией на механическую агрессию. Они нарушают микроциркуляцию и повышают проницаемость сосудов. Пульпа погибает.
Когда некроз пульпы достигает апикальный периодонт, из-за своего цитотоксического действия интерлейкинами, активирует остеокласты и резорбцию кости.
Медикаментозный периодонтит
Медикаментозный периодонтит развивается при попадании в периодонт агрессивных жидкостей или лекарственных средств, таких как мышьяковистая паста, формалин, три крезол формалин, фенол. Проникновение в периодонт происходит через корневой канал.
Сюда же относится периодонтит, развивающийся в ответ на выведение в периодонт при лечении пульпита фосфат-цемента, резорцин-формалиновой пасты, штифтов и других пломбировочных материалов. К медикаментозному периодонтиту относят и периодонтит по причине аллергии в результате применения препаратов, способных вызвать местный иммунный ответ (антибиотики, эвгенол и др.).

Инородные тела
Гуттаперча, бумажные пины, остатки кальция и другие самые разнообразные вещи можно встретить в периапикальных тканях.
Апикальный периодонт всегда реагирует на инородные тела. Они могут попасть через корневой канал, через травмированную слизистую оболочку или периодонтальный карман.
В случае проникновение бумажного пина, следует помнить, что человеческий организм не умеет перерабатывать целлюлозу, поэтому инородное тело окружает бактериальная бляшка, которая поддерживает воспаление.
Гуттаперча — биосовместимый материал. Однако, в тоже время может давать реакцию со стороны верхушечного периодонта. В исследованиях на морских свинках показано, что большие частицы гуттаперчи инкапсулируются, их окружают коллагеновые волокна, а мелкие частицы поддерживают локальную тканевую реакцию. А магний и кремний, которые содержатся в избытке гуттаперчи, способны вызывать резорбцию.

Диагностика хронического апикального периодонтита
Диагностика хронического апикального периодонтита сходна с таковой в случае острого апикального периодонтита. А значит используем основные, дополнительные методы диагностики.
К основным относят выяснение жалоб пациента, анамнеза, зондирование, перкуссия, пальпация и определение подвижности зуба.
Жалобы пациента чаще всего отсутствуют, но могут жаловаться на неприятные ощущения во время еды при накусывании.
Зондирвоание безболезненное, пальпацмя слизистой в области верхушки также безболезненная. Перкуссия слабоположительная.
К дополнительным специальным методам относят определение электровозбудимости пульпы (снижена до 200мкА), определение окклюзии (наличие или отсутствие травмирующего фактора), свищевого хода, температурные тесты.
NB! Обязательно проводим рентгенологическое исследование.

Лечение хронического апикального периодонтита, травматического и медикаментозного периодонтитов
После диагностики приступают к составлению плана лечения хронического апикального периодонтита, основываясь на данных клинической и рентгенологической картин.
Лечение травматического периодонтита начинают с выявления и устранения травмирующего фактора.
Лечение медикаментозного периодонтита заключается в антисептической обработки системы корневых каналов, перепломбировке при выявлении инородного тела в апикальном периодонте. При воздействии агрессивных жидкостей за пределами апекса, на устья кладут ватный шарик или помещают ватную турунду в канал, смоченную антидотом (например, для мышьяковистого ангидрида антидотом является 5% р-р унитиола или 2-3% настойка йода). При мышьяковистых периодонтитах наблюдается болевой синдром при накусывании на зуб, со стороны слизистой редко бывают патологические изменения.
При выведении гипохлорита натрия за верхушку наблюдается резкая распирающая боль, кровоподтеки, отек на стороне поражения. Корневые каналы обильно промывают физраствором, область верхушки корня обкалывают физраствором количеством, превышающим объем гипохлорита в 10 раз. К пломбировке приступают в следующее посещение при отсутствии прогрессирования патологического процесса.
Назначают антибиотики, противовоспалительные и антигистаминные препараты.
Общим среди лечения у всех видов апикальных периодонтитов является эндодонтическое лечение причинного зуба.
- Издательство «Медиа Сфера»
- Об издательстве
- Рекламодателям
- Доставка / Оплата
- Контакты
Азербайджанский медицинский университет Минздрава Азербайджанской Республики, Баку, Азербайджан
Азербайджанский медицинский университет, Баку, Азербайджан
Клинико-рентгенологическое обоснование эндодонтического лечения постоянных зубов с периапикальной деструкцией
Журнал: Стоматология. 2020;99(1): 33-37
Ахмедбейли Р. М., Мамедзаде Р. Э. Клинико-рентгенологическое обоснование эндодонтического лечения постоянных зубов с периапикальной деструкцией. Стоматология. 2020;99(1):33-37. https://doi.org/10.17116/stomat20209901133
Азербайджанский медицинский университет Минздрава Азербайджанской Республики, Баку, Азербайджан





В ходе настоящего исследования были апробированны четыре схемы эндодонтического лечения и определена наиболее эффективная схема лечения с применением временной лечебной пасты на основе кальция гидроксида три раза с интервалом по ٧—14 дней с последующей долгосрочной временной обтурацией кальций гидроксида с йодоформом, ультразвуковой активации гипохлорита натрия в корневом канале, гидродинамической ирригации и диодного лазера. В наиболее эффективной схеме за весь период лечения наблюдалось уменьшение размера дефекта на 2,57±0,17 мм (p>0,001) и снижение показания индекса PAI на 1,٨٤ балла (p>٠,٠٠1). На основании данных денситометрии определено, что применение гидроксида кальция с йодоформом в схеме лечения приводит к улучшению репарации костной ткани в периапикальной зоне на ٢,٢—4,2%. Наибольшее и полное ингибирование микроорганизмов определено у пациентов первой и третьей опытной группы, в которых был использован диодный лазер. Применение диодного лазера при эндодонтическом лечении зубов с периапикальной деструкцией усиливает антибактериальную активность и способствует полному ингибированию исследованной патогенной микрофлоры в корневых каналах.
Азербайджанский медицинский университет Минздрава Азербайджанской Республики, Баку, Азербайджан
Азербайджанский медицинский университет, Баку, Азербайджан
Среди наиболее сложных и трудоемких вопросов практической стоматологии проблема лечения зубов с периапикальной деструкцией занимает ведущее место. Это объясняется рядом причин, прежде всего распространенностью процесса и сложностью лечения [1–4]. По данным этих авторов, из общего числа обратившихся в стоматологические учреждения больные с различными формами хронического периодонтита составляют от 15 до 30%, а в 50% случаев деструктивные формы периодонтита являются причиной удаления зубов. Кроме того, очаги воспаления в периодонте являются источником сенсибилизации организма [5]. В 65,3% случаев зубы, явившиеся источником инфекции при развитии острого воспалительного процесса, ранее подвергались эндодонтическому лечению [6,7]. Хронический периодонтит в 85–98% случаев также является причиной таких острых воспалительных процессов челюстно-лицевой области, как периоститы, абсцессы, флегмона, лимфадениты и остеомиелит челюстей [2,8].
Успех эндодонтического лечения зуба зависит от качества инструментальной и медикаментозной обработки сложной системы корневых каналов с последующей герметичной обтурацией, что предотвращает развитие микроорганизмов в корневом канале и поражение периодонтальных тканей при лечении пульпита и купирование воспалительного процесса при лечении заболеваний периодонта [9–11]. Вышеперечисленными причинами и объясняются социально-медицинская значимость проблемы и чрезвычайная актуальность постоянного поиска новых схем и методов для повышения эффективности эндодонтического лечения зубов с периапикальными деструктивными изменениями.
Цель данной работы — апробирование и оценка эффективности различных схем эндодонтического лечения постоянных зубов с апикальным пероидонтитом с деструкцией.
Материалы и методы
Были исследованы и подвергнуты лечению 124 зуба с диагнозом «хронический апикальный периодонтит» с периапикальной деструкцией размером от 1,8 мм до 5,9 мм, разделенных на четыре группы (три опытные и одна контрольная) по 31 в каждой. Среди обследуемых пациентов было 81 (65,3%) женщина и 43 (34,7%) мужчины в возрасте от 14 до 78 лет. Вылеченных зубов на нижней челюсти было 75 (60,5%), а на верхней челюсти — 49 (39,5%).
В первой группе применялась временная лечебная паста на основе кальций гидроксида три раза с интервалом по 7–14 дней, ультразвуковая активация гипохлорита натрия, гидродинамическая ирригация и диодный лазер. Во второй группе — временная лечебная паста на основе кальция гидроксида три раза с интервалом по 7–14 дней с последующей долгосрочной временной обтурацией пастой на основе кальция гидроксида с йодоформом, ультразвуковая активация гипохлорита натрия, гидродинамическая ирригация. В третьей группе — временная лечебная паста на основе кальция гидроксида три раза с интервалом по 7–14 дней с последующей долгосрочной временной обтурацией кальций гидроксида с йодоформом, ультразвуковая активация гипохлорита натрия в корневом канале, гидродинамическая ирригация и диодный лазер. В контрольной группе применялась временная лечебная паста на основе кальция гидроксида три раза с интервалом по 7–14 дней и ультразвуковой активации гипохлорита натрия.
Микробиологическое исследование микрофлоры корневого канала проводилось методом полимеразной цепной реакции (ПЦР) в режиме реального времени. Забор материала проводили до лечения и непосредственно перед постоянным заполнением корневого канала в сорока зубах. Исследовались следующие виды анаэробной микрофлоры и грибков: Porphyromonas endotondalis; Porphyromonas gingivalis; Aggregatibacter actinomycetemcomitans; Treponema denticola; Tannerella forsythia; Prevotella intermedia; Fusobacterium nucleatum; Enterococcus faecalis, E. faecium; Streptococcus spp.; Candida albicans; Candida crusei; Candida glabrata. Протокол забора материала из корневого канала для ПЦР анализа проводился согласно протоколу Экспертного совета Университета штата Коннектикут «Центр здоровья» [12].
Измерение размера периапикальной деструкции проводилось посредством программы «Measure length» оперативной системы Sidexis (Sirona, Germany). С помощью электронной линейки проводились измерения по горизонтальной и вертикальной линиям по центру дефекта и по полученным цифровым данным вычислялось среднее значение, которое и характеризовало состояние очага деструкции в периапикальной области, а также восстановление костной ткани в очаге деструкции в процессе и после лечения (рис. 1).

Рис. 1. Оптическая денситометрия периапикальной области.
Оптическую денситометрию периапикальных тканей проводили до лечения и непосредственно перед постоянной обтурацией корневых каналов на основании данных цифрового интраорального рентгенологического исследования. Оптическая денситометрия проведена на 124 зубах.
Оценку состояния периапикальных тканей проводили посредством периапикального индекса (periapical index, PAI) у 124 зубов на основе радиовизиографических рентгеновских снимков. Оценку проводили перед лечением, непосредственно перед постоянным заполнением корневого канала и через 6, 12, 24, 36–60 месяцев после обтурации.
В целях статистической обработки данных был применен непараметрический метод оценки различий показателей — U-критерий Манна-Уитни-Уилкоксона. Статистическое различие между группами считалось достоверным при значении p 0,001). Во второй опытной группе лечебные мероприятия привели к уменьшению размера дефекта на 2,36±0,16 мм (р>0,001). В третьей опытной группе произошло уменьшения размера дефекта на 2,57±0,17 мм (р>0,001). В контрольной группе апробированная схема лечения привела к уменьшению размера дефекта на 1,65±0,18 мм (р>0,001) (таблица).

Таблица 1. Динамика периапикальных деструктивных изменений по показателям среднего размера дефекта
Исходные показатели размера дефектов в кости до начала лечения не имели статистических различий по группам, однако после лечения полученные аналогичные показатели имели статистические различия по всем группам (р 
Рис. 2. Показатели оптической денситометрии кости в периапикальной области.
Анализ данных оптической денситометрии по состоянию околоверхушечной кости зубов, подвергнутых эндодонтическому лечению по различным схемам, определил наилучшую динамику репарации периапикальных тканей в третьей опытной группе зубов (p 0,05), а применение апробированной схемы лечения во второй опытной группе — к уменьшению PAI на 3,19 балла (р>0,05). Применение апробированной схемы лечения в третьей опытной группе привело к уменьшению PAI на 2,97 балла (р>0,05). В контрольной группе произошло снижение PAI на 2,87 балла (р>0,05) (рис. 3).

Рис. 3. Показатели PAI. Таким образом, наилучшая динамика репарации пораженных околоверхушечных тканей определена во второй и третьей опытных группах, а наименьшая — в контрольной группе исследования.
Все схемы лечения, апробированные во всех четырех группах, показали высокую антимикробную активность. Наибольшее подавление роста микроорганизмов определено у пациентов первой и третьей опытной групп. Схемы лечения во второй опытной и контрольной группах, которые не предусматривали применение диодного лазера, были антимикробиологически менее активны. Применение диодного лазера при эндодонтическом лечении зубов с периапикальной деструкцией усиливает антибактериальную активность и способствует полному ингибированию исследованной патогенной микрофлоры в корневых каналах.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interests.
- Издательство «Медиа Сфера»
- Об издательстве
- Рекламодателям
- Доставка / Оплата
- Контакты
Азербайджанский медицинский университет Минздрава Азербайджанской Республики, Баку, Азербайджан
Азербайджанский медицинский университет, Баку, Азербайджан
Клинико-рентгенологическое обоснование эндодонтического лечения постоянных зубов с периапикальной деструкцией
Журнал: Стоматология. 2020;99(1): 33-37
Ахмедбейли Р. М., Мамедзаде Р. Э. Клинико-рентгенологическое обоснование эндодонтического лечения постоянных зубов с периапикальной деструкцией. Стоматология. 2020;99(1):33-37. https://doi.org/10.17116/stomat20209901133
Азербайджанский медицинский университет Минздрава Азербайджанской Республики, Баку, Азербайджан





В ходе настоящего исследования были апробированны четыре схемы эндодонтического лечения и определена наиболее эффективная схема лечения с применением временной лечебной пасты на основе кальция гидроксида три раза с интервалом по ٧—14 дней с последующей долгосрочной временной обтурацией кальций гидроксида с йодоформом, ультразвуковой активации гипохлорита натрия в корневом канале, гидродинамической ирригации и диодного лазера. В наиболее эффективной схеме за весь период лечения наблюдалось уменьшение размера дефекта на 2,57±0,17 мм (p>0,001) и снижение показания индекса PAI на 1,٨٤ балла (p>٠,٠٠1). На основании данных денситометрии определено, что применение гидроксида кальция с йодоформом в схеме лечения приводит к улучшению репарации костной ткани в периапикальной зоне на ٢,٢—4,2%. Наибольшее и полное ингибирование микроорганизмов определено у пациентов первой и третьей опытной группы, в которых был использован диодный лазер. Применение диодного лазера при эндодонтическом лечении зубов с периапикальной деструкцией усиливает антибактериальную активность и способствует полному ингибированию исследованной патогенной микрофлоры в корневых каналах.
Азербайджанский медицинский университет Минздрава Азербайджанской Республики, Баку, Азербайджан
Азербайджанский медицинский университет, Баку, Азербайджан
Среди наиболее сложных и трудоемких вопросов практической стоматологии проблема лечения зубов с периапикальной деструкцией занимает ведущее место. Это объясняется рядом причин, прежде всего распространенностью процесса и сложностью лечения [1–4]. По данным этих авторов, из общего числа обратившихся в стоматологические учреждения больные с различными формами хронического периодонтита составляют от 15 до 30%, а в 50% случаев деструктивные формы периодонтита являются причиной удаления зубов. Кроме того, очаги воспаления в периодонте являются источником сенсибилизации организма [5]. В 65,3% случаев зубы, явившиеся источником инфекции при развитии острого воспалительного процесса, ранее подвергались эндодонтическому лечению [6,7]. Хронический периодонтит в 85–98% случаев также является причиной таких острых воспалительных процессов челюстно-лицевой области, как периоститы, абсцессы, флегмона, лимфадениты и остеомиелит челюстей [2,8].
Успех эндодонтического лечения зуба зависит от качества инструментальной и медикаментозной обработки сложной системы корневых каналов с последующей герметичной обтурацией, что предотвращает развитие микроорганизмов в корневом канале и поражение периодонтальных тканей при лечении пульпита и купирование воспалительного процесса при лечении заболеваний периодонта [9–11]. Вышеперечисленными причинами и объясняются социально-медицинская значимость проблемы и чрезвычайная актуальность постоянного поиска новых схем и методов для повышения эффективности эндодонтического лечения зубов с периапикальными деструктивными изменениями.
Цель данной работы — апробирование и оценка эффективности различных схем эндодонтического лечения постоянных зубов с апикальным пероидонтитом с деструкцией.
Материалы и методы
Были исследованы и подвергнуты лечению 124 зуба с диагнозом «хронический апикальный периодонтит» с периапикальной деструкцией размером от 1,8 мм до 5,9 мм, разделенных на четыре группы (три опытные и одна контрольная) по 31 в каждой. Среди обследуемых пациентов было 81 (65,3%) женщина и 43 (34,7%) мужчины в возрасте от 14 до 78 лет. Вылеченных зубов на нижней челюсти было 75 (60,5%), а на верхней челюсти — 49 (39,5%).
В первой группе применялась временная лечебная паста на основе кальций гидроксида три раза с интервалом по 7–14 дней, ультразвуковая активация гипохлорита натрия, гидродинамическая ирригация и диодный лазер. Во второй группе — временная лечебная паста на основе кальция гидроксида три раза с интервалом по 7–14 дней с последующей долгосрочной временной обтурацией пастой на основе кальция гидроксида с йодоформом, ультразвуковая активация гипохлорита натрия, гидродинамическая ирригация. В третьей группе — временная лечебная паста на основе кальция гидроксида три раза с интервалом по 7–14 дней с последующей долгосрочной временной обтурацией кальций гидроксида с йодоформом, ультразвуковая активация гипохлорита натрия в корневом канале, гидродинамическая ирригация и диодный лазер. В контрольной группе применялась временная лечебная паста на основе кальция гидроксида три раза с интервалом по 7–14 дней и ультразвуковой активации гипохлорита натрия.
Микробиологическое исследование микрофлоры корневого канала проводилось методом полимеразной цепной реакции (ПЦР) в режиме реального времени. Забор материала проводили до лечения и непосредственно перед постоянным заполнением корневого канала в сорока зубах. Исследовались следующие виды анаэробной микрофлоры и грибков: Porphyromonas endotondalis; Porphyromonas gingivalis; Aggregatibacter actinomycetemcomitans; Treponema denticola; Tannerella forsythia; Prevotella intermedia; Fusobacterium nucleatum; Enterococcus faecalis, E. faecium; Streptococcus spp.; Candida albicans; Candida crusei; Candida glabrata. Протокол забора материала из корневого канала для ПЦР анализа проводился согласно протоколу Экспертного совета Университета штата Коннектикут «Центр здоровья» [12].
Измерение размера периапикальной деструкции проводилось посредством программы «Measure length» оперативной системы Sidexis (Sirona, Germany). С помощью электронной линейки проводились измерения по горизонтальной и вертикальной линиям по центру дефекта и по полученным цифровым данным вычислялось среднее значение, которое и характеризовало состояние очага деструкции в периапикальной области, а также восстановление костной ткани в очаге деструкции в процессе и после лечения (рис. 1).

Рис. 1. Оптическая денситометрия периапикальной области.
Оптическую денситометрию периапикальных тканей проводили до лечения и непосредственно перед постоянной обтурацией корневых каналов на основании данных цифрового интраорального рентгенологического исследования. Оптическая денситометрия проведена на 124 зубах.
Оценку состояния периапикальных тканей проводили посредством периапикального индекса (periapical index, PAI) у 124 зубов на основе радиовизиографических рентгеновских снимков. Оценку проводили перед лечением, непосредственно перед постоянным заполнением корневого канала и через 6, 12, 24, 36–60 месяцев после обтурации.
В целях статистической обработки данных был применен непараметрический метод оценки различий показателей — U-критерий Манна-Уитни-Уилкоксона. Статистическое различие между группами считалось достоверным при значении p 0,001). Во второй опытной группе лечебные мероприятия привели к уменьшению размера дефекта на 2,36±0,16 мм (р>0,001). В третьей опытной группе произошло уменьшения размера дефекта на 2,57±0,17 мм (р>0,001). В контрольной группе апробированная схема лечения привела к уменьшению размера дефекта на 1,65±0,18 мм (р>0,001) (таблица).

Таблица 1. Динамика периапикальных деструктивных изменений по показателям среднего размера дефекта
Исходные показатели размера дефектов в кости до начала лечения не имели статистических различий по группам, однако после лечения полученные аналогичные показатели имели статистические различия по всем группам (р 
Рис. 2. Показатели оптической денситометрии кости в периапикальной области.
Анализ данных оптической денситометрии по состоянию околоверхушечной кости зубов, подвергнутых эндодонтическому лечению по различным схемам, определил наилучшую динамику репарации периапикальных тканей в третьей опытной группе зубов (p 0,05), а применение апробированной схемы лечения во второй опытной группе — к уменьшению PAI на 3,19 балла (р>0,05). Применение апробированной схемы лечения в третьей опытной группе привело к уменьшению PAI на 2,97 балла (р>0,05). В контрольной группе произошло снижение PAI на 2,87 балла (р>0,05) (рис. 3).

Рис. 3. Показатели PAI. Таким образом, наилучшая динамика репарации пораженных околоверхушечных тканей определена во второй и третьей опытных группах, а наименьшая — в контрольной группе исследования.
Все схемы лечения, апробированные во всех четырех группах, показали высокую антимикробную активность. Наибольшее подавление роста микроорганизмов определено у пациентов первой и третьей опытной групп. Схемы лечения во второй опытной и контрольной группах, которые не предусматривали применение диодного лазера, были антимикробиологически менее активны. Применение диодного лазера при эндодонтическом лечении зубов с периапикальной деструкцией усиливает антибактериальную активность и способствует полному ингибированию исследованной патогенной микрофлоры в корневых каналах.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interests.
Читайте также:

