Миелоз красной пульпы что это
Опубликовано: 02.05.2024
Диагноз хронического миелолейкоза (ХМЛ) в большинстве случаев установить или, во всяком случае, заподозрить нетрудно по характерным изменениям картины крови. Эти изменения выражаются в постепенно нарастающем лейкоцитозе, небольшом в начале заболевания (10— 15 • 10 9 /л) и достигающем по мере течения болезни без лечения огромных цифр — 200—500—800 • 10 9 /л и даже более.
Одновременно с нарастанием числа лейкоцитов отмечаются характерные изменения лейкоцитарной формулы: увеличение содержания гранулоцитов до 85—95 %, наличие незрелых гранулоцитов — миелоцитов, метамиелоцитов, при значительном лейкоцитозе — нередко промиелоцитов, а иногда единичных бластных клеток. Очень характерно увеличение содержания базофилов до 5—10 %, нередко с одновременным повышением уровня эозинофилов до 5—8 % («эозинофильно-базофильная ассоциация», не встречающаяся при других заболеваниях) и уменьшением числа лимфоцитов до 10—5 %.
Иногда количество базофилов достигает значительных цифр— 15—20 % и более.
В литературе 15—20-летней давности в таких случаях заболевание обозначалось как базофильный вариант хронического миелолейкоза, который встречается у 5—8 % больных. Описан эозинофиль-ный вариант, при котором в крови постоянно 20— 40 % эозинофилов. В настоящее время эти варианты не выделяют, а увеличение числа базофилов или эозинофилов рассматривается как признак продвинутой стадии болезни.
У большинства больных увеличено количество тромбоцитов до 400—600 • 10 9 /л, а иногда и более — до 800—1000 • 10 9 /л, редко — еще выше. Содержание гемоглобина и эритроцитов может долго оставаться нормальным, снижаясь только при очень высоком лейкоцитозе. У некоторых больных в начале заболевания наблюдается даже небольшой эритроцитоз — 5,0-5,5•10 12 л.
Исследование костно-мозгового пунктата обнаруживает увеличение числа миелокариоцитов и процента незрелых гранулоцитов с увеличением миелоидно/эритроидного соотношения до 20—25/1 вместо нормального 3—4/1. Обычно увеличено количество базофилов и эозинофилов, особенно у больных с высоким содержанием этих клеток в крови. Как правило, отмечается большое количество фигур митоза.
У некоторых больных, чаще при значительном гиперлейкоцитозе, в костно-мозговом пунктате обнаруживаются голубые гистиоциты и клетки, напоминающие клетки Гоше. Это макрофаги, захватывающие глюкоцереброзиды из распадающихся лейкоцитов. Число мегакариоцитов обычно увеличено, как правило, они имеют признаки дисплазии.
При морфологическом исследовании не обнаруживается каких-либо изменений в строении клеток гранулоцитарного ряда при ХМЛ по сравнению с нормальными, однако при электронной микроскопии выявляется асинхронизм в созревании ядра и цитоплазмы: на каждом этапе созревания гранулоцита ядро отстает в своем развитии от цитоплазмы.
Из цитохимических особенностей очень характерно резкое снижение или полное исчезновение щелочной фосфатазы в нейтрофилах крови и костного мозга.

При трепанобиопсии обнаруживаются выраженная гиперплазия миелоидного ростка, резкое уменьшение содержания жира, у 20—30 % больных уже в начале заболевания — та или иная степень миелофиброза.
Морфологическое исследование селезенки обнаруживает инфильтрацию красной пульпы лейкемическими клетками.
Из биохимических изменений характерным является увеличение содержания витамина В12 в сыворотке крови, которое превышает нормальное иногда в 10—15 раз и нередко остается повышенным при клинико-гематологической ремиссии. Другое существенное изменение — увеличение содержания мочевой кислоты. Оно оказывается высоким практически у всех нелеченых больных при значительном лейкоцитозе и может повышаться еще больше при проведении цитостатической терапии.
У некоторых больных постоянное повышение уровня мочевой кислоты приводит к образованию уратовых мочевых камней и подагрических артритов, отложению кристаллов мочевой кислоты в тканях ушных раковин с образованием видимых узелков. У подавляющего числа больных отмечается высокий уровень лактатдегидрогеназы сыворотки.
Начало заболевания в большинстве случаев почти или совсем бессимптомно. Обычно при уже появившихся изменениях крови селезенка не увеличена. По мере развития болезни она прогрессивно увеличивается, иногда достигая огромных размеров. Лейкоцитоз и размеры селезенки не всегда коррелируют между собой. У некоторых больных селезенка занимает всю левую половину живота, спускаясь в малый таз, при лейкоцитозе 65—70 • 10 9 /л, у других больных с лейкоцитозом, достигающим 400—500 • 10 9 /л, селезенка выступает из-под края реберной дуги всего на 4—5 см. Большие размеры селезенки особенно характерны для ХМЛ с высокой базофилией.
При выраженной спленомегалии обычно увеличена и печень, но всегда в значительно меньшей степени, чем селезенка. Увеличение лимфатических узлов для ХМЛ не характерно, оно встречается иногда в терминальной стадии болезни и обусловлено инфильтрацией лимфатического узла бластными клетками.

Жалобы на слабость, чувство тяжести, иногда боли в левом подреберье, потливость, субфебрильную температуру появляются только при развернутой клинической и гематологической картине заболевания.
У 20—25 % больных ХМЛ выявляется случайно, когда еще нет клинических признаков болезни, а имеются лишь нерезко выраженные гематологические изменения (лейкоцитоз и небольшой процент незрелых гранулоцитов в крови), которые обнаруживают при анализе крови, сделанном по поводу другого заболевания или при профилактическом обследовании. Отсутствие жалоб и клинических симптомов иногда приводит к тому, что характерные, но умеренные изменения крови, к сожалению, не привлекают внимания врача, и истинное начало заболевания удается установить лишь ретроспективно при обращении больного с уже выраженной клинико-гематологической картиной болезни.
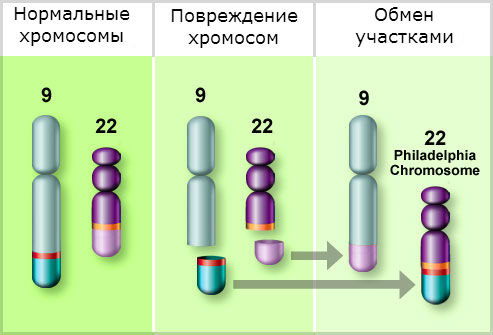
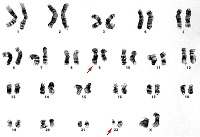
Подтверждением диагноза ХМЛ является обнаружение в клетках крови и костного мозга характерного цитогенетического маркера — Ph-хромосомы. Этот маркер имеется у всех больных ХМЛ и не встречается при других заболеваниях.
Хронический миелолейкоз — первое онкологическое заболевание, при котором у человека были описаны специфические изменения хромосом и расшифрованы молекулярные механизмы, лежащие в основе развития болезни.
В 1960 г. два цитогенетика из г. Филадельфии в США P. Nowell и D. Hungerford у всех обследованных ими больных ХМЛ обнаружили укорочение длинного плеча одной из, как они ошибочно считали, хромосом 21-й пары. По названию города, где было сделано открытие, эта хромосома была названа филадельфийской, или Ph-хромосомой. В 1970 г., используя более совершенную технику окрашивания хромосом, Т. Caspersson и соавт. установили, что при ХМЛ имеется делеция длинного плеча одной из хромосом, не 21-й, а 22-й пары. Наконец, в 1973 г. было сделано важнейшее открытие, ставшее отправной точкой в исследовании патогенеза ХМЛ: J. Rowley показала, что образование Ph-хромосомы обусловлено реципрокной транслокацией (взаимный обмен частью генетического материала) между хромосомами 9 и 22.
При такой транслокации происходит перенос большей части длинного плеча хромосомы 22 на длинное плечо хромосомы 9, а маленькой терминальной части длинного плеча хромосомы 9 — на хромосому 22. В результате возникает характерная цитогенетическая аномалия — удлинение длинного плеча одной из хромосом 9-й пары и укорочение длинного плеча одной из хромосом 22-й пары. Именно эта хромосома из 22-й пары с укороченным длинным плечом и обозначается как Ph-хромосома.
К настоящему времени установлено, что Ph-хромосома — t(9;22)(q34;q11) обнаруживается в 95— 100 % метафаз у 90-95 % больных ХМЛ. Примерно в 5 % случаев выявляются вариантные формы Ph-хромосомы. Чаще всего это сложные транслокации, вовлекающие хромосомы 9, 22 и какую-либо третью хромосому, а иногда добавочно 2 или 3 хромосомы. При сложных транслокациях всегда имеются такие же молекулярные изменения, как при стандартной t(9;22)(q34;q11). Стандартные и вариантные транслокации могут одновременно обнаруживаться у одного и того же больного в разных метафазах.

Иногда встречается так называемая маскированная транслокация с такими же, как при типичной, молекулярными изменениями, но не определяемая обычными цитогенетическими методами. Это обусловлено переносом меньших, чем при стандартной транслокации, участков хромосом. Описаны также случаи, когда при обычном цитогенетиче-ском исследовании не обнаруживается t(9; 22), однако методом FISH или RT-PCR (ПЦР в реальном времени) удается установить, что в типичном участке хромосомы 22 имеется стандартная для ХМЛ перестройка генов — образование химерного гена BCR-ABL. Исследования таких случаев показали, что иногда происходит перенос участка хромосомы 9 на хромосому 22, но отсутствует транслокация участка хромосомы 22 на хромосому 9.
В начальном периоде цитогенетического изучения хронического миелолейкоза выделяли два его варианта — Ph-позитивный и Ph-негативный. Впервые Ph-негативный ХМЛ описан S. Krauss и соавт. в 1964 г.. Авторы обнаружили Ph-негативный ХМЛ почти у половины больных, которых они наблюдали. В дальнейшем по мере совершенствования методов исследования доля Ph-негативного ХМЛ неуклонно сокращалась. В настоящее время признается, что истинного Ph-негативного (BCR-ABL-негативного) ХМЛ не существует, а описанные ранее наблюдения в большинстве случаев относились к BCR-ABL-позитивному ХМЛ, но с таким типом хромосомных перестроек, которые не могли быть выявлены известными в то время цитогенетическими методами.
Таким образом, полученные к настоящему времени данные позволяют считать, что во всех случаях ХМЛ существуют изменения хромосом 9 и 22 с одинаковой перестройкой генов в определенной области хромосомы 22. В тех случаях, когда характерных цитогенетических изменений не удается обнаружить, речь идет о других заболеваниях, похожих на ХМЛ по клиническим проявлениям (спленомегалия) и картине крови (гиперлейкоцитоз, нейтрофилез). Чаще всего это хронический миеломоноцитарный лейкоз (ХММЛ), который в классификации ВОЗ 2001 г. относится к болезням, имеющим как миелопролиферативные, так и миелодиспластические черты. При ХММЛ всегда повышено количество моноцитов в крови и костном мозге.
При хроническом миелолейкозе у многих больных обнаруживаются транслокации с участием хромосомы 5: t(5;7), t(5;10), t(5;12), при которых образуются слитные гены, вовлекающие расположенный на хромосоме 5 ген PDGFbR (ген b-рецептора ростового фактора, продуцируемого тромбоцитами, — platelet-derived growth factor receptor b). Продуцируемый этим геном белок имеет домен с функцией тирозинкиназы, активирующейся при транслокации, чем обусловлен нередко значительный лейкоцитоз.
При наличии лейкоцитоза, нейтрофилеза и молодых форм гранулоцитов в крови, дисплазии всех ростков миелопоэза, но отсутствии моноцитоза заболевание, согласно классификации ВОЗ, обозначают как атипичный ХМЛ, также рассматриваемый в рубрике миелодиспластических/миелопролиферативных болезней. В 25—40 % случаев это заболевание, как и другие формы миелодиспластических синдромов, заканчивается острым лейкозом. Характерных цитогенетических изменений не обнаруживается.
К этой же категории болезней в настоящее время отнесен и так называемый ювенильный ХМЛ, который встречается в основном у детей моложе 14 лет, причем у мальчиков вдвое чаще, чем у девочек. Для этого заболевания обычны низкое содержание гемоглобина, эритроцитов и тромбоцитов, повышенное количество моноцитов, в крови нередко присутствуют бластные клетки и нет базофилии и эозинофилии. В костном мозге часто увеличено содержание моноцитов и бластных клеток. Уровень щелочной фосфатазы нейтрофилов нормальный или повышен. Характерны сплено- и гепатомегалия и лимфаденопатия. Цитогенетическое исследование не обнаруживает Ph-хромосомы или гена BCR-ABL. У 30—40 % больных имеется характерная для миелодиспластических синдромов моносомия хромосомы 7.
Похожим на хронический миелолейкоз по уровню лейкоцитоза и гепатоспленомегалии является и так называемый хронический нейтрофильный лейкоз (ХНЛ). Это редкое заболевание (всего описано не более 100 случаев), при котром в отличие от ХМЛ в крови даже при высоком лейкоцитозе обычно очень небольшое количество незрелых элементов миелоидного ряда. Специфических хромосомных изменений при ХНЛ неизвестно.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Европейская клиникаХронический миелолейкоз — это злокачественное заболевание крови, при котором происходит избыточное образование и нарушение созревания гранулоцитов в костном мозге. Уникальной особенностью данного вида лейкоза является наличие в опухолевых клеток специфического маркера — филадельфийской хромосомы. Она образуется в результате транслокации t(9;22), при которой один фрагмент 22 хромосомы меняется местами с фрагментом девятой хромосомы. В итоге образуется химерный ген, который нарушает процесс деления и созревания клеток миелоидного ряда.
- Причины развития хронического миелолейкоза
- Патогенез хронического миелолейкоза
- Стадии хронического миелолейкоза
- Симптомы и признаки хронического миелолейкоза
- Диагностика хронического миелолейкоза
- Лечение хронического миелолейкоза
- Прогноз и профилактика хронического миелолейкоза
Причины развития хронического миелолейкоза
Причиной развития хронического миелолейкоза является та самая мутация, которая приводит к образованию филадельфийской хромосомы. Ее обнаруживают у 90-95% больных. Но вот что становится причиной ее образования до сих пор неизвестно.
Из эпидемиологических данных известно, что заболевание чаще развивается у пожилых людей, преимущественно мужчин. Дети страдают крайне редко, на их долю приходится около 2% всех случаев хронического миелолейкоза.
Патогенез хронического миелолейкоза
Филадельфийская хромосома является результатом взаимной транслокации между 9 и 22 хромосомами. При этом онкоген ABL из 9 хромосомы переносится на 22 хромосому и присоединяется к гену BCR. В результате образуется гибридный BCR-ABL ген, который регулирует синтез особого онкогенного белка — тирозинкиназы bcr-abl. Этот онкопротеин нарушает процесс клеточного деления, защищает опухолевые клетки от запрограммированной гибели (апоптоза) и нарушает их сцепление со стромой костного мозга, благодаря чему недозревшие клетки выходят в кровяное русло.
Чаще всего хронический миелолейкоз развивается в результате мутации в плюрипотентной гемопоэтической стволовой клетке, которая располагается в костном мозге, но есть случаи, когда первичный очаг находится в печени или селезенке.
При хроническом миелолейкозе в основном преобладает патология гранулоцитарного ростка, но могут страдать все линии гемопоэза — эритроцитарный росток, моноциты и др. Здоровые стволовые клетки сохраняются и могут давать начало новому кроветворению после проведения химиотерапии.
Стадии хронического миелолейкоза
В течении хронического миелолейкоза выделяют 4 стадии, которые отражают прогрессирование патологии. При этом заболевание может быть выявлено на любой из них.
Хроническая или доклиническая стадия — не имеет клинических симптомов, диагноз можно заподозрить по общему анализу крови, который пациенты могут сдавать либо в рамках диспансеризации, либо по поводу диагностики другого заболевания. В большинстве случаев хронический миелолейкоз выявляется именно на этой стадии.
Фаза акселерации, или стадия прогрессирования. В этот период нарастает количество опухолевых гранулоцитарных клеток, появляются различные симптомы, например, слабость или боли в костях. Объективно отмечается увеличение количества бластов в крови или костном мозге до 15-29%, увеличивается количество базофилов (более 20%), обнаруживается тромбоцитопения или тромбоцитоз (более 1000×10 9 ).
Бластный криз — это фаза, во время которой происходит резкое увеличение количества бластных клеток (больше 30%) и болезнь по своему течению напоминает агрессивный острый лейкоз.
Пациент при этом находится в тяжелом состоянии. Отмечается повышение температуры, упорные инфекции, кровотечения, лейкозные поражения кожи. На этой стадии лейкоз с трудом поддается терапии.
Фазу хронического миелолейкоза обязательно оценивают при постановке диагноза и далее перепроверяют при прогрессировании патологии и необходимости смены лечения.
Симптомы и признаки хронического миелолейкоза
Симптоматика хронического миелолейкоза характеризуется многообразием клинических проявлений и зависит от агрессивности течения и стадии заболевания. В целом может иметься несколько синдромов:
- Синдром опухолевой интоксикации. Проявляется неадекватной текущему состоянию слабостью, потерей веса, снижением аппетита. Может быть повышение температуры, повышенная потливость, зуд кожи, боли в костях.
- Синдром опухолевой пролиферации. Развивается при активном увеличении количества злокачественных клеток, инфильтрирующих печень и селезенку. При этом пациенты отмечают боль и тяжесть в левом боку.
- Анемический синдром — развивается при снижении количества эритроцитов и уровня гемоглобина. Проявляется слабостью, одышкой, повышенной утомляемостью при рутинных физических нагрузках. Может наблюдаться снижение давления, бледность кожи и слизистых, головокружение, тахикардия.
- Нарушения со стороны кровесвертывающей системы — тромбозы и геморрагии (кровотечения). Причиной тромбозов чаще всего оказывается тромбоцитоз (повышение уровня тромбоцитов выше 1000×10 9 /л). При этом могут возникать тромбофлебиты, инфаркты, инсульты. Геморрагические проявления характеризуются увеличением времени кровотечения после травмы, а также образованием петехиальной геморрагической сыпи. Развиваются они на фоне критического снижения уровня тромбоцитов.
Диагностика хронического миелолейкоза
В большинстве случаев хронический миелолейкоз является случайной находкой, которая обнаруживается при обследовании по другому поводу. Заподозрить его можно по общему анализу крови, в частности по увеличению количества лейкоцитов и преобладанию в формуле гранулоцитарного ростка кроветворения. При этом может увеличиваться не только количество нейтрофилов, но и базофилов с эозинофилами. Может быть умеренная анемия или отклонения в количестве тромбоцитов.
Если врач подозревает хронический миелолейкоз, пациента направляют на дальнейшее обследование — пункцию и биопсию костного мозга. Для подтверждения диагноза необходимо проводить стандартное цитогенетическое исследование костного мозга на предмет наличия филадельфийской хромосомы. Исследуется не менее 20 метафаз. При невозможности проведения цитогенетики, прибегают к флюоресцентной in situ гибридизации, с помощью которой выявляют химерный ген. Также определяется экспрессия химерного гена в клетках периферической крови посредством ПЦР. Если типичный транскрипт не обнаруживается, а при этом есть клинико-гематологические признаки хронического миелолейкоза, показано определение более редких мутаций — BCR-ABLp190, р230.

В фазе бластного криза проводят иммунофенотипирование бластных клеток, цитологическое и биохимическое исследование спинномозговой жидкости. При обнаружении хронического миелолейкоза в фазе активации или бластного криза, поиск филадельфийской хромосомы может осуществляться посредством секвенирования генетического материала клеток крови.
Лечение хронического миелолейкоза
На начальном этапе, до получения цитогенетического подтверждения диагноза (как мы уже знаем, хронический миелолейкоз выставляется при наличии филадельфийской хромосомы), назначается симптоматическая терапия гидроксимочевиной. Ее целью является снижение общего уровня лейкоцитов и тромбоцитов. При непереносимости препарата или недостаточном снижении уровня тромбоцитов может применяться анагрелид. Если имеются признаки лейкостаза (энцефалопатия, зрительные нарушения, нарушения работы почек), проводится лейкаферез.
После цитогенетического подтверждения диагноза, назначается специфическая противоопухолевая терапия. Главными препаратами являются ингибиторы тирозинкиназ (ИТК). Дозировка подбирается в зависимости от уровня лейкоцитов. На начальном этапе для профилактики синдрома лизиса опухоли необходима усиленная гидратация (дополнительное введение жидкости в объеме 2-2,5 л/м 2 , если нет противопоказаний со стороны сердечно-сосудистой системы) и назначение аллопуринола.
Целью специфического лечения хронического миелолейкоза является подавление опухолевого клона клеток, снижение риска прогрессирования патологии и продление жизни пациента до значений, сопоставимых с общепопуляционными показателями. С внедрением в практику ИТК эти задачи стали вполне выполнимы и не только позволили повысить общую выживаемость таких больных в несколько раз, но и оказаться от пожизненного приема препаратов и перехода под динамическое наблюдение у пациентов с хорошим молекулярным ответом опухоли.
В настоящее время согласно принятым протоколам лечения, ИТК должны назначаться всем больным с впервые выявленным хроническим миелолейкозом. В основе механизма их действия лежит блокада АТФ-связывающего кармана патологической молекулы BCR-ABL, что лишает этот белок тирозинкиназной активности, которая стимулирует избыточное деление опухолевых клеток. При постоянном приеме ИТК, опухолевый клон подвергается редукции, что дает возможность восстановлению нормального кроветворения.
В России для терапии первой линии зарегистрированы следующие препараты из группы ИТК:
- иматиниб,
- нилотиниб,
- дазатиниб.
Иматиниб
Иматиниб обладает избирательной активностью в отношении BCR-ABL тирозинкиназы и некоторых других тирозинкиназ. Назначается длительными курсами и должен приниматься ежедневно. Первоначальная дозировка составляет 400 мг в сутки при хронической фазе миелолейкоза, и 600 мг/сут при фазе акселерации или бластном кризе. Дозировка не зависит от роста, пола и массы тела пациента. Препарат выпускается в таблетированной форме или капсулах. Может применяться в амбулаторных условиях. При неудовлетворительном результате терапии, дозировка может быть увеличена, при развитии токсических осложнений — снижена.
Нилотиниб
Нилотиниб — высокоселективный ингибитор BCR-ABL тирозинкиназы. Был разработан на основе молекулы иматиниба и модифицирван для увеличения сродства к BCR-ABL тирозинкиназой. Выпускается в капсулах. Дозировка при терапии хронической фазы составляет 600 мг/сут, при терапии фазы акселерации — 800 мг/сут. Препарат принимают 2 раза в сутки с интервалом в 12 часов строго натощак, поскольку еда увеличивает биодоступность препарата, что повышает его концентрацию в плазме и может спровоцировать развитие токсических осложнений. При недостаточном терапевтическом эффекте в лечении хронической фазы, возможно увеличение дозировки до 800 мг/сутки. При развитии осложнений, дозу снижают.
Дазатиниб
Дазатиниб обладает активностью ко многим тирозинкиназам, в том числе и к мутантной BCR-ABL. Проникает через гематоэнцефалический барьер. Выпускается в формах для перорального применения. Рекомендуемая дозировка составляет 100 мг/сутки для хронической фазы и 140 мг/сут для фазы акселерации и бластного криза. При недостаточной эффективности терапии хронической фазы возможно увеличение дозировки до 140 мг/сут. При развитии токсических осложнений ее снижают до 80 мг/сутки.

Босутиниб
Босутиниб — относительно новый препарат, в России зарегистрирован в 2014 году и применяется для терапии второй и последующих линий при непереносимости или неэффективности вышеперечисленных препаратов. Стандартная суточная доза составляет 500 мг, при необходимости может быть увеличена до 600 мг.
Выбор препарата первой линии проводится индивидуально для каждого пациента. При этом учитывается фаза лейкоза, чувствительность опухолевого клона с отдельными мутациями, профиль токсичности каждого препарата и наличие у пациента сопутствующих заболеваний.
Определение спектра мутаций проводится при манифестации патологии с фазу акселерации или бластного криза, либо при неэффективности терапии выбранным препаратом и необходимости смены препарата, поскольку здесь есть вероятность возникновения резистентных клонов. Например, мутации F317L/V, T315A, V299L обуславливают низкую чувствительность к дазатинибу, поэтому его меняют на нилотиниб. Мутации Y253H, E255K/V, F359V/C, наоборот, делают опухолевые клетки резистентными к нилотинибу, поэтому таким пациентам показан дазатиниб.
Мутации E255K/V, G250E, V299L обуславливают устойчивость к босутинибу. Наличие мутации Т3151 определяет устойчивость ко всем видам ИТК, поэтому таким пациентам рекомендуется аллогенная трансплантация гемопоэтических стволовых клеток. Также возможен вариант терапии понатинибом, но он пока не зарегистрирован в России.
Эффект терапии первой линии может быть отнесен к одной из трех групп:
- Оптимальный ответ. Это хороший результат, который позволяет надеяться на длительный период безрецидивной выживаемости (7-8 и более лет). Критерием достижения оптимального ответа является полный гематологический ответ в течение 3 месяцев, полный цитогенетический ответ в течение 6 месяцев и большой молекулярный ответ в течение 12-18 месяцев.
- Предупреждение. При наличии предупредительных факторов требуется тщательный мониторинг состояния больного и готовность к смене режима лечения. Факторами предупреждения является группа высокого риска хронического миелолейкоза, увеличение более, чем в 10 раз уровня транскрипции мутантного гена, наличие дополнительных хромосомных аномалий в клетках с филадельфийской хромосомой.
- Неудача терапии. Сюда относят прогрессирование заболевания, возникновение новыхмутаций, появление дополнительных хромосомных аномалий в клетках с филадельфийской хромосомой. Требуется смена терапии.
Другие методы лечения хронического миелолейкоза
Трансплантация донорских стволовых клеток показана пациентам с неэффективностью терапии второй линии и пациентам с мутацией T315I. Пациентам с непереносимостью ИТК и невозможностью проведения трансплантации возможно лечение с помощью гидроксимочевины, интерферонов и цитостатиков.
Прогноз и профилактика хронического миелолейкоза
Специфических методов профилактики не существует, поскольку неизвестны причины, из-за которых образуются мутации, вызывающие хронический миелолейкоз. Что касается прогноза, то здесь все зависит от возраста больного, ответа на лечение и возможности проведения аллогенной трансплантации. В целом ситуация довольно благоприятная и позволяет надеяться на продолжительность жизни, сопоставимую с общепопуляционными показателями. У некоторых больных возможно достижение стойкой ремиссии и отказ от пожизненного приема ИТК с регулярным динамическим наблюдением.
В Европейской клинике лечение миелолейкоза соответствует всем современным лечебным протоколам. В сложных случаях, решение принимает консилиум специалистов, а при достижении ремиссии, мы особое внимание уделяем регулярному наблюдению пациента, что также позволяет улучшать результаты лечения.
Хронический миелолейкоз - опухолевое заболевание крови. Характеризуется бесконтрольным ростом и размножением всех ростковых клеток крови, при этом молодые злокачественные клетки способны созревать до зрелых форм.

Хронический миелолейкоз (синоним – хронический миелоидный лейкоз) – опухолевое заболевание крови. Его развитие связано с изменениями в одной из хромосом и появлением химерного («сшитого» из разных фрагментов) гена, который нарушает кроветворение в красном костном мозге.
Во время хронического миелолейкоза в крови повышается содержание особой разновидности лейкоцитов – гранулоцитов. Они образуются в красном костном мозге в огромном количестве и выходят в кровь, не успевая до конца созреть. Одновременно содержание всех остальных видов лейкоцитов снижается.
Причины хронического миелолейкоза
Причины хромосомного нарушения, приводящего к хроническому миелолейкозу, до сих пор изучены недостаточно.
Считается, что имеют значение следующие факторы:
![]()
Слабые дозы радиации. Их роль доказана только у 5% больных.- Электромагнитные излучения, вирусы и некоторые химические вещества – их влияние не доказано окончательно.
- Применение некоторых лекарственных препаратов. Известны случаи возникновения хронического миелолейкоза при лечении цитостатиками (противоопухолевые препараты) в сочетании с лучевой терапией.
- Наследственные причины. Люди с хромосомными нарушениями (синдром Клайнфелтера, синдром Дауна) имеют повышенный риск хронического миелоидного лейкоза.
- Клетки размножаются неконтролируемо, как раковые.
- Для этих клеток перестают работать естественные механизмы гибели.
Фазы хронического миелолейкоза
- Хроническая фаза. В этой фазе находится большинство пациентов, которые обращаются к врачу (около 85%). Средняя продолжительность – 3 – 4 года (зависит от того, насколько своевременно и правильно начато лечение). Это стадия относительной стабильности. Пациента беспокоят минимальные симптомы, на которые он может не обращать внимания. Иногда врачи выявляют хроническую фазу миелолейкоза случайно, при проведении общего анализа крови.
- Фаза акселерации. Во время этой фазы патологический процесс активируется. Количество незрелых белых кровяных телец в крови начинает быстро нарастать. Фаза акселерации является как бы переходной от хронической к последней, третьей.
- Терминальная фаза. Финальная стадия болезни. Возникает при нарастании изменений в хромосомах. Красный костный мозг практически полностью замещается злокачественными клетками. Во время терминальной стадии пациент погибает.
Проявления хронического миелолейкоза
Симптомы хронической фазы:
![]()
Вначале симптомы могут полностью отсутствовать, либо они выражены настолько слабо, что больной не придает им особого значения, списывает на постоянное переутомление. Заболевание выявляется случайно, во время очередной сдачи общего анализа крови.- Нарушение общего состояния: слабость и недомогание, постепенная потеря веса, снижение аппетита, повышенная потливость по ночам.
- Признаки, обусловленные увеличением размеров селезенки: во время приема пищи больной быстро наедается, боли в левой части живота, наличие опухолевидного образования, которое можно прощупать.
- Признаки, связанные с нарушением функции тромбоцитов и белых кровяных телец: различные кровотечения либо, напротив, образование тромбов.
- Признаки, связанные с повышением количества тромбоцитов и, как следствие, повышением свертываемости крови: нарушение кровообращения в головном мозге (головные боли, головокружения, снижение памяти, внимания и пр.), инфаркт миокарда, нарушение зрения, одышка.
Симптомы фазы акселерации
Симптомы терминальной стадии хронического миелолейкоза:
- Резкая слабость, значительное ухудшение общего самочувствия.
- Длительные ноющие боли в суставах и костях. Иногда они могут быть очень сильными. Это связано с разрастанием злокачественной ткани в красном костном мозге.
- Проливные поты.
- Периодическое беспричинное повышение температуры до 38 - 39⁰C, во время которого возникает сильный озноб.
- Снижение массы тела.
- Повышенная кровоточивость, появление кровоизлияний под кожей. Эти симптомы возникают в результате уменьшения количества тромбоцитов и снижением свертываемости крови.
- Быстрое увеличение размеров селезенки: живот увеличивается в размерах, появляется чувство тяжести, боли. Это происходит за счет роста опухолевой ткани в селезенке.
Диагностика заболевания
К какому врачу следует обращаться при наличии симптомов хронического миелолейкоза?

Осмотр в кабинете врача
Когда врач может заподозрить у пациента хронический миелолейкоз?
Как производится полное обследование при подозрении на хронический миелолейкоз?
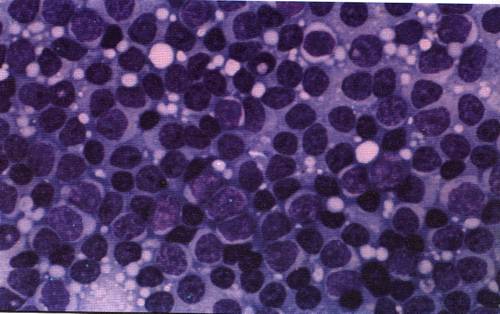
| Название исследования | Описание | Что выявляет? |
| Общий анализ крови | Рутинное клиническое исследование, выполняется при подозрении на любые заболевания. Общий анализ крови помогает определить общее содержание лейкоцитов, их отдельных разновидностей, незрелых форм. Кровь для анализа берут из пальца или вены в утренние часы. |
Лабораторные показатели
Симптомы
- Приапизм – болезненная, чрезмерно длительная эрекция.
Данные симптомы это предвестники тяжелого состояния (бластного криза), появляются за 6- 12 месяцев до его начала.
- Снижается эффективность лекарств (цитостатиков)
- Развивается анемия
- Увеличивается процент бластных клеток в крови
- Ухудшается общее состояние
- Увеличивается селезенка
- Симптомы соответствую клинической картине при остром лейкозе (см. Острый лимфолейоз).
Как лечат миелолейкоз?
Цель лечения снизить рост опухолевых клеток и уменьшить размеры селезенки.
Лечение заболевания должно быть начато сразу после того, как установлен диагноз. От качества и своевременности терапии во многом зависит прогноз.
Лечение включает различные методы: химиотерапия, лучевая терапия, удаление селезенки, пересадка костного мозга.
Лечение лекарствами
Химиотерапия
- Классические препараты: Миелосан (Милеран, Бусульфан), Гидроксиуреа (Гидреа, Литалир), Цитозар, 6-меркаптопурни, альфа-интерферон.
- Новые препараты: Гливек, Спрайсел.
Пересадка костного мозга
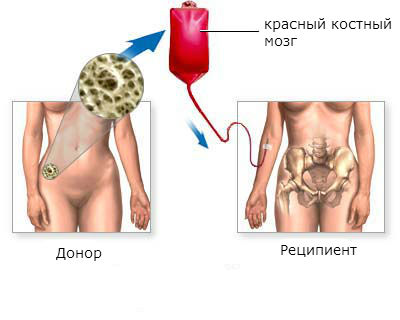
Пересадка костного мозга даёт возможность полностью выздороветь больным хроническим миелолейкозом. Эффективность пересадки выше в хронической фазе заболевания, в остальных фазах гораздо ниже.
Трансплантация красного костного мозга является наиболее эффективным методом лечения хронического миелоидного лейкоза. Более чем у половины пациентов, которым была произведена пересадка, наступает стойкое улучшение в течение 5 лет и дольше.
Чаще всего выздоровление происходит в том случае, когда красный костный мозг пересаживают больному моложе 50 лет в хроническую фазу заболевания.
Этапы трансплантации красного костного мозга:
- Поиск и подготовка донора. Лучшим донором стволовых клеток красного костного мозга является близкий родственник больного: близнец, брат, сестра. Если близких родственников нет, или они не подходят, ищут донора. Проводят ряд тестов для того, чтобы убедиться, что донорский материал приживется в теле пациента. Сегодня в развитых странах созданы большие банки доноров, в которых находятся десятки тысяч донорских образцов. Это дает шанс быстрее найти подходящие стволовые клетки.
- Подготовка пациента. Обычно этот этап продолжается от недели до 10 дней. Проводят лучевую терапию и химиотерапию для уничтожения как можно большего количества опухолевых клеток, предотвращения отторжения донорских клеток.
- Собственно пересадка красного костного мозга. Процедура похожа на переливание крови. В вену пациента заводят катетер, через который в кровь вводят стволовые клетки. Они какое-то время циркулируют в кровотоке, а потом оседают в костном мозге, приживаются там и начинают работать. Для предотвращения отторжения донорского материала врач назначает противовоспалительные и противоаллергические средства.
- Снижение иммунитета. Донорские клетки красного костного мозга не могут прижиться и начать функционировать сиюминутно. Для этого нужно время, обычно 2 – 4 недели. В течение этого срока у больного сильно снижен иммунитет. Его помещают в стационар, полностью ограждают от контакта с инфекциями, назначают антибиотики и противогрибковые средства. Этот период является одним из самых сложных. Сильно повышается температура тела, в организме могут активироваться хронические инфекции.
- Приживление донорских стволовых клеток. Самочувствие пациента начинает улучшаться.
- Восстановление. В течение нескольких месяцев или лет функция красного костного мозга продолжает восстанавливаться. Постепенно пациент выздоравливает, восстанавливается его работоспособность. Но он все еще должен находиться под наблюдением врача. Иногда новый иммунитет не может справиться с некоторыми инфекциями, в этом случае примерно через год после пересадки костного мозга делают прививки.
Лучевая терапия
Проводится в случаи отсутствия эффекта от химиотерапии и при увеличенной селезенке после приема медикаментов (цитостатиков). Метод выбора при развитии локальной опухоли (гранулоцитарная саркома).
В какой фазе заболевания применяется лучевая терапия?
Лучевая терапия используется в развернутой стадии хронического миелолейкоза, которая характеризуется признаками:
- Значительное разрастание опухолевой ткани в красном костном мозге.
- Рост опухолевых клеток в трубчатых костях 2.
- Сильное увеличение печени и селезенки.
Применяется гамма-терапия – облучение области селезенки гамма-лучами. Основная задача – уничтожить или прекратить рост злокачественных опухолевых клеток. Лучевую дозу и режим облучения определяет лечащий врач.
| К длинным трубчатым костям относят кости плеча, предплечья, пальцев, голени, бедра. В детстве эти кости целиком заполнены красным костным мозгом. У взрослого человека красный костный мозг сохраняется только в головках костей, а в теле кости он замещается на желтый костный мозг (жир). При хроническом миелоидном лейкозе желтый костный мозг может быть вытеснен опухолевой тканью. |
Удаление селезенки (спленэктомия)
Удаление селезенки используется редко по ограниченным показаниям (инфаркт селезенки, тромбоцитопения, выраженный дискомфорт в животе).
Операцию обычно проводят в терминальную фазу заболевания. Вместе с селезенкой из организма удаляют большое количество опухолевых клеток, тем самым облегчая течение заболевания. После операции обычно увеличивается эффективность медикаментозной терапии.
Каковы основные показания к операции?
- Разрыв селезенки.
- Угроза разрыва селезенки.
- Значительное увеличение органа в размерах, что приводит к сильному дискомфорту.
Очистка крови от избыточного количества лейкоцитов (лейкаферез)
При высоких уровнях лейкоцитов (500,0 · 10 9 /л и выше), могут использовать лейкаферез для предотвращения осложнений (отек сетчатки, приапизм, микротромбозы ).
При развитии бластного криза, лечение будет таким же, как при острых лейкозах (см. острый лимфолейкоз).
Лейкоцитаферез – лечебная процедура, напоминающая плазмаферез (очищение крови). У пациента берут определенное количество крови и пропускают через центрифугу, в которой она очищается от опухолевых клеток.
В какой фазе заболевания проводят лейкоцитаферез?
Так же, как и лучевую терапию, лейкоцитаферез проводят во время развернутой стадии миелолейкоза. Нередко его применяют в тех случаях, когда отсутствует эффект от применения лекарственных средств. Иногда лейкоцитаферез дополняет медикаментозную терапию.

Хронический миелолейкоз – это злокачественное миелопролиферативное заболевание, характеризующееся преимущественным поражением гранулоцитарного ростка. Может долгое время протекать бессимптомно. Проявляется склонностью к субфебрилитету, ощущением полноты в животе, частыми инфекциями и увеличением селезенки. Наблюдаются анемия и изменение уровня тромбоцитов, сопровождающиеся слабостью, бледностью и повышенной кровоточивостью. На заключительной стадии развиваются лихорадка, лимфоаденопатия и кожная сыпь. Диагноз устанавливается с учетом анамнеза, клинической картины и данных лабораторных исследований. Лечение – химиотерапия, радиотерапия, пересадка костного мозга.
МКБ-10

- Причины
- Патогенез
- Симптомы хронического миелолейкоза
- Диагностика
- Лечение хронического миелолейкоза
- Прогноз
- Цены на лечение
Общие сведения
Хронический миелолейкоз – онкологическое заболевание, возникающее в результате хромосомной мутации с поражением полипотентных стволовых клеток и последующей неконтролируемой пролиферацией зрелых гранулоцитов. Составляет 15% от общего количества гемобластозов у взрослых и 9% от общего числа лейкозов во всех возрастных группах. Обычно развивается после 30 лет, пик заболеваемости хроническим миелолейкозом приходится на возраст 45-55 лет. Дети до 10 лет страдают исключительно редко.
Хронический миелолейкоз одинаково распространен у женщин и у мужчин. Из-за бессимптомного или малосимптомного течения может становиться случайной находкой при исследовании анализа крови, взятого в связи с другим заболеванием или во время профилактического осмотра. У части больных хронический миелолейкоз выявляется на заключительных стадиях, что ограничивает возможности терапии и ухудшает показатели выживаемости. Лечение проводят специалисты в области онкологии и гематологии.

Причины
Хронический миелолейкоз считается первым заболеванием, при котором достоверно установлена связь между развитием патологии и определенным генетическим нарушением. В 95% случаев подтвержденной причиной хронического миелолейкоза является хромосомная транслокация, известная как «филадельфийская хромосома». Суть транслокации заключается во взаимной замене участков 9 и 22 хромосом. В результате такой замены формируется устойчивая открытая рамка считывания. Образование рамки вызывает ускорение деления клеток и подавляет механизм восстановления ДНК, что увеличивает вероятность возникновения других генетических аномалий.
В числе возможных факторов, способствующих появлению филадельфийской хромосомы у больных хроническим миелолейкозом, называют ионизирующее облучение и контакт с некоторыми химическими соединениями.
Патогенез
Итогом мутации становится усиленная пролиферация полипотентных стволовых клеток. При хроническом миелолейкозе пролиферируют преимущественно зрелые гранулоциты, но аномальный клон включает в себя и другие клетки крови: эритроциты, моноциты, мегакариоциты, реже – В- и Т-лифоциты. Обычные гемопоэтические клетки при этом не исчезают и после подавления аномального клона могут служить основой для нормальной пролиферации кровяных клеток. Для хронического миелолейкоза характерно стадийное течение.
- При первой, хронической (неактивной) фазе отмечается постепенное усугубление патологических изменений при сохранении удовлетворительного общего состояния.
- Во второй фазе хронического миелолейкоза – фазе акселерации изменения становятся явными, развиваются прогрессирующие анемия и тромбоцитопения.
- Заключительной стадией хронического миелолейкоза является бластный криз, сопровождающийся быстрой экстрамедуллярной пролиферацией бластных клеток.
Источником бластов становятся лимфатические узлы, кости, кожа, ЦНС и т. д. В фазе бластного криза состояние больного хроническим миелолейкозом резко ухудшается, развиваются тяжелые осложнения, завершающиеся гибелью больного. У некоторых пациентов фаза акселерации отсутствует, хроническая фаза сразу сменяется бластным кризом.
Симптомы хронического миелолейкоза
Клиническая картина определяется стадией заболевания. Хроническая фаза в среднем продолжается 2-3 года, в некоторых случаях – до 10 лет. Для этой фазы хронического миелолейкоза характерно бессимптомное течение или постепенное появление «легких» симптомов: слабости, некоторого недомогания, снижения трудоспособности и чувства переполнения живота. При объективном осмотре больного хроническим миелолейкозом может обнаруживаться увеличение селезенки. По анализам крови выявляется повышение количества гранулоцитов до 50-200 тыс./мкл при бессимптомном течении заболевания и до 200-1000 тыс./мкл при «легких» признаках.
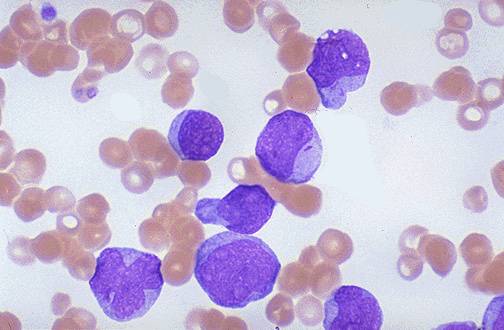
На начальных стадиях хронического миелолейкоза возможно некоторое снижение уровня гемоглобина. В последующем развивается нормохромная нормоцитарная анемия. При исследовании мазка крови пациентов с хроническим миелолейкозом отмечается преобладание молодых форм гранулоцитов: миелоцитов, промиелоцитов, миелобластов. Наблюдаются отклонения от нормального уровня зернистости в ту или иную сторону (обильная или очень скудная). Цитоплазма клеток незрелая, базофильная. Определяется анизоцитоз. При отсутствии лечения хроническая фаза переходит в фазу акселерации.
О начале фазы акселерации может свидетельствовать как изменение лабораторных показателей, так и ухудшение состояния пациентов. Возможно нарастание слабости, увеличение печени и прогрессирующее увеличение селезенки. У больных хроническим миелолейкозом выявляются клинические признаки анемии и тромбоцитопении или тробоцитоза: бледность, быстрая утомляемость, головокружения, петехии, кровоизлияния, повышенная кровоточивость. Несмотря на проводимое лечение, в крови пациентов с хроническим миелолейкозом постепенно увеличивается количество лейкоцитов. При этом отмечается возрастание уровня метамиелоцитов и миелоцитов, возможно появление единичных бластных клеток.
Бластный криз сопровождается резким ухудшением состояния больного хроническим миелолейкозом. Возникают новые хромосомные аномалии, моноклоновое новообразование трансформируется в поликлоновое. Отмечается нарастание клеточного атипизма при угнетении нормальных ростков кроветворения. Наблюдаются ярко выраженные анемия и тромбоцитопения. Суммарное количество бластов и промиелоцитов в периферической крови составляет более 30%, в костном мозге – более 50%. Пациенты с хроническим миелолейкозом теряют вес и аппетит. Возникают экстрамедуллярные очаги незрелых клеток (хлоромы). Развиваются кровотечения и тяжелые инфекционные осложнения.
Диагностика
Диагноз устанавливается на основании клинической картины и результатов лабораторных исследований. Первое подозрение на хронический миелолейкоз часто возникает при повышении уровня гранулоцитов в общем анализе крови, назначенном в порядке профилактического осмотра или обследования в связи с другим заболеванием. Для уточнения диагноза могут использоваться данные гистологического исследования материала, полученного при стернальной пункции костного мозга, однако окончательный диагноз «хронический миелолейкоз» выставляется при выявлении филадельфийской хромосомы при помощи ПЦР, флюоресцентной гибридизации или цитогенетического исследования.
Вопрос о возможности постановки диагноза хронический миелолейкоз при отсутствии филадельфийской хромосомы остается дискутабельным. Многие исследователи считают, что подобные случаи могут объясняться комплексными хромосомными нарушениями, из-за которых выявление данной транслокации становится затруднительным. В ряде случаев филадельфийскую хромосому можно обнаружить при использовании ПЦР с обратной транскрипцией. При отрицательных результатах исследования и нетипичном течении заболевания обычно говорят не о хроническом миелолейкозе, а о недифференцированном миелопролиферативном/миелодиспластическом расстройстве.
Лечение хронического миелолейкоза
Тактику лечения определяют в зависимости от фазы заболевания и выраженности клинических проявлений. В хронической фазе при бессимптомном течении и слабо выраженных лабораторных изменениях ограничиваются общеукрепляющими мероприятиями. Больным хроническим миелолейкозом рекомендуют соблюдать режим труда и отдыха, принимать пищу, богатую витаминами и т. д. Лечение может включать:
- Монохимиотерапию. При повышении уровня лейкоцитов используют бусульфан. После нормализации лабораторных показателей и уменьшения селезенки пациентам с хроническим миелолейкозом назначают поддерживающую терапию или курсовое лечение бусульфаном. При бластных кризах осуществляют лечение гидроксикарбамидом.
- Радиотерапию. Облучение обычно используют при лейкоцитозе в сочетании со спленомегалией. При снижении уровня лейкоцитов делают паузу продолжительностью не менее месяца, а затем переходят на поддерживающую терапию бусульфаном. Радиотерапию также назначают при хлоромах.
- Полихимиотерапию. В прогрессирующей фазе хронического миелолейкоза возможно использование одного химиопрепарата или полихимиотерапии. Применяют митобронитол, гексафосфамид или хлорэтиламиноурацил. Как и в хронической фазе, проводят интенсивную терапию до стабилизации лабораторных показателей, в последующем переходят на поддерживающие дозы. Курсы полиохимиотерапии при хроническом миелолейкозе повторяют 3-4 раза в год.
- Гемокоррекцию. При неэффективности терапии используют лейкоцитаферез. При выраженной тромбоцитопении, анемии выполняют переливания тромбоконцентрата и эритроцитарной массы.
- ТКМ.Пересадку костного мозга проводят в первой фазе хронического миелолейкоза. Продолжительной ремиссии удается достичь у 70% пациентов.
- Удаление селезенки. При наличии показаний осуществляют спленэктомию. Экстренная спленэктомия показана при разрыве или угрозе разрыва селезенки, плановая – при гемолитических кризах, «блуждающей» селезенке, рецидивирующих периспленитах и резко выраженной спленомегалии, сопровождающейся нарушением функций органов брюшной полости.
Прогноз
Прогноз при хроническом миелолейкозе зависит от множества факторов, определяющим из которых является момент начала лечения (в хронической фазе, фазе активации или в период бластного криза). В качестве неблагоприятных прогностических признаков хронического миелолейкоза рассматривают значительное увеличение печени и селезенки (печень выступает из-под края реберной дуги на 6 и более см, селезенка – на 15 и более см), лейкоцитоз свыше 100x10 9 /л, тромбоцитопению менее 150x10 9 /л, тромбоцитоз более 500х10 9 /л, повышение уровня бластных клеток в периферической крови до 1% и более, повышение суммарного уровня промиелоцитов и бластных клеток в периферической крови до 30% и более.
Вероятность неблагоприятного исхода при хроническом миелолейкозе возрастает по мере увеличения количества признаков. Причиной гибели становятся инфекционные осложнения или тяжелые геморрагии. Средняя продолжительность жизни пациентов с хроническим миелолейкозом составляет 2,5 года, однако при своевременном начале терапии и благоприятном течении заболевания этот показатель может увеличиваться до нескольких десятков лет.
Что такое Сублейкемический миелоз -
Сублейкемический миелоз относится к лейкозам, проявляющимся несколько повышенной полиморфно-клеточной миелопролиферацией типа панмиелоза или миеломегакариоцитарного миелоза, прогрессирующим миелофиброзом и остеомиелосклерозом, спленомегалией, гепатомегалией с трехростковой миелоидной метаплазией в этих и, значительно реже, в других органах и тканях.
Что провоцирует / Причины Сублейкемического миелоза:
В литературе не встретились данные о структуре заболеваемости сублейкемическим миелозом.
Патогенез (что происходит?) во время Сублейкемического миелоза:
Некоторые исследователи полагают, что при сублейкемическом миелозе первично нарушается процесс кроветворения на уровне клетки-предшественницы миелопоэза. Принадлежность его к гемобластозам и вторичный характер миелофиброза основываются на исследованиях типов Г-6-ФД в клетках крови и фибробластах костного мозга и кожи у мулаток, гетерозиготных по этому ферменту. Согласно одной из концепций, миелофиброз при этой форме лейкоза обусловлен мегакариоцитами и тромбоцитами, продуцирующими ростковый фактор, усиливающий пролиферацию фибробластов. Топография миелофиброза соответствует участкам скопления мегакариоцитов. Сторонники принадлежности сублейкемического миелоза к лейкозам указывают на миелоидную метаплазию в селезенке и других органах, финальное обострение процесса по типу бластного криза, наличие злокачественной формы заболевания и чувствительность таких больных к цитостатической терапии.
Симптомы Сублейкемического миелоза:
При доброкачественном варианте сублейкемического миелоза развернутой клинической картине предшествует длительный бессимптомный период. Продолжительность жизни от момента установления диагноза колеблется от 1,5 до 5 лет, встречаются случаи более длительного течения заболевания (15-20 и более лет).
Злокачественные формы сублейкемического миелоза характеризуются острым (подострым) или молниеносным течением, ранним возникновением бластного криза, глубокой тромбоцитопенией и выраженным геморрагическим синдромом, приводящим к смерти. Часто присоединяются инфекционные осложнения, сердечная и печеночная недостаточность и тромбозы. В 10-17% случаев диагностируется портальная гипертензия с варикозным расширением вен пищевода.
Примерная формулировка диагноза:
Сублейкемический миелоз чаще обнаруживается у лиц старше 40 лет. Иногда в течение многих лет больные не отмечают никаких признаков болезни, обращаются к врачу с жалобами на похудание, периодически возникающую лихорадку, боли в костях и в области селезенки. На фоне несостоятельности гемостаза и тромбоцитопении возникают кровоизлияния в кожу, суставы, нередки кровотечения из вен пищевода и желудка. Анемия чаще носит нормохромный, редко мегалобластный или гемолитический характер. В отдельных случаях выявляются эритроцитоз и увеличение эритропоэза в костном мозге. В гемограмме количество лейкоцитов увеличено, иногда снижено, отмечается нейтрофилез со сдвигом влево. Количество тромбоцитов увеличено или нормально, они функционально неполноценны. В миелограмме — мегакариоцитоз (незрелые формы). В костном мозге — сужение полостей, заполненных фиброзной тканью. В увеличенной селезенке, печени и других органах и тканях очаги внекостномозгового кроветворения полиморфного состава.
Диагностика Сублейкемического миелоза:
Диагноз сублейкемического миелоза устанавливают на основании клинических данных и результатов исследования состояния гемопоэза (гемограммы, миелограммы, биоптата костного мозга).
Сублейкемический миелоз дифференцируют от хронического миелолейкоза, протекающего с сублейкемическим лейкоцитозом. Обнаружение Ph'-хромосомы служит веским аргументом в пользу миелолейкоза.
Дифференциальную диагностику следует проводить также между сублейкемическим миелозом и вторичным миелофиброзом, который может развиваться при злокачественных новообразованиях, длительных инфекциях (туберкулез), а также при токсических воздействиях (бензол и его производные и др.).
Лечение Сублейкемического миелоза:
На ранних стадиях сублейкемического миелоза при умеренной анемии и спленомегалии, не вызывающей абдоминального дискомфорта, цито-статическое лечение применять не следует; можно ограничиться общеукрепляющей терапией. Показаниями к назначению цитостатиков является спленомегалия с компрессионным синдромом и явлениями гиперспленизма, тромбоцитемия с угрозой возникновения тромбозов, прогрессирующая бластемия, плетора.
Миелобромол назначают по 250 мг/сут при исходном количестве лейкоцитов не менее 15-20*10 9 /л и нормальном содержании тромбоцитов, курсовая доза 4-10 г. При несколько меньшем их числе предварительно, на 7-14 дней, назначают глюкокортикоидные и анаболические гормоны. Препарат отменяют, когда лейкоциты достигают 6-7*10 9 /л, а тромбоциты - 100-150*10 9 /л.
Циклофосфан, противоопухолевый эффект которого менее выражен, чем миелобромола, назначают - в случаях сниженного количества лейкоцитов и тромбоцитов - по 200-400 мг/сут внутривенно с промежутками 1 -3 дня (курсовая доза 10- 12 г) в сочетании с глюкокортикоидными гормонами. При бластном кризе используют принципы лечения острых лейкозов.
Основные клинико-гематологические и рентгенологические изменения при сублейкемическом миелозе
Размеры селезенки, печени
Спленомегалия, нередко нижний край селезенки достигает малого таза, гепатомегалия у 50% больных (эти симптомы могут отсутствовать), явления абдоминального дискомфорта
Анемня, чаще нормохромная, иногда мегалобластного или гемолитического характера (снижение продолжительности жизни эритроцитов, повышение уровня свободного билирубина в сыворотке крови); в отдельных случаях эритроцитоз, часто анизо- и пойкилоцитоз, мишеневидные и грушевидные формы эритроцитов, эритро- и нормобласты, ретикулоцитоз; в костном мозге эритропоэз иногда бывает усилен
В гемограмме количество лейкоцитов увеличено, но не существенно, редко снижено; нейтрофилез со сдвигом влево, иногда встречаются миелобласты. В костном мозге увеличено количество незрелых форм нейтрофилов
Количество тромбоцитов увеличено у 50% больных, они функционально неполноценны (снижены ретракция кровяного сгустка, уровень фактора 3, адгезивность тромбоцитов, увеличено время кровотечения); в костном мозге увеличено число мегакариоцитов включая незрелые формы
Экстра медуллярный гемопоэз
Характерно наличие очагов трехросткового кроветворения, состоящих из клеток различной степени зрелости, в селезенке, печени, других органах
Массивное разрастание костной ткани с уменьшением объема деятельного костного мозга и с сужением его полостей, заполненных фиброзной тканью, жировыми клетками; костные балки утолщены, неправильной формы вследствие напластования атипичной костной ткани, остеоида
На рентгенограммах костей (таз, позвонки, ребра, череп, длинные трубчатые) кортикальный слой утолщен, утрачена нормальная трабекулярная структура, может выявляться облитерация костномозговых полостей
Лучевая терапия на область резко увеличенной селезенки вызывает кратковременный положительный эффект, купируя явления абдоминального дискомфорта, однако возможно развитие глубокой цитопении.
Спленэктомия показана в основном в случаях глубоких гемолитических кризов, не поддающихся медикаментозной терапии, при угрозе разрыва селезенки и рецидивирующих ее инфарктах, при выраженном геморрагическом тромбоцитопеническом синдроме. Спленэктомия противопоказана в терминальной стадии, при тромбоцитозе и гиперкоагуляции.
Глюкокортикоидные гормоны назначают при анемии гемолитического характера, цитопениях, длительной лихорадке неинфекционного происхождения, артралгиях. Анаболические гормоны (неробол, ретаболил) показаны при анемии, обусловленной недостаточностью эритропоэза, длительном лечении глюкокортикоидными гормонами. При глубокой анемии применяют трансфузии эритроцитной массы; тромбоцитопенический геморрагический синдром служит показанием для переливаний тромбоконцентрата. При железодефицитной анемии назначают препараты железа.
К каким докторам следует обращаться если у Вас Сублейкемический миелоз:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Сублейкемического миелоза, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору – клиника Euro lab всегда к Вашим услугам! Лучшие врачи осмотрят Вас, изучат внешние признаки и помогут определить болезнь по симптомам, проконсультируют Вас и окажут необходимую помощь и поставят диагноз. Вы также можете вызвать врача на дом. Клиника Euro lab открыта для Вас круглосуточно.
Как обратиться в клинику:
Телефон нашей клиники в Киеве: (+38 044) 206-20-00 (многоканальный). Секретарь клиники подберет Вам удобный день и час визита к врачу. Наши координаты и схема проезда указаны здесь. Посмотрите детальнее о всех услугах клиники на ее персональной странице.
Если Вами ранее были выполнены какие-либо исследования, обязательно возьмите их результаты на консультацию к врачу. Если исследования выполнены не были, мы сделаем все необходимое в нашей клинике или у наших коллег в других клиниках.
У Вас ? Необходимо очень тщательно подходить к состоянию Вашего здоровья в целом. Люди уделяют недостаточно внимания симптомам заболеваний и не осознают, что эти болезни могут быть жизненно опасными. Есть много болезней, которые по началу никак не проявляют себя в нашем организме, но в итоге оказывается, что, к сожалению, их уже лечить слишком поздно. Каждое заболевание имеет свои определенные признаки, характерные внешние проявления – так называемые симптомы болезни. Определение симптомов – первый шаг в диагностике заболеваний в целом. Для этого просто необходимо по несколько раз в год проходить обследование у врача, чтобы не только предотвратить страшную болезнь, но и поддерживать здоровый дух в теле и организме в целом.
Если Вы хотите задать вопрос врачу – воспользуйтесь разделом онлайн консультации, возможно Вы найдете там ответы на свои вопросы и прочитаете советы по уходу за собой. Если Вас интересуют отзывы о клиниках и врачах – попробуйте найти нужную Вам информацию в разделе Вся медицина. Также зарегистрируйтесь на медицинском портале Euro lab, чтобы быть постоянно в курсе последних новостей и обновлений информации на сайте, которые будут автоматически высылаться Вам на почту.
Читайте также: