При цинге происходит нарушение как пролина так и лизина
Опубликовано: 17.04.2024
Цинга́ — болезнь, вызываемая острым недостатком витамина C (аскорбиновая кислота), который приводит к нарушению синтеза коллагена, и соединительная ткань теряет свою прочность.
Гидроксилирование пролина и лизина начинается в период трансляции коллагеновой мРНК на рибосомах и продолжается на растущей полипептидной цепи вплоть до её отделения от рибосом. После образования тройной спирали дальнейшее гидроксилирование пролиловых и лизиловых остатков прекращается.
Реакции гидроксилирования катализируют ок-сигеназы, связанные с мембранами микросом. Пролиловые и лизиловые остатки в Y-положении пептида (Гли-х-у)n подвергаются действию, соответственно, пролил-4-гидроксилазы и лизил-5-гидроксилазы. Пролил-3-гидроксилаза действует на некоторые остатки пролина в Х-положениях. Необходимыми компонентами этой реакции являются оскетоглутарат, О2 и витамин С (аскорбиновая кислота). Донором атома кислорода, который присоединяется к С-4 пролина, является молекула О2, второй атом О2 включается в сукцинат, который образуется при декарбоксилировании α-кетоглутарата, а из карбоксильной группы а-кетоглутарата образуется СО2 (см. схему А на с. 691).
Гидроксилазы пролина и лизина содержат в активном центре атом железа Fe2+. Для сохранения атома железа в ферроформе необходим восстанавливающий агент. Роль этого агента выполняет кофермент гидроксилаз - аскорбиновая кислота, которая легко окисляется в дегидроаскорбиновую кислоту. Обратное превращение происходит в ферментативном процессе за счёт восстановленного глутатиона (см. схему Б на с. 691).
Гидроксилирование пролина необходимо для стабилизации тройной спирали коллагена, ОН-группы гидроксипролина (Hyp) участвуют в образовании водородных связей. А гидроксилирование лизина очень важно для последующего образования ковалентных связей между молекулами коллагена при сборке коллагеновых фибрилл. При цинге - заболевании, вызванном недостатком витамина С, нарушается гидроксилирование остатков пролина и лизина. В результате этого образуются менее прочные и стабильные коллагеновые волокна, что приводит к большой хрупкости и ломкости кровеносных сосудов с развитием цинги. Клиническая картина цинги характеризуется возникновением множественных точечных кровоизлияний под кожу и слизистые оболочки, кровоточивостью дёсен, выпадением зубов, анемией.
3. Роль защитных систем в обеспечении гомеостаза полости рта.
Гомеостаз — саморегуляция, способность открытой системы сохранять постоянство своего внутреннего состояния посредством скоординированных реакций, направленных на поддержание динамического равновесия. Основная задача системы — воспроизводить себя, восстанавливать утраченное равновесие, преодолевать сопротивление внешней среды. К основным причинам нарушения гомеостаза относятся необычные для нормальной жизнедеятельности неферментативные реакции, протекающие в мембранах. В большинстве случаев это цепные реакции окисления с участием свободных радикалов, возникающие в фосфолипидах клеток. Эти реакции ведут к повреждению структурных элементов клеток и нарушению функции регулирования . Что касается гомеостаза полости рта, то основная роль в его поддержании отводится слюне. При этом важное значение имеет и слизистая оболочка, через которую реализуются протекание метаболических процессов в полости рта и ее защитные функции . К метаболизму, обеспечивающему поддержание гомеостаза полости рта, относятся все реакции и процессы, осуществляющие жизнедеятельность структурных элементов клеток и тканей . Нарушение клеточного метаболизма приводит к изменению гомеостаза полости рта и развитию патологического процесса . Слюна как естественная жидкая биологическая среда играет огромную роль в жизне- деятельности зубов, слизистой оболочки полости рта и пародонта . Снижение секреции слюны — неблагоприятный фактор, способствующий развитию стоматологической патологии. Основное участие слюны в поддержании гомеостаза полости рта осуществляется за счет ее активных компонентов, участвующих во многих процессах: пищеварении, поддержании постоянства среды, антимикробном, защитном, реминерализующем и других действиях .
Один из показателей гомеостаза полости рта — кислотно-основное состояние (величина водородного показателя — рН). Концентрация водородных ионов в полости рта влияет на активность ферментов слюны, процессы минерализации и реминерализации эмали, микроциркуляцию, активность микрофлоры, специфическую и неспецифическую резистентность тканей полости рта. К факторам, определяющим кислотно-основное состояние полости рта, относятся: состав пищи и питьевой воды, количество и состав слюны, десневой жидкости, зубного налета, микрофлора, а также применяемые средства гигиены для полости рта, курение, профессиональные факторы, наличие зубных протезов и ортодонтических аппаратов, заболевания зубов, десен, слизистойоболочки полости рта.
4. Возрастные изменения, протекающие в коллагене. Применение коллагена в медицине.
Коллаген является основным фибриллярным белком, обеспечивающим механические свойства кожи, ее прочность, сопротивление к деформациям. Снижение количества и изменение качества коллагеновых волокон в коже наблюдается как при хронологическом старении, так и под воздействием УФ-лучей, обуславливающих ускоренное старение кожи. Это проявляется уменьшением толщины кожи, формированием морщин, складок, усугублением проявлений гравитационного птоза (опущения) мягких тканей, более легкой травматизацией кожи. Для фотостарения более характерно формирование сетки тонких морщин - так называемый мелкоморщинистый тип старения.
При наличии полиморфизма гена коллагена предполагают наличие измененного коллагена в коже. Внешне это может проявляться преждевременным старением, выраженными признаками гравитационного птоза. В этом случае ингредиенты и процедуры, стимулирующие синтез коллагена, будут способствовать накоплению нетипичного белка, более устойчивого к действию ферментов, осуществляющих нормальный метаболизм. Таким пациентам стимулирующие процедуры назначаются с большой осторожностью.

4608
Углеводная еда, быстрые перекусы и, как следствие, дефициты по белку.
Восполнить аминокислотную задолженность можно разными методами, и это всегда комплексный подход.
В 2009 году Елена Румянцева предложила термин «аминокислотно-заместительная терапия», который исторически был применен к группе препаратов Jalupro. Знали ли мы тогда, что в 2019-м это будет так актуально и остро необходимо 1 .
Давайте разбираться в дефинициях: что такое аминокислоты, и как они классифицируются?
Аминокислоты. Общая информация, или классика жанра
Аминокислоты – это химические соединения, которые признаны жизненно необходимыми элементами белковых молекул. Молекула белка построена из ста или более остатков аминокислот, ковалентно связанных в полимерные цепи. В человеческом организме пять миллионов белков, причем ни один из белков человека не идентичен с белком любого другого живого организма. Несмотря на такое разнообразие белковых структур, для их построения необходимы всего 22 аминокислоты (табл. 1).
Таблица № 1. Классификация деления аминокислот
Аминокислоты
Незаменимые аминокислоты
У человека девять аминокислот признаны незаменимыми, поскольку организм неспособен их синтезировать, и в обычных условиях необходимо, чтобы они присутствовали в составе рациона питания
Неэссенциальные аминокислоты
Организм человека способен синтезировать. Эссенциальные аминокислоты у разных видов различаются, поскольку разные варианты метаболизма способны обеспечить синтез разных веществ
Изолейцин, лейцин, лизин, треонин, триптофан, метионин, гистидин, валин и фенилаланин
Аланин, аргинин, аспарагиновая кислота, цистеин, глутаминовая кислота, глутамин, глицин, оргинин, цитруллин, пролин, серин, таурин и тирозин
Биологические функции белков очень разнообразны. Они выполняют каталитические, регуляторные, структурные, двигательные, транспортные, защитные, запасные и другие функции. Они являются составными элементами мышц, сухожилий, органов, желез, кожи, волос и ногтей.
Исключительное свойство белка – самоорганизация структуры, то есть способность самопроизвольно создавать определенную, свойственную только данному белку структуру. Для того чтобы организм мог эффективно использовать и синтезировать белок, должны присутствовать все незаменимые аминокислоты в необходимой пропорции. Даже временное отсутствие одной незаменимой аминокислоты может отрицательно сказаться на синтезе белка. При уменьшении количества любой незаменимой аминокислоты или ее отсутствии пропорционально уменьшается эффективность всех остальных.
Что такое аминокислотно-заместительная терапия?
Аминокислотно-заместительная терапия (АЗТ) – метод, набирающий в последнее время популярность в дерматокосметологии. Напрямую к этому виду терапии относится введение аминокислотного состава в средние слои кожи. Косвенно функцию аминокислотно-заместительной терапии берет на себя методика плазмотерапии (PRP).
Цель? Синтез вожделенного коллагена. В последнее время из всех информационных источников звучат призывы насинтезировать новый коллаген, в ход идут как методы тяжелой артиллерии, читай, высокотехнологичные аппараты с клинически доказанной эффективностью, так и различные снадобья, «продавцы молодости» не стесняются маркетинговых ходов из серии «Данная сыворотка увеличивает синтез коллагена на миллиард процентов»…
Как врачу-косметологу и его пациенту разобраться, где заканчивается мечта и начинается реальность? Ответ – изучать научные статьи.
Как происходит синтез коллагена?
Кожа состоит из нескольких слоев: эпидермиса, дермы и подкожно-жировой клетчатки.
АЗТ- и PRP-терапии направлены главным образом на дерму, которая отвечает за толщину и эластичность кожи, в дерме происходит огромное количество параллельных процессов синтеза и распада. Лучше пытаться влиять на эту деятельность, хорошо представляя себе патогенетические механизмы, протекающие в коже.
Основной компонент дермы – это коллаген, органическое соединение из группы фибриллярных белков. Сосочковый слой дермы образован более мелкими пучками волокон коллагена, в нем преобладает большое количество клеток (фибробласты, фиброциты, тучные клетки, Т-лимфоциты), в то время как сетчатый слой характеризуется более крупными пучками, формирующими характерную сеть, обеспечивающую прочность кожи, отсюда и название слоя – сетчатый.
Фибробласты – основные клетки дермы, которые производят как коллаген, так и другие белки и некоторые энзимы. В разные периоды жизни человека дерма претерпевает изменения. Так, в юном возрасте она характеризуется высокой активностью фибробластов и состоит из небольших ярко-красных пучков коллагеновых волокон. С возрастом активность фибробластов снижается, уменьшается их количество, пучки коллагеновых волокон утолщаются и приобретают бледно-розовую окраску.
Молекула коллагена состоит из трех полипептидных цепей, скрученных в виде правой тройной спирали и состоящих из аминокислотных остатков (как правило, это остатки глицина, пролина и лизина). Трехспиральная структура коллагена придает молекуле прочность.
На одном из концов молекула «сшита» поперечными связями из остатков лизина, что придает волокнам высокую степень упругости.
Особую роль в регуляции синтеза коллагена играют гормоны. Глюкокортикоиды тормозят синтез коллагена, что проявляется уменьшением толщины дермы, а также атрофией кожи в местах продолжительного введения этих гормонов 8 .
На синтез коллагена влияют также половые гормоны, рецепторы к которым обнаружены в фибробластах. Синтез коллагена зависит от содержания эстрогенов, что подтверждает тот факт, что у женщин в менопаузе снижается содержание коллагена в дерме 3, 9, 10-14 .
Можем ли мы контролировать процессы синтеза и распада коллагена?
В настоящее время эстетическая медицина предлагает современные и эффективные методики по созданию пула веществ для наиболее эффективного и контролируемого синтеза коллагена. В первую очередь это аминокислотно-заместительная терапия (АЗТ) и PRP-терапия (плазмотерапия).
АЗТ представляет собой инъекционное введение аминокислот, которые ответственны за выработку коллагена. Недавнее исследование Avantaggiato et al. показало, что совместное инъекционное введение ацетилцистеина и аминокислот привело к улучшению внешнего вида кожи, замедлило ее старение и обезвоживание 2 .

Кому? Когда? Зачем?
Классическая аминокислотно-заместительная терапия в эстетической медицине – это препараты Jalupro. Уже 12 лет в России. Каждый день подтверждается эффективность и безопасность.
В состав препаратов входит запатентованная производителем структура комплекса из аминокислот (глицин, L-пролин, L-лизин моногидрохлорид, L-лейцин). Смесь аминокислот строго сбалансирована не только по количественному составу, но и по стереометрии – пространственной структуре молекул. Как результат, кластер целенаправленно встраивается в качестве главного субстрата в биохимический цикл синтеза коллагена фибробластами. Препарат является результатом многолетних научно-исследовательских работ, свойства и эффективность проверены и доказаны более чем 50 клиническими исследованиями.
Основные показания для применения препарата
- Фото- и хроностарение кожи лица любой степени выраженности.
- Растяжки различного генеза и длительности существования.
- Подготовка к эстетическим процедурам и реабилитация после них.
На третьем пункте остановлюсь подробно.
Загнанных лошадей пристреливают, не так ли?
Большая часть высокотехнологичных машин направлена на синтез коллагена, небольшая часть – на синтез эластина, и мало кто задумывается над простым фактом, что прежде чем стимулировать, необходимо дать эссенциальные аминокислоты для синтеза коллагена I и III типов и направить воспаление по контролируемому пути.
Именно это патофизиологическое обоснование делает аминокислотно-заместительную терапию – первой линией в выборе тактики подготовки пациентов к стимуляционным процедурам.

В отличие от «классических» врожденных ошибок метаболизма в катаболических путях, при которых повышенные уровни метаболитов легко обнаруживаются в жидкостях организма, дефекты синтеза имеют низкие значения метаболитов или, что сбивает с толку, даже совершенно нормальные уровни аминокислот. Это делает биохимическую диагностику этой относительно новой группы метаболических заболеваний сложной. Сообщалось о нарушениях в путях синтеза серинового обмена, глютамина, пролина и, в последнее время, аспарагина. Несмотря на то, что эти дефекты синтеза аминокислот находятся казалось бы в несвязанных метаболических путях, они , действительно, имеют много клинических особенностей. У детей, в первую очередь, поражается центральная нервная система, что приводит к (врожденной) микроцефалии, ранним приступам судорог и различным степеням умственной отсталости ( задержки психического развития).
Аномалии развития головного мозга сопровождаются кожными заболеваниями, такими как кутис-лакса ( Сutis Laxa - болезнь, от которой кожа лица и шеи начинает стареть в ускоренном темпе) при дефектах синтеза пролина; коллодий-подобная кожа и ихтиоз ( группа наследственных заболеваний кожи, которая характеризуется нарушениями ороговения.) при дефиците серина а также некролитическая эритема при дефиците глютамина. Гипомиелинизация с сопутствующей потерей объема мозга и дефектами вращения миелина вокруг аксонов может наблюдаться на МРТ головного мозга и , в частности, диффузионном тензорном изображении , при всех видах нарушениях синтеза аминокислот . У взрослых с дефектами синтеза серина или пролина, может иметь место спастическая параплегия и несколько форм полинейропатии с умственной отсталостью или без нее, которые по-видимому, являются основными симптомами этих поздних форм аминокислотных расстройств.
В последней литературе сообщалось о нескольких новых нейропсихиатрических расстройствах, а также новых фенотипах для уже известных проблемах синтеза аминокислот, что в основном связано с секвенированием следующего поколения когорт пациентов с аналогичными клиническими фенотипами. Исследование пациентов с этими дефектами синтеза раскрывает новые и уникальные функции аминокислот, участвующих, например, в развитии центральной нервной системы плода или поддержании функций периферической нервной системы.
Мы знаем о том факте, что аминокислоты являются строительными блоками для синтеза пептидов и белков и что они выполняют важные функции в промежуточном метаболизме. Мы также недавно узнали, что нейропсихиатрические расстройства могут вызывать целый спектр клинических симптомов, начиная от летальных дефектов развития и заканчивая поздним спастическим парапарезом у взрослых. Однако, многие аминокислоты имеют свои специфические клеточные функции, например, при нейротрансмиссии или энергетическом обмене и детоксикации. Выявление недостатков синтеза аминокислот создает особые проблемы для наших биохимических диагностических исследований , поскольку легко пропустить низкие значения, особенно при более мягких фенотипах. К нашему удивлению, при некоторых расстройствах концентрации аминокислот в плазме или спинномозговой жидкости (CSF) неинформативны, что требует использования методов секвенирования для подтверждения клинического диагноза. Осведомленность о нарушениях синтеза аминокислот важна из-за потенциальных терапевтических ошибок и иногда очень узкого окна возможности изменить течение заболевания и предотвратить неврологические и психические расстройства.
Исторически биохимический анализ повышенных уровней аминокислот или продуктов их распада в жидкостях организма был краеугольным камнем диагностики врожденных нарушений (ошибок) обмена веществ.
Дефекты синтеза серина
. В 1996 году Jaeken и коллеги впервые сообщили о дефектах пути синтеза аминокислоты серина у детей с тяжелыми неврологическими расстройствами. Низкие уровни серина и (глицина) в плазме и спинномозговой жидкости (CSF) были основными диагностическими признаками, указывающими на дефицит серина. С тех пор сообщалось о дефектах в путях синтеза других аминокислот.
Сообщалось о дефектах в генах, кодирующих три фермента пути синтеза L-серина, и, что неудивительно, все они вызывают сходные клинические фенотипы. L-серин синтезируется из промежуточного гликолитического 3-фосфоглицерата посредством трех ферментативных превращений. Участвующими в этом процессе ферментами являются 3-фосфоглицератдегидрогеназа (3-PGDH, OMIM 606879), 3-фосфогидроксипируват аминотрансфераза (PSAT, OMIM 610936) и фосфосеринфосфатаза (PSP, OMIM 172480).
Когда в педиатрической практике впервые были отмечены нарушения с дефицитом серина, оказалось, что между этими тремя дефектами имеются некоторые различия в фенотипе. Тем не менее, благодаря недавним исследованиям, полученным с помощью секвенирования целого экзома, теперь стало очевидным, что невозможно различить генные дефекты по клиническим признакам. Молекулярные дефекты в генах, кодирующих три фермента, могут иметь идентичные фенотипы, начиная от тяжелого летального антенатального фенотипа и заканчивая фенотипом полиневропатии в более старшем возрасте у взрослых. Тем не менее, признание дефицита серина имеет важное значение, поскольку при лечении L-серином сообщается о хороших результатах лечения.
Тяжелый и летальный фенотип с дефицитом серина уже был известен как синдром Ней-Лаксова (NLS). В 2014 году две разные группы опубликовали информацию о мутациях в генах синтеза серина у пациентов с синдромом Ней-Лаксова (Acuna-Hidalgo et al 2014 , Shaheen et al 2014 ). Из этих публикаций было очевидно, что дефекты всех трех генов могут приводить к одному и тому же клиническому фенотипу.
NLS вызывает внутриутробную или раннюю послеродовую смерть. У больных детей наблюдаются дисморфные признаки, состоящие из проптоза глаз, аномальных век, микроцефалии, маленького круглого рта, обширных скелетных аномалий с контрактурами и перепонками пальцев рук и ног;кожные аномалии, напоминающие коллодийоподобную кожу, и множественные структурные аномалии центральной нервной системы с дефектами нервной трубки, дисплазия коры, увеличенные желудочковые пространства и структурные аномалии мозжечка. Подчеркнем тот факт, что дефекты в метаболизме серина были обнаружены в результате совместной последовательности секвенирования экзома, а не в результате обнаружения низких значений серина в плазме. Имеются ограниченные данные о концентрациях серина в биологических жидкостях у пациентов с NLS, но , значения серина в плазме могут быть очень низкими (

- Что такое лизин?
- Для чего нужен лизин?
- Кому требуется L-лизин?
- Как принимать L-лизин?
- В каких продуктах есть лизин?
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
L-лизин входит в состав некоторых продуктов и пищевых добавок, которые нормализуют самочувствие человека и улучшают состояние его здоровья. Она нужна каждому человеку. В повышенных количествах ее нужно принимать профессиональным спортсменам.
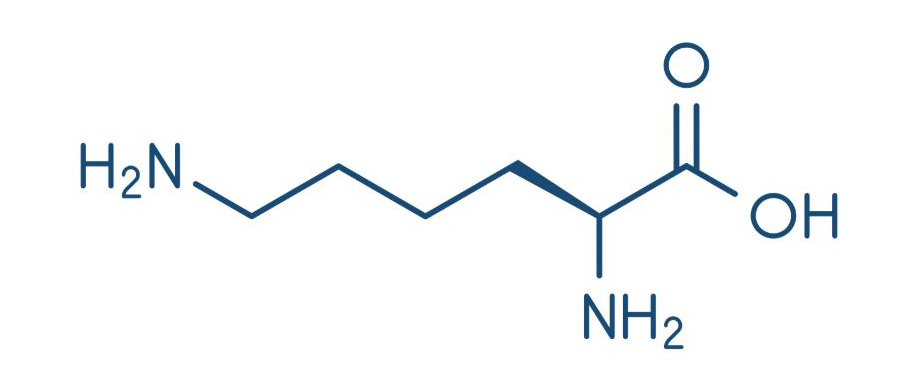
Что такое лизин?
Лизин – это незаменимая аминокислота. Организм человека не способен вырабатывать ее самостоятельно, поэтому ее нужно черпать из продуктов питания или специализированных добавок.
Для чего нужен лизин?
Данная аминокислота оказывает на организм следующее воздействие:
- являясь одной из важнейших составляющих коллагена, укрепляет опорно-двигательный аппарат;
- способствует лучшему усвоению кальция в кишечнике, что обеспечивает поддержание здоровья опорно-двигательного аппарата, укрепление волос и ногтей;
- помогает организму вырабатывать антитела к различным возбудителям инфекций;
- ускоряет процесс обмена веществ;
- приводит в норму состояние сосудов;
- помогает при похудении, расщепляет жировую прослойку;
- снижает воспалительные процессы в организме;
- улучшает запоминание информации;
- увеличивает скорость роста новых клеток;
- улучшает настроение;
- борется с головными болями;
- замедляет процессы старения;
- повышает силу и выносливость.

Кому требуется L-лизин?
Добавка показана к применению в следующих случаях:
- интенсивные занятия спортом;
- плохой иммунитет;
- заболевания сердечно-сосудистой системы;
- необоснованная усталость, апатия, отсутствие жизненных сил;
- нарушение процессов обмена веществ;
- жалобы на зрение;
- период сезонных вирусов и простуд;
- тревожность, нервозность, агрессивность;
- лечение новообразований костной ткани.
Как принимать L-лизин?
Дозировку L-лизина в индивидуальном порядке назначает врач или спортивный тренер. Принимать средство нужно следующим образом:
- Сразу после пробуждения, когда организму особенно требуется аминокислота.
- До тренировки, чтобы дать телу энергию и тонус для спортивной нагрузки.
- Сразу после тренировки, так как мышцам необходимы дополнительное питание и поддержка.
- Перед сном, чтобы предотвратить разрушение мышечной ткани во время отдыха.

В каких продуктах есть лизин?
L-лизин в большом количестве содержится в продуктах животного происхождения:
- все виды сыра;
- куриные яйца;
- морская рыба жирных сортов – треска, скумбрия, сельдь, сардина;
- морепродукты – креветки, кальмары, мидии, устрицы;
- мясо кролика;
- мясо рогатого скота – телятина, говядина, баранина, козлятина;
- свинина;
- печень и другие субпродукты;
- молоко и молочная продукция.

L-лизин также содержится в пище растительного происхождения, но в меньшем количестве:
- Бобовые культуры – фасоль, бобы, чечевица, соя, кукуруза.
- Орехи всех видов.
- Дрожжи.
- Крупы, особенно пшеничная.
Данная аминокислота используется как простыми людьми, так и спортсменами. Чтобы избежать побочных эффектов, важно соблюдать инструкцию по ее применению.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
БАКТЕРИАЛЬНЫЙ СИНТЕЗ АМИНОКИСЛОТ

ПРОБИОТИЧЕСКИЕ МИКРООРГАНИЗМЫ СИНТЕЗИРУЮТ АМИНОКИСЛОТЫ
Аминокислоты — органические биологически важные соединения, в молекуле которых одновременно содержатся карбоксильные (-СООН) и аминные группы (-NH2) , и имеющие боковую цепь, специфичную для каждой аминокислоты. Ключевые элементы аминокислот – углерод (C), водород (H), кислород (O) и азот (N). Прочие элементы находятся в боковой цепи определенных аминокислот.
Как известно, пробиотические микроорганизмы (бактерии) синтезируют различные биологически активные вещества: ранее проведенными исследованиями было установлено, что в микробной биомассе пробиотических культур (бифидобактерий и пропионовокислых бактерий), а также в отработанной культуральной жидкости содержатся антимутагенные вещества , ферменты, витамины группы В , короткоцепочечные жирные кислоты и аминокислоты. Отмечено, например, что пропионовокислые бактерии характеризуются очень хорошо развитой биосинтетической способностью и как представители прокариот способны синтезировать все аминокислоты, входящие в состав клеточных белков.
Одной из важнейших функций аминокислот является их участие в синтезе белков, выполняющих каталитические, регуляторные, запасные, структурные, транспортные, защитные и другие функции. Иными словами, пробиотические микроорганизмы играют огромную роль в процессах белкового синтеза и потому являются весьма ценными источиками аминокислот, ферментов и т.п. К слову, природные аминокислоты являются, как правило, оптически активными L - и D формами, которые трудно разделить, вот почему микробный синтез является ныне основным и экономически выгодным в промышленности.
ПОЛУЧЕНИЕ АМИНОКИСЛОТ . Существует четыре промышленных метода получения аминокислот: 1) экстракция из гидролизата белка; 2) химический синтез; 3) биотрансформация соединений-предшественников в ферментере или клеточном реакторе; 4) микробная ферментация.
Успех промышленного получения аминокислот объясняется тем, что химический синтез соединений-предшественников относительно дешев. Кроме того, для производства практически всех протеиногенных аминокислот разработаны методы ферментации, и имеются штаммы, позволяющие получать большие количества продукта. Во многих случаях такой подход экономически оправдан. Широко используются штаммы, усовершенствованные методами генетической инженерии. К настоящему времени закончено секвенирование генома Corynebacterium glutamicum. Полученная генетическая информация поможет ускорить создание новых высокопродуктивных штаммов. Во многих случаях уже клонированы целые опероны, ответственные за биосинтез аминокислот. Изучаются возможности управления обменом веществ клетки методами так называемой метаболической инженерии.
Для более детального рассмотрения темы промышленного интеза аминокислот следует перейти по кнопке-ссылке:
Стоит особенно отметить, что пропионовокислые бактерии могут синтезировать все аминокислоты за счет ассимиляции азота (NH4)2SO4. Б ифидобактерии , также отличаются образованием данных органических соедиинений. В частности, бифидобактерии выделяются синтезом триптофана, который является биологическим прекурсором серотонина (из которого затем может синтезироваться мелатонин) и ниацина (витамина PP или B3) — водорастворимого витамина, участвующего во многих окислительно-восстановительных реакциях, образовании ферментов, обмене липидов и углеводов в живых клетках.

Одним из примеров практического использования способности пробиотических бактерий к аминокислотному (белковому) синтезу , является использование их заквасок в пищевой промышленности, что позволяет получать продукты сбалансированные по аминокислотному составу. Например, при использовании бифидо- и пропионовокислых бактерий в производстве сырокопченых колбас , происходит значительное накопление в продуктах свободных аминокислот, а сумма незаменимых аминокислот становится выше на 29%. Преимущественное накопление глицина, глютаминовой кислоты, валина, фенилаланина, тирозина, лейцина, изолейцина отражает специфическое совместное воздействие на белки и пептиды тканевых эндопептидаз и экзопептидаз, а также биосинтез белков пропионовокислыми бактериями.

Нашли свое применение пробиоти ки и в сельском хозяйстве. Использование бактерий в качестве продуцента белкового корма является более эффективным, так как бактерии образуют до 75% белка по массе, в то время как дрожжи - не более 60%. Например, использование штаммов Propionibacterium freudenreichii subsp. shermanii, для приготовления белкового корма не требует расхода воздуха и энергозатрат на его подачу, так как данные штаммы пропионовокислых бактерий являются анаэробами. Штаммы обладают широким спектром антимикробного действия, что исключает развитие посторонней микрофлоры в процессе биосинтеза и поэтому не требуется наличие специального оборудования для соблюдения условий стерильности. Возможность утилизации разнообразных отходов отраслей промышленности, использующих природное сырье, при наращивании биомассы штаммов ПКБ с целью приготовления белкового корма решает также экологические проблемы предприятий.
АМИНОКИСЛОТЫ, СИНТЕЗИРУЕМЫЕ БИФИДОБАКТЕРИЯМИ И ПРОПИОНОВОКИСЛЫМИ БАКТИЕРИЯМИ

БИФИДОБАКТЕРИИ
также образуют из неорганических азотистых соединений незаменимые аминокислоты, в частности - аланин , валин , аспарагин , синтезируют триптофан .
ПИЩЕВАЯ ЦЕННОСТЬ АМИНОКИСЛОТ
Все эти биосинтезирующие функции бактерий открывают огромные возможности в сфере создания продуктов функционального питания. В современных условиях неблагоприятной экологии и снижения качества питания, с пособность бактерий к синтезу практически важных веществ (аминокислот, различных белковых соединений, витаминов, короткоцепочечных жирных кислот, полисахаридов и т.п.), является одним из перспективных инструментов в решени вопросов профилактики и лечения алиментарных заболеваний.
| ТРИПТОФАН | ЛИЗИН | МЕТИОНИН |
| На заметку: Цветовое обозначение атомов соединений на схемах аминокислот: N (азот) - синий, С (углерод) черный, О (кислород) - красный, H (водород) - белый, S (сера) - желтый (см. серусодержащий метиони н) | ||
Известно более 200 природных аминокислот, из них только 20 входят в состав белков. Эти аминокислоты называют протеиногенными — строящими белки. В организме человека наряду с протеиногенными аминокислотами можно найти и другие, которые играют иную роль, например, орнитин, β-аланин, таурин и др. Но в данном разделе мы рассмотрим лишь свойства 20-ти стандартных (протеиногенных заменимых и незаменимых аминокислот), участвующих в биосинтезе белка , а также некоторых других, синтезируемых указанными выше пробиотическими микроорганизмами. Как известно, в виде белков аминокислоты являются вторым (после воды) компонентом мышц, клеток и других тканей человеческого организма. Аминокислоты играют решающую роль в таких процессах, как транспорт нейротрансмиттеров и биосинтезе.
Для тех кто хочет получить общее представление или освежить память об основных понятиях, касающихся аминокислот и синтезе белка из аминокислот, а также о роли аминокислот в питании человека, предлагаем перейти по ссылкам:
КЛАССИФИКАЦИЯ АМИНОКИСЛОТ ПО ЗАМЕНИМЫМ И НЕЗАМЕНИМЫМ
Заменимые аминокислоты – это аминокислоты, поступающие в организм человека с белковой пищей, либо образующиеся в организме из иных аминокислот.
Незаменимые аминокислоты – это аминокислоты, которые не могут быть получены в организме человека с помощью биосинтеза, поэтому должны постоянно поступать в виде пищевых белков. Их отсутствие в организме приводит к явлениям, угрожающим жизни.
Незаменимыми аминокислотами для взрослого здорового человека являются аминокислоты фенилаланин , триптофан , треонин , метионин , лизин , лейцин , изолейцин и валин ; Для детей, дополнительно, гистидин и аргинин .
Классификация аминокислот на заменимые и незаменимые содержит ряд исключений:
- Заменимый гистидин, синтезирующийся в организме человека, должен поступать с белковой пищей, так как его производство недостаточно для нормального поддержания здоровья;
- Заменимый аргинин вследствие ряда особенностей его метаболизма, при некоторых физиологических состояниях организма может быть приравнен к незаменимым;
- Тирозин можно считать заменимой аминокислотой лишь при условии достаточного поступления фенилаланина. У больных фенилкетонурией тирозин становится незаменимой аминокислотой.
Потребность в аминокислотах и белке

Потребность в незаменимых аминокислотах
Существуют стандарты сбалансированности незаменимых аминокислот (НАК), разработанные с учетом возрастных данных. Для взрослого человека (г/сутки): триптофана – 1, лейцина 4—6, изолейцина 3—4, валина 3—4, треонина 2—3, лизина 3—5, метионина 2—4, фенилаланина 2—4, гистидина 1,5—2.
Таблица 1. Международные рекомендации по суточной потребности детей в аминокислотах*
Читайте также:

