Цитологический метод исследования пародонта
Опубликовано: 24.04.2024

Лечение и реабилитация пациентов с воспалительными заболеваниями пародонта являются одной из наиболее сложных проблем в стоматологии, что находит подтверждение в огромном количестве предложенных для этих целей средств и методов, которые далеко не всегда оказываются эффективными и необходимости использования лекарственных антимикробных препаратов избирательного действия [3, 7, 12].
Для определения вида возбудителя, назначения эффективного лечения и его оценки необходим микробиологический анализ патологического материала. Кроме того, с помощью микробиологической диагностики врач сможет конкретизировать диагноз и составить прогноз развития болезни [14].
Наиболее важными показаниями к проведению микробиологической диагностики являются такие заболевания как:
- Острый язвенно-некротический гингивит.
- Хронический пародонтит с частым рецидивированием и абсцедированием.
- Болезни паро- и периодонта, устойчивые к лечению.
- Агрессивные формы болезней пародонта (препубертатный, ювенильный пародонтит, быстропрогрессирующий у взрослых).
- Тяжелые формы патологии пародонта на фоне системных заболеваний.
- Комплексное лечение заболеваний пародонта с проведением системной антимикробной терапии, лоскутных операций, в случаях сложного протезирования или внутрикостной имплантации зубов, связанных с большими финансовыми затратами.
Сегодня актуальна выработка стандартов диагностических исследований при заболеваниях пародонта, которые могут использоваться в повседневной практике врача-стоматолога [17].
Цель исследования: на основе данных литературы сделать обзор методов диагностики микрофлоры при заболеваниях пародонта, рассмотреть преимущества и недостатки каждого из методов, что даст возможность врачу-стоматологу выбрать тот метод, который будет отвечать его целям, экономическим и техническим возможностям.
Цитологический метод исследования
Содержимое пародонтального кармана изучают по методике П. М. Покровского и М. С. Макаровой в модификации И. А. Бенюмовой (1962). Пародонтальные карманы предварительно промывают изотоническим раствором хлорида натрия, стерильной корневой иглой с турундой производят забор материала.
Забор содержимого из корневого канала проводится на этапе механической обработки корневых каналов стерильным эндодонтическим инструментом (H-файлом) (методика А. А. Кунина, 2003) [16].
Исследуемый материал распределяется на предметном стекле. Препарат фиксируют смесью Никифорова и окрашивают по Граму и Гимзе-Романовскому. Далее материал высушивается и микроскопируется при помощи светового микроскопа [1, 6].
Преимущества: простота в использовании
Недостатки: не позволяет определить вид возбудителя и его чувствительность к антибактериальным препаратам
Метод жидкостной цитологии
Жидкостная тонкослойная цитология – это способ получения монослойных цитолологических препаратов при переносе клеток из фиксирующего или транспортного растворов с использованием методов центрифугирования, осаждения и/или фильтрации.
С помощью урогенитального зонда или стоматологических бумажных адсорбентов производится забор материала из пародонтального пространства. Материал сразу помещается в специальный контейнер (виалу) и отправляется в лабораторию. В лаборатории виалы в базовых штативах помещаются в цитопроцессор, проводится обработка цитологического материала с полным сохранением клеточных и субтканевых структур. Производят окрашивание по методу Папаниколау [10].
– быстрый и удобный микроскопический анализ: препарат занимает небольшую площадь, клетки располагаются в один слой, в скоплениях хорошо видна структура ядер;
– возможность неоднократного приготовления препаратов из одного и того же контейнера;
– более высокая информативность по сравнению с традиционным цитологическим методом за счет обеспечения сохранности клеточных структур.
– более высокая, по сравнению с традиционной цитологией, стоимость пробоподготовки;
– необходимость дополнительного оборудования для приготовления препаратов;
– необходимость дополнительного обучения для интерпретации результатов [8].
Бактериологический метод исследования
Забор содержимого пародонтального кармана проводят стерильной ватной турундой на глубине 2 мм. Затем концевую часть турунды промывают в 10 мл физиологического раствора и получают взвесь микроорганизмов [6].
Забор содержимого корневого канала проводится следующим образом. Коронку зуба очищают от зубного налета гигиенической полировочной щеткой с последующей обработкой 3 %-ой перекисью водорода. После препарирования кариозной полости, раскрытия полости зуба, обеспечения эндодонтического доступа в канале H-файлом № 15-20 инструментальными движениями с ирригацией физиологическим раствором создают суспензию инфицированного состава, которую забирают с помощью стерильного бумажного штифта [11].
Образцы полученных проб помещают в транспортные системы и в течение 24 часов доставляют в бактериологическую лабораторию. Далее делают секторальный посев по методике Мельникова-Царева на 5 % кровяном агаре Шедлера, для идентификации микроорганизмов в современных условиях используют специальные тест-системы [9]. Определяют чувствительность выделенных микроорганизмов к антибактериальным препаратам, а также к препаратам растений, действие которых активно изучают в последнее время [3, 5].
– позволяет установить видовой состав микрофлоры;
– возможность определения чувствительности микроорганизмов к определенным антибактериальным препаратам
– чувствительность к забору материала, транспортировке и условиям проведения
ПЦР
Сбор мягкого зубного налета производят методом смыва из пародонтального кармана (в случае патологии) или из десневой бороздки (в случае нормы) с помощью стерильных бумажных эндодонтических штифтов [15].
Сбор твёрдого зубного налета производят следующим образом. После предварительного полоскания ротовой полости водой проводят обработку ватным тампоном зуба с целью полного удаления мягкого налета и соскабливают поддесневой твердый налет, используя кюрету Грейси [14].
Исследуемый материал помещают в пробирки с транспортной средой, предварительная обработка материала не требуется. ПЦР проходит в 3 этапа: выделение ДНК/РНК, амплификация ДНК/РНК-фрагментов, детекция ДНК/РНК-продуктов амплификации. Современные ДНК/РНК тесты способны идентифицировать от 3 до 11 периодонтопатогенов [4, 11, 13, 17].
– возможность анализа до 96 образцов за один запуск (использование при скрининговых исследованиях большого числа пациентов) [2];
– не требует специальных транспортных сред (для проведения анализа необязательно присутствие живых микроорганизмов);
– быстрый результат (весь процесс с момента передачи в лабораторию занимает не более одного рабочего дня);
– за счет автоматической интерпретации полученных результатов снимается проблема субъективной оценки;
– возможность определения чувствительности к антибактериальным препаратам
– ограничение оценки лекарственной устойчивости (данные о конкретных генетических механизмах резистентности могут отсутствовать, резистентность к препаратам часто связана с различными механизмами и мутациями в различных генах, которые независимо влияют на фенотип);
– возможность ложноположительного результата в результате загрязнения исследуемого материала и ложноотрицательного результата в результате ингибирования реакции компонентами биологических образцов [9].
Таким образом, на клиническом приеме врач-стоматолог при лечении заболеваний пародонта в целях определения вида возбудителя, назначения эффективного лечения и его оценки может использовать различные методы микробиологической диагностики. Выбор определяется преимуществами и недостатками каждого метода. Цитологический метод позволяет определить только наличие микрофлоры без возможности определить вид возбудителя и чувствительность к противомикробным средствам. Метод жидкостной цитологии является более информативным, однако также не дает возможности определения чувствительности к противомикробным средствам и является более дорогим. Бактериологический метод позволяет установить видовой состав микрофлоры, определить чувствительность микроорганизмов к антибактериальным препаратам, но является еще более дорогим и имеет чувствительность к забору и транспортировке материала. Метод ПЦР позволяет с высокой точностью определить видовой состав микрофлоры, не требователен к забору и транспортировке материала, дает возможность определения чувствительности к антибактериальным препаратам, однако имеет высокую стоимость и возможны ложные результаты.

CC BY
Аннотация научной статьи по клинической медицине, автор научной работы — Искакова Марьям Козбаевна, Муродова Нагима Умрзоковна
В статье приведены данные цитологического исследования у больных с воспалительными заболеваниями пародонта, изучена динамика клеточного состава десны, доказаны изменения в десне, коррелирующие с клинической формой и тяжестью патологического процесса.
Похожие темы научных работ по клинической медицине , автор научной работы — Искакова Марьям Козбаевна, Муродова Нагима Умрзоковна
The article presents the data of cytological examination in patients with inflammatory periodontal diseases, the dynamics of the cellular composition of the gums, proven changes in the gums correlated with the clinical form and severity of the pathological process.
Текст научной работы на тему «Характеристика цитологических исследований при заболеваниях пародонта»
Количество осложнений в основной и контрольной группах:
Осложнение Основная группа(n=23) Контрольная группа (n=17)
Застойная пневмония 2 3
Местная раневая инфекция 1 3
Несостоятельность анастомоза 0 2
Выводы: комбинированное использование оценки уровня альбумина и MUST в дооперационном периоде позволяет выявить пациентов со злокачественными новообразованиями органов желудочно-кишечного тракта по риску развития послеоперационных осложнений.
1. Статистический сборник здоровье населения Республики Казахстан и деятельность организаций здравоохранения в 2013 году - Астана: Министерство здравоохранения Республики Казахстан - 2014 - С.30
2. Статистический сборник здоровье населения Республики Казахстан и деятельность организаций здравоохранения в 2014 году - Астана: Министерство здравоохранения Республики Казахстан - 2015 - С.30
3. Салтанов А.И., Лейдерман И.Н., Снеговой А.В. Искусственное питание в поддерживающей терапии онкологических больных - М.: Издательство Медицинское информационное агентство, - 2012. - С.306
4. Fukuda Y et all. Prevalence of Malnutrition Among GaSric Cancer Patients Undergoing Ga^rectomy and Optimal Preoperative Nutritional Support for Preventing Surgical Site Infections //Ann SurgOncol. 2015 Dec;22 Suppl 3:S778-85. doi: 10.1245/s10434-015-4820-9. Epub 2015 Aug 19
5. Мальков О.А., Мороз В.В., Долгих В.Т., Лейдерман И.Н., Гирш О.А. Нутритивная поддержка в онкохирургии // Общая реаниматология. - 2008. - IV; 2. - С.94-97
ХАРАКТЕРИСТИКА ЦИТОЛОГИЧЕСКИХ ИССЛЕДОВАНИИ ПРИ ЗАБОЛЕВАНИЯХ ПАРОДОНТА
Искакова Марьям Козбаевна
Канд.мед.наук, ассоц.профессор кафедры интернатуры по стоматологии, г. Алматы
Муродова Нагима Умрзоковна,
магистрант кафедры интернатуры по стоматологии, г. Алматы
В статье приведены данные цитологического исследования у больных с воспалительными заболеваниями пародонта, изучена динамика клеточного состава десны, доказаны изменения в десне, коррелирующие с клинической формой и тяжестью патологического процесса.
The article presents the data of cytological examination in patients with inflammatory periodontal diseases, the dynamics of the cellular composition of the gums, proven changes in the gums correlated with the clinical form and severity of the pathological process.
Ключевые слова: диагностика, цитологический метод, исследование, динамика, клеточный состав
Keywords: diagnosis, cytological method, the ftudy of dynamics of cellular composition
Более доступным в плане диагностики и оценки эффективности терапии является цитологический метод исследования. Цитологические методы исследования позволяют неинвазивно, а значит, безболезненно и за короткое время определить характер патологических изменений, происходящих в тканях, проследить динамику процессов в очаге поражения, оценить эффективность лечения и прогнозировать отдаленные результаты. Современным разделом цитологии является цитоморфометрия, которая основывается на математической обработке результатов цитограмм и количественной оценке содержания различных клеточных элементов. А.С. Григорьян с соавт. разработали цитомор-фометрический метод, основанный на подсчете в цитограм-мах мазков-отпечатков количества эпителиальных клеток с
признаками различных видов цитопатологии: повышенная базофилия цитоплазмы; дистрофические и некробиотиче-ские изменения; «фагирование» [1]. С целью объективации воспалительных и деструктивных процессов в тканях па-родонта был разработан цитоморфометрический метод, в основе которого лежит изучение клеточных элементов ци-тограмм отпечатков с десны [2]. В своих исследованиях мы использовали упрощенную, модифицированную методику изучения цитограммы пародонта в норме и при патологии, т.н. метод экспресс-диагностики. При исследовании цитологического материала анализировали не только качественные признаки, но и количественные показатели цитограмм [3]. Подсчет клеток производили в двух основных клеточных популяциях цитограмм: эпителиальной (эпителиальные
клетки) и соединительнотканной (лейкоциты). При подсчете эпителиальных клеток сначала устанавливали их число в поле. Затем в том же поле зрения подсчитывали клетки с явными признаками цитопатологии и выводили относительный (к общему числу эпителиальных клеток) показатель содержания клеток с каждым из типов цитопатологии: базо-филия цитоплазмы, дистрофические изменения (вакуолизация цитоплазмы, деструкция ядра). Соединительнотканные клеточные популяции (лейкоциты) также подсчитывали в 5 полях зрения, фиксировали число клеток в абсолютных цифрах, затем выводили средние показатели, которые являются данными для вычисления воспалительно-деструктивного индекса. Выбор полей зрения для подсчета клеток применяли произвольный, при этом исследовали не менее 3—5 полей [4].
Цитологический материал был взят у 10 лиц с интакт-ным пародонтом - (контрольная группа) и у 20 больных с ВЗП до и после лечения (основная группа). Наибольшее количество пациентов составляли пациенты с хроническим катаральным гингивитом, для статистической достоверности в каждой группе были взято одинаковое число пациентов до и после лечения. При патологии тканей пародонта
в цитограмме определялись лейкоциты, округлой формы, в зависимости от степени выраженности воспалительного процесса количество их варьировало: единичные и большое скопление.
В цитограмме эпителия интактного пародонта определялось большое количество эпителиальных клеток - 58±0,05%, и единичное количество лейкоцитов - 0,12±0,05 (рисунок 1). При ВЗП в цитограмме больных были выявлены: большое количество лейкоцитов и дистрофически измененных клеток эпителия. Клетки эпителия характеризовались мелко- и крупнокапельной вакуолизацией цитоплазмы, с деформированным ядром. При хроническом катаральном гингивите (легкая степень) в цитограмме насчитывались эпителиальные клетки различных видов: от крупных полигональных со средним и мелким размером ядра (22,0±0,03*) и незначительные скопления лейкоцитов - 49,0±0,05* (рисунок 2). При хроническом катаральном гингивите (средняя степень) в цитограмме насчитывались эпителиальные клетки: крупные полигональные со средним и мелким размером ядра (16,0±0,09*) и скопления лейкоцитов 76,0±0,05* (рисунок 3). Эти данные свидетельствуют о хроническом воспалительном процессе в тканях пародонта.
1-эпителиальные клетки Рисунок 1.Пациент М., 20 лет. Мазок отпечаток. Интактный пародонт.
При хроническом катаральном гингивите в стадии обострения в цитограмме насчитывались незначительное количество эпителиальных клеток, причем больше одного вида: средние полигональные с мелким размером ядра (6,0±0,01*) и огромное количество лейкоцитов (162,0±0,05*), что свидетельствует об обострении хронического воспалительного процесса в тканях пародонта, которое можно отожествлять с острым воспалительным процессом. При хроническом
гипертрофическом гингивите в цитограмме насчитывались незначительное количество эпителиальных клеток: по форме полигональные средние и мелкие с мелким размером ядра (12±0,03*) и незначительные скопления лейкоцитов (59,0±0,01*), что свидетельствует о хроническом течении воспалительного процесса в тканях пародонта, сопровождающиеся гипперплазией десны.
1- эпителиальные клетки; 2 - лейкоциты Рисунок 2. Б-ной К., 24 года. Диагноз: Хронический катаральный гингивит, легкая степень, до лечения. Мазок отпечаток.
1- эпителиальные клетки; 2 - лейкоциты Рисунок 3. Б-ной А., 24 года. Диагноз: Хронический катаральный гингивит, средняя степень, до лечения. Мазок отпечаток.
Таким образом, признаки цитопатологии отпечатков при заболевании пародонта свидетельствуют о воспалительных изменениях в десне, коррелирующие с клинической формой и тяжестью патологического процесса. При данной цитологической картине выбор средств лечения играет значительную роль на купирование воспалительных процессов и удлинение сроков ремиссии. Проведение комплексных клинических, цитологических исследований доказало о том, что у больных с различными формами воспалительных за-
болеваний пародонта имеются нарушения специфических и неспецифических факторов обеспечения реактивности организма, что свидетельствует о срыве адаптационных механизмов при этом заболевании. Для устранения выявленных нарушений необходима организация проведения профилактических осмотров среди лиц молодого возраста с целью раннего выявления заболевания и проведение эффективных лечебно-профилактических мероприятий.
1.Григорьян А.С. и соавт. Новый диагностический метод оценки состояния пародонта по данным цитоморфометрии отпечатков с десны // Ж. Стоматология. 2000. - № 5. - с. 4-9.
2. Григорьян А. С., Фролова О.А., Иванова Е.В. Морфогенез ранних стадий воспалительных заболеваний пародонта //Ж. Стоматология. 2002. - № 1. - с. 19-25.
3. http://medumvercom/Medical/&omatologia/590.html MedUniver.
4.Грудянов А.И. Заболевание пародонта — Медицинское информационное агенство, 2009. — 328 с.
РАННИЕ РЕЗУЛЬТАТЫ СИСТЕМНОГО ПРОТЕЗИРОВАНИЯ ДЕТОКСИКАЦИОННОЙ ФУНКЦИИ ПЕЧЕНИ ПРИ КРИТИЧЕСКИХ СОСТОЯНИЯХ
Исмаилов Еркинбек Лесбекович
Кандидат медицинских наук, доцент кафедры анестезиологии и реаниматологии с курсом скорой неотложной медицинской помощи Института последипломного образования Казахского Национального медицинского университета,
Исследовательская работа выполнена на основе клинической оценки эффективности проводимой интенсивной терапии с системным протезированием дезинтоксикационной функции печени у 39 пациентов с различными заболеваниями, течение которых осложнилось мультиорганной дисфункцией с превалированием синдрома острой печеночной недостаточности и интоксикации, находившихся на стационарном лечении в отделении реанимации и интенсивной терапии. Системное протезирования детоксикационной функций печени включало в себя последовательное применение методов экстракорпоральной детоксикации (альбуминовый диализ - MARS терапия (молекулярная адсорбционная рециркуляционная система), гемодиафильтрация (ГДФ), плазмаферез) и гемокоррекции (внутрисосудистое лазерное облучение крови (ВЛОК) и ультрафиолетовое облучение крови (УФО) на фоне традиционной посиндромной интенсивной терапии.
Анализ полученных результатов нашего исследования в динамике показал, что раннее включение системного протезирования детоксикационной функции печени в комплексное лечение острой печеночной недостаточности обеспечивает уменьшение клинических признаков и тяжести эндотоксикоза уже на 2-3-е сутки после 1 сеанса системного протезирования детоксикационной функции печени.
Objective of the &udy - recovery of the functional viability and accelerate of the regenerative processes in the liver after sy^emic prophéties of detoxification functions of the liver.
The research work based on the clinical assessment of the effectiveness of intensive therapy with sy^emic pro^hetics of detoxification liver function in 39 patients with various diseases, which complicated by multiorgan dysfunction syndrome with prevalence of acute liver failure and intoxication. Sy&em pro^hetics detoxification of the liver is consi^ent application of methods of extracorporeal detoxification (albumin dialysis - MARS therapy (molecular adsorption recirculation sy&em), hemodiafiltration (HDF), plasmapheresis) and hemocorrection (intravascular laser irradiation of blood (ILIB) and ultraviolet blood irradiation (UV).
Analysis of the our results showed that the early inclusion of a sy&em prophetic of liver detoxification function in the complex treatment of acute liver failure reduces clinical signs and severity of endotoxemia already 2-3 days after 1 session.
Ключевые слова: системное протезирование, детоксикационная функция, печеночная недостаточность, экстракорпоральная детоксикация
Keywords: sy^em pro^hetics, detoxification function, liver failure, extracorporeal detoxification
Современный уровень развития медицины позволяет с успехом проводить сложнейшие оперативные вмешательства и выводить пациентов из тяжелейших критических состояний, которые еще десять-пятнадцать лет назад считались однозначно фатальными. И если в отношении систем дыхания, кровообращения, выделения и других проблема временного протезирования функциональных способностей в той или иной степени решена, то в отношении детоксика-ционной функции печени вопрос остается открытым вследствие особенностей функционирования и роли этого органа в подержании постоянства гомеостаза и влиянии ее состояние на статус других жизненно важных органов и систем.
Цель исследования - восстановление функциональной состоятельности и ускорение регенеративных процессов в
печени после системного протезирования детоксикацион-ной функций печени
Материалы и методы исследования Исследовательская работа выполнена на основе сравнительного анализа и клинической оценки эффективности проводимой интенсивной терапии с системным протезированием дезинтоксикационной функции печени у 39 пациентов с различными заболеваниями, течение которых осложнилось мультиорганной дисфункцией с превалированием синдрома острой печеночной недостаточности и интоксикации, в возрасте от 35 до 73 лет. Среди обследованных больных было мужчин - 21 (53,8 %) и 18 женщин (46,2 %). Основными причинами острой печеночной недостаточности были: вирусные гепатиты - 13 пациентов (33,3%), токсический гепатит - 7 пациент (17,9%), сепсис - 13 пациента
Микробиологическое исследование, направленное на выделение возбудителя и - при его выявлении - на определение его чувствительности к антибиотикам для подбора оптимальной терапии пародонтита. При выявлении патогенных и/или условно-патогенных микроорганизмов будет определена их чувствительность к антимикробным препаратам (антибиотикам и бактериофагам). При обнаружении микроорганизмов, составляющих нормальную микрофлору, чувствительность к антибиотикам и бактериофагам не определяется, т.к. не имеет диагностического значения.
Посев на факультативно-анаэробную бактериальную флору; микрофлора при заболеваниях тканей пародонта; посев на анаэробы; посев на анаэробные бактерии; анаэробные бактерии, посев, отделяемое десневого кармана.
Какой биоматериал можно использовать для исследования?
Мазок из десневого кармана.
Как правильно подготовиться к исследованию?
- Не проводить туалет полости рта в день взятия биоматериала на исследование.
Общая информация об исследовании
Десневым, или зубодесневым, карманом является углубление между десной и зубом. Если данное углубление патологически увеличивается, то речь идет о возникновении пародонтального кармана. В процессе развития пародонтита происходит воспаление десны вследствие воздействия бактериальных агентов. Изменения, связанные с возникновением патологического зубодесневого кармана, связаны с изменением микробного состава зубного налета. В норме в тканях десны содержится незначительное количество бактерий: палочки и кокки. При воспалении увеличивается количество подвижных палочек и спирохет. Наличие пародонтального кармана можно заподозрить при жалобах на локализованные боли, при утолщении десны, десневых кровотечениях и нагноениях, при подвижности зубов, сине-багровом цвете десневого края. Основным диагностическим методом является зондирование десневого края вдоль каждой поверхности зуба. Содержимое десневого кармана состоит в основном из смеси микроорганизмов, лейкоцитов и продуктов их жизнедеятельности, остатков пищи, остатков эпителиальных клеток. Изменение зубодесневого прикрепления вследствие пародонтита может иметь постоянный прогрессирующий характер, при котором выделяют периоды ремиссии и обострения. Если во время ремиссии воспалительная реакция снижена или вообще отсутствует, то во время обострения наблюдается увеличение клинических проявлений с наличием десневого экссудата, в котором можно определить большое количество подвижных бактерий и спирохет. В лечении используются различные методы: антибактериальная терапия, кюретаж, хирургическое лечение и др., в том числе комбинации различных методов.
Анаэробная микрофлора – это микроорганизмы, для жизнедеятельности и размножения которых не требуется кислород, для многих из них он, наоборот, является губительным. Анаэробы населяют организм человека в норме (в пищеварительном тракте, органах дыхания, мочеполовой системе). При снижении иммунитета или травмах, повреждениях возможна активация инфекции с развитием воспалительного процесса. Организм человека тогда может становиться по сути источником заражения сам для себя (эндогенное инфицирование). Реже анаэробы попадают в организм снаружи (глубокая колотая рана, инфицированный аборт, ранения брюшной и грудной полости, введение спиц и протезов). Развиваясь в толще кожи, мягких тканей и мышц, анаэробные организмы способны вызывать целлюлиты, абсцессы, миозиты. Симптомы, позволяющие заподозрить анаэробную инфекцию мягких тканей: плотный отёк, газообразование (ощущение, что лопаются пузырьки воздуха под кожей при надавливании), гнилостное воспаление, зловонный запах.
Основное лечение анаэробного воспаления – хирургическое. При этом необходимо устранить источник воспаления либо раскрыть рану, обеспечив доступ кислорода, губительного для анаэробов.
Для дифференциальной диагностики анаэробной и аэробной инфекции проводят посев биоматериала на флору, так как принципы лечения в том или ином случае будут разные. Анаэробные микроорганизмы обладают чувствительностью к довольно узкому спектру антибактериальных препаратов, поэтому целесообразно проводить лекарственную терапию после определения чувствительности к антибиотикам. По выросшей культуре определяется вид микроорганизмов, которые участвуют в формировании воспалительной реакции. Зная вид возбудителя, можно подобрать антибактериальный препарат, который способен успешно влиять на данные микроорганизмы и способствовать более эффективной санации пародонтальных карманов.
После выявления культуры бактерий целесообразно провести определение их чувствительности к разным антибиотикам. В связи с тем что все чаще наблюдается развитие антибиотикорезистентности микроорганизмов, подбор антибиотиков по их спектру действия на бактерии может привести к малоэффективному или вообще безрезультатному лечению. Преимуществом метода определения чувствительности к антибиотикам является точное определение антибактериального препарата, имеющего наивысшую эффективность в конкретном случае.
Перечень проверяемых антибиотиков:
Ванкомицин / 5 мкг
Клиндомицин / 2 мкг
Эритромицин / 15 мкг
Амоксициллин клавуланат / 20/10 мкг
Метронидазол / 50 мкг
Канамицин / 30 мкг
Для чего используется исследование?
- Для комплексной диагностики пародонтита и заболеваний пародонта;
- для дифференциальной диагностики анаэробной и аэробной инфекций, для подбора адекватного терапевтического лечения с учетом обнаруженной микрофлоры;
- для контроля проведенной терапии пародонтита или воспалительных процессов в десневом канале.
Когда назначается исследование?
- При воспалительных процессах в области зубодесневых карманов;
- при кровоточивости десен, болезненности десен, появлении запаха изо рта;
- при изменении положения зубов, появлении промежутков между зубами;
- при появлении гнойно-воспалительных процессов в области зубов, абсцессов.
Что означают результаты?
В норме анаэробы в диагностически значимых количествах не высеваются.
Причина выявления микроорганизмов - присутствие роста колоний данного вида микроорганизмов на питательной среде.
Кто назначает исследование?
Стоматолог, стоматолог-пародонтолог, инфекционист, терапевт, врач общей практики, оториноларинголог, педиатр.
Литература
- Fermin A Carranza, Paulo M. Camargo. The Periodontal Pocket. / Carranza's Clinical Periodontology, 2012, 127-139.
- Mirela Kolakovic, Ulrike Held, Patrick R Schmidlin, Philipp Sahrmann. An estimate of pocket closure and avoided needs of surgery after scaling and root planing with systemic antibiotics: a systematic review. / BMC Oral Health. 2014; 14: 159.
Иногда обычных обследований зубов недостаточно для того, чтобы точно определить диагноз или назначить целенаправленное эффективное лечение и профилактику нового заболевания. В этом случае осуществляются дополнительные исследования, некоторые из которых применяются и в других областях медицины.
Клинический анализ крови
Клинический анализ крови – это едва ли не самое частое лабораторное исследование, в ходе которого определяют число эритроцитов, содержание гемоглобина и т.п. Это позволяет выяснить, насколько тяжела болезнь и каковы реактивные способности организма.
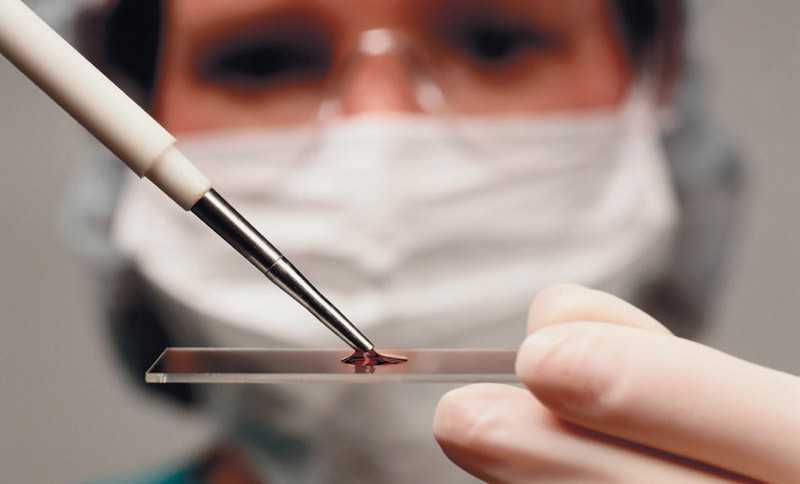
Гистологическое исследование
Этот метод исследования используют для того, чтобы установить или подтвердить диагноз при наличии труднозаживающих язв, опухоли, инфильтрации или других поражений полости рта. Материал для исследования берется с участка на границе патологической и здоровой ткани. Сейчас этот метод часто заменяют цитологическим исследованием.
Цитологическое исследование
Данное исследование проводится для изучения динамики состояния слизистой под протезом, либо для проведения дифференциальной диагностики воспалительных процессов слизистой полости рта и разнообразных онкологических заболеваний.
Электроодонтодиагностика
Этот метод позволяет оценить возбудимость чувствительных нервов зуба в ответ на их раздражение током. Если зуб полностью здоров, то порог его раздражения находится в районе двух-шести мкА. При глубоком кариесе порог повышается до 20 мкА, при воспалении пульпы – до 20-50 мкА. Если коронковая часть пульпы погибла, то порог чувствительности возрастает до 60 мкА, а если погибла еще и корневая пульпа, то он доходит до сотни микроампер.
Термоодонтодиагностика
Данный метод также представляет собой оценку состояния возбудимости нервов зуба, но уже при помощи температурного раздражителя. Для этого применяется охлажденная вода, поток воздуха и разогретая гуттаперча. Если при воздействии температуры болевая реакция возникает, но резко проходит, то можно говорить о кариозном процессе. Если же боль сильная и при этом длительная, то существует вероятность воспалительного процесса уже в пульпе зуба.
Реодентография
Этот метод позволяет оценить состояние пульпы зуба на основании графической регистрации потока крови по сосудам пульпы. При помощи этого метода можно отличить друг от друга средний кариес и глубокий кариес, глубокий кариес и пульпит и различные формы пульпита, а также в целом определить витальность зубной пульпы. Реодентографию применяют для того, чтобы проконтролировать состояние пульпы зуба после его одонтопрепарирования под коронку либо для оценки состояния тканей под коронками.
Создание диагностической модели челюстей
При помощи диагностической модели можно поставить диагноз, проконтролировать лечение, оценить начальное состояние и его изменения. Многие измерительные приемы можно осуществить только на модели, а некоторые с ее помощью делать намного удобнее.
Обследование больного при наличии металлических включений
Для создания зубных протезов в стоматологии используют нержавеющую сталь, припой, а также титановые, золотые, золото-платиновые, серебряно-палладиевые и кобальто-хромовые сплавы. В составе этих материалов может содержаться больше десятка металлов, так что при создании коронок и протезов очень важно тщательно соблюдать технологию изготовления. Любое нарушение может спровоцировать патологическую реакцию на протез. Микроэлементы с протезов могут поступать в слюну из-за износа металлической поверхности, коррозии и по ряду других причин. А если в полости рта присутствует два металла, то в составе со слюной создается гальванический элемент, продуцирующий ток. Микротоки, в свою очередь, способны вызывать парестезию, плоский лишай и лейкоплакию.
При клиническом обследовании людей с металлическими протезами в стоматологическую карту больного нужно внести множество данных:
- Время появления жжения или привкуса металла, их характер и интенсивность;
- Время протезирования;
- Материал и внешний вид протеза;
- Количество единиц в протезе;
- Количество паяных соединений;
- Состояние слизистой;
- Лечился ли пациент до этого момента и к чему привело лечение.
Также важно собрать данные клинико-лабораторных исследований, может даже понадобиться общеклиническое обследование и заключение от невропатолога и терапевта. При объективном обследовании обязательно нужно оценить состояние слизистой: ее влажность, цвет, отечность и наличие патологических изменений и эрозий.
Определение электрохимических потенциалов с помощью биопотенциометра
Суть этого метода заключается в следующем: один электрод, обычно хлористоводородный, приводится в контакт с областью под языком. Второй электрод поочередно подносят к заранее выбранным участкам слизистой или к имеющимся искусственным включениям, таким как протезы, пломбы, вкладки и т.п. В норме разница потенциалов не должна быть больше 50 мВ. Если же регистрируются большие значения, то нужно провести тщательное обследование и выяснить и устранить причинное металлическое включение.
Определение порога вкусовой лабильности
Суть данного метода в определении состояния вкусового анализатора в зависимости от показателей порогов вкусовой чувствительности и длительности скрытого периода ощущений. Порог определяется при помощи различных веществ:
- На сладкое – раствора глюкозы в концентрации от 0,1 до 20% и выше;
- На соленое – раствор поваренной соли от 0,1% и выше;
- На кислое – вино-каменную кислоту в концентрации -0,15% и больше;
- На горькое – раствор хинина соляно-кислого в очень малых концентрациях – от 0,0002% и выше.
За вкусовой порог принимается величина минимальной концентрации, при которой вещество характеризуется пациентом правильно. Проводят исследование спустя полтора-два часа после приема пациентом пищи.
Исследование слюны
Это исследование проводят не только при наличии во рту металлических включений – оно также помогает определить количество слюны, скорость ее секреции, вязкость, количество осадка и содержание в ней неорганических и органических компонентов. При обследовании при наличии металлических включений роль также играет рН слюны.
В среднем за сутки у человека вырабатывается один литр слюны. Если у пациента есть жалобы на повышенное слюноотделение или наоборот, сухость во рту, то определяется скорость слюноотделения. Для этого пациент 20 минут сплевывает слюну в пробирку. Сбор слюны осуществляется утром и натощак.

По количеству слюны в пробирке определяется скорость слюноотделения, потенциометрически определяется рН слюны, остальные показатели определяются при анализе собранной жидкости.
Другие инструментальные методы исследования
- Определение угла наклона зуба или зубов;
- Зубовреопародонтография;
- Эхоостеометрия;
- Измерение выносливости зубного аппарата к горизонтальной и вертикальной нагрузке;
- Полярография;
- Гнадинамоментрия;
- И т.п.
Все эти методы применяются для того, чтобы установить или уточнить диагноз. Из в стоматологии очень много, и они используются в разных клинических случаях и по различным показаниям.
Что такое цитологическое исследование
Цитологическое исследование — одно из самых востребованных в онкологии. С его помощью врач оценивает состояние клеточных элементов и делает заключение о злокачественной или доброкачественной природе новообразования. Изучаются особенности строения клеток, клеточный состав органов, тканей, жидкостей организма человека. Цитологическое исследование применяется при диагностике предраковых заболеваний и злокачественных новообразований различных органов: шейки и тела матки, молочной железы, щитовидной железы, легких, кожи, мягких тканей и костей, желудочно-кишечного тракта, лимфатических узлов и др. Для цитологического исследования берут мазки свода влагалища и шейки матки, мокроту, мочу, экссудаты из полостей и т.д.
Когда назначается цитологическое исследование?
В большинстве случаев врачи – терапевты, гинекологи, онкологи и другие специалисты — прибегают к цитологической диагностике при подозрении на опухолевое заболевание.
Цитологический метод применяется для исследования новообразований в различных органах – кожа, молочная железа, лёгкие, средостение, печень, почки, забрюшинные образования, щитовидная железа, предстательная железа, яичко, яичники, лимфатические узлы, миндалины, слюнные железы, мягкие ткани, кости и др.
Наибольшее распространение цитологические исследования получили в области гинекологии. Это доступный и быстрый метод скрининга, доказавший свою эффективность в диагностике предраковых заболеваний и раннего рака шейка матки.
Нередки случаи, когда цитологическое исследование помогало обнаружить рак желудка, легкого, мочевого пузыря и др. на самых ранних стадиях, когда рентгенологические и эндоскопические исследования не выявили изменений.
В период лечения опухолевого заболевания необходимо постоянно контролировать эффективность проводимой терапии. Для этого необходимы быстрые и эффективные методы диагностики. Цитологическое исследование в этих случаях позволяет оперативно получить ответы на большинство возникающих у врачей вопросов по поводу течения болезни. Цитологическое исследование широко используется также и после окончания специализированного (хирургического, химиотерапевтического или лучевого) лечения для контроля течения заболевания и раннего выявления возможного рецидива или прогрессирования опухоли (исследование лимфатических узлов, плеврального экссудата и т.д.).

Основные области применения цитологических исследований в онкологии:
- Скрининг, профилактические осмотры
- Диагностика – установление и уточнение диагноза
- Контроль результатов во время и после проведения терапии
В чем отличие цитологии от гистологического исследования?
Отличие цитологического исследования от гистологического, в первую очередь, заключается в том, что изучаются именно клетки, а не срезы тканей. Для гистологического исследования требуется либо операционный материал, либо забор материала методом трепан-биопсии. Для цитологического же исследования достаточно мазка со слизистой оболочки, соскоба с поверхности опухоли или материала, полученного тонкой иглой.
Подготовка гистологического препарата требует больше усилий и времени, нежели подготовка для цитологического анализа.
Как выполняется цитологическое исследование?
Для анализа используют различный биоматериал.
Эксфолиативный материал, то есть полученный методом «слущивания»:
- соскобы с поверхности эрозий, ран, язв;
- соскобы с шейки матки и цервикального канала, аспираты из полости матки;
- секреты желез, экскреты, мокрота, транссудаты, экссудаты, промывные воды и т.д.
- Исследование мочи на атипические клетки
Пункционный материал:
- пунктаты, полученные тонкой иглой (тонкоигольная биопсия)
- отпечатки материала трепан-биопсий из опухолей и различных новообразований
Операционный материал:
- мазки-отпечатки и соскобы с удаленной ткани, жидкость, смывы и др. материал, полученный при проведении хирургических вмешательств.
Эндоскопический материал:
- материал, полученный при проведении эндоскопического исследования
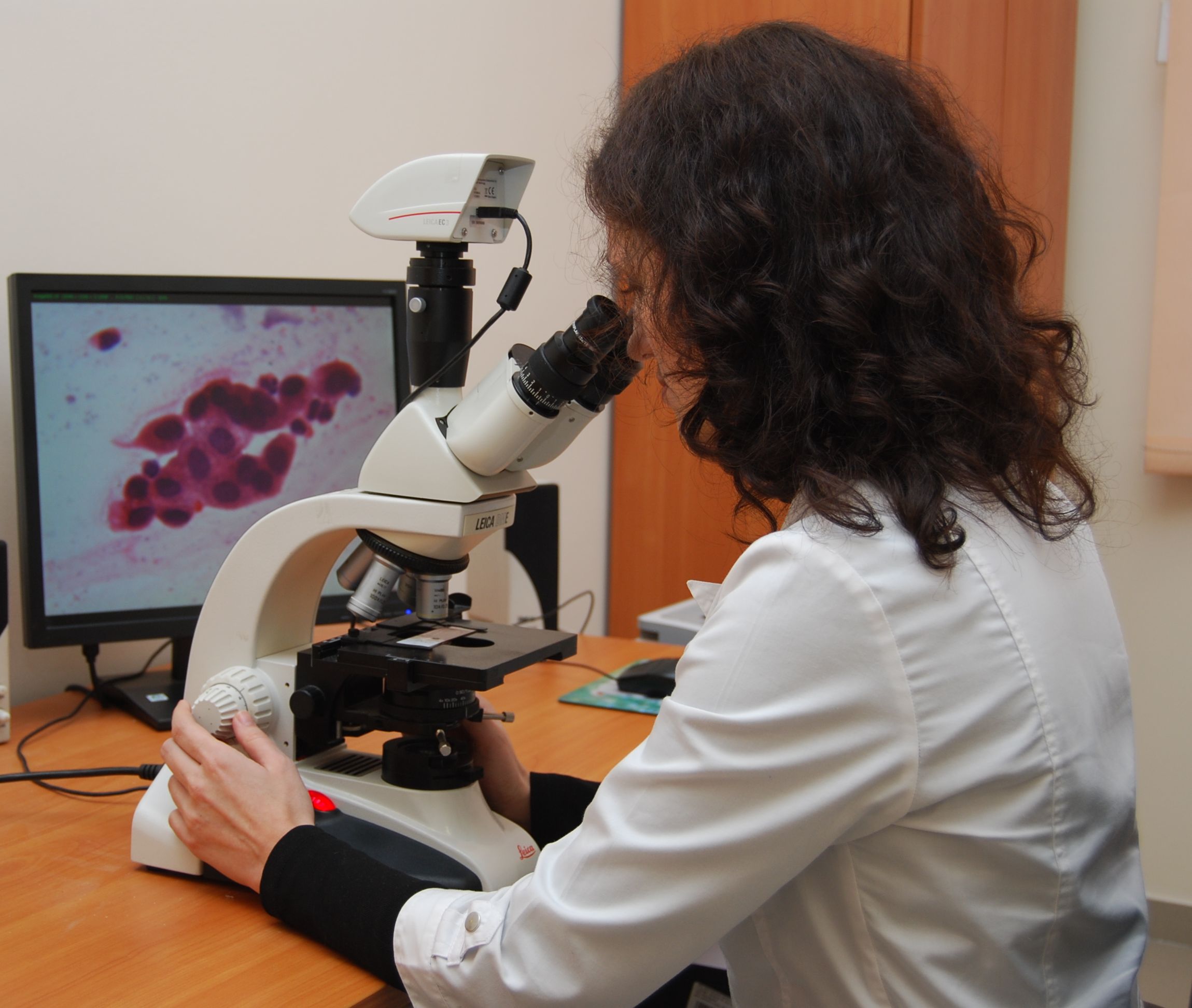
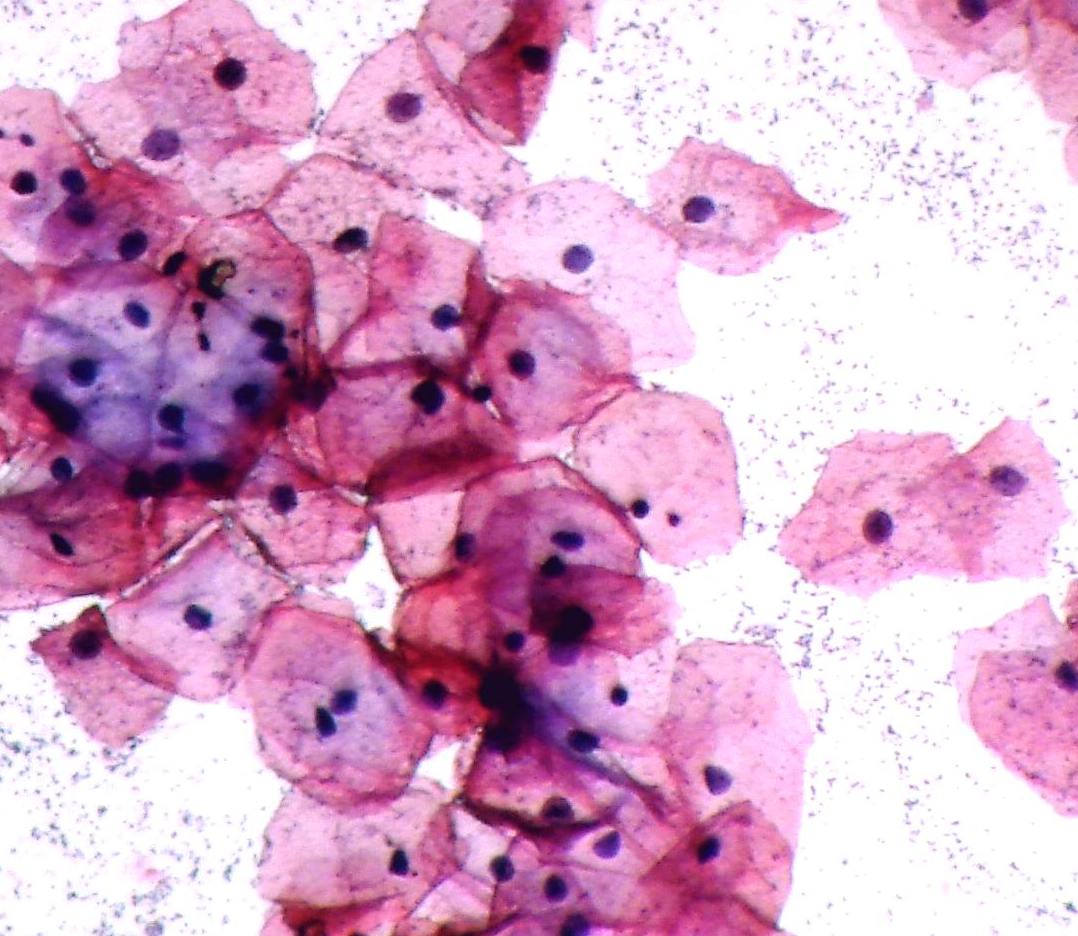
Цитологическое исследование — наиболее щадящий метод диагностики. Обычно забор материала для анализа протекает безболезненно, в амбулаторных условиях, без травматического воздействия на органы и ткани.
Взятый для анализа клеточный материал в цитологической лаборатории переносят на предметные стекла, окрашивают и исследуют под микроскопом.
Цитоморфолог использует в своей работе совокупность признаков атипии клетки, критически оценивая их наличие и степень выраженности. Результат анализа напрямую зависит от профессионализма специалиста, проводящего исследование: как в части подготовки материала, так и в части его исследования под микроскопом.
На поверхности опухолевых клеток есть особые белки – антигены. Причем, каждая опухоль экспрессирует свой собственный набор антигенов. При необходимости с помощью специальных реактивов для иммуноцитохимического исследования врач-цитолог может не только установить наличие злокачественно трансформированных клеток в исследуемом образце, но и определить гистотип опухоли, ее органную принадлежность, факторы прогноза и чувствительность к лечению.


Достоинства цитологического метода:
- абсолютная безвредность для пациента
- безболезненность
- возможность применения многократных цитологических исследований
- быстрота
- диагностика злокачественных опухолей любой локализации и в любой стадии процесса.
Обычно для проведения исследования требуется несколько часов. Интраоперационное цитологическое исследование может быть выполнено в течение 10 минут.
За счет его безвредности, цитологический метод незаменим для оценки динамики морфологических изменений в клетках опухоли во время лечения, для определения терапевтического эффекта проводимого лечения. Для таких пациентов он имеет несомненные преимущества перед другими, более инвазивными методами исследования.
Методы цитологических исследований постоянно совершенствуются. Развитие эндоскопической техники позволяет целенаправленно получать материал для исследования из внутренних органов, ранее недоступных для морфологического анализа без оперативного вмешательства.
Таким образом, цитологическое исследование, благодаря сочетанию высокой информативности, безвредности для пациента и скорости проведения, при отсутствии травматизации тканей, имеет огромное значение в онкологии.


Авторская публикация:
Михетько Андрей Александрович
заведующий лабораторией цитологии НМИЦ онкологии им.Н.Н. Петрова,
врач клинической лабораторной диагностики (цитолог) высшей квалификационной категории, кандидат медицинских наук.
Читайте также:

