При пародонтите ph слюны и десневой жидкости
Опубликовано: 24.07.2024
Идеальный уровень кислотно-щелочного баланса для ротовой полости равен pH=7. В случае, если кислотность преобладает, среда становится кислой (рН снижается), если щелочей больше - рН увеличивается.
Чем выше кислотность, тем с большей вероятностью создается благоприятная среда для развития микроорганизмов. Кислая среда возникает, например, после употребления богатой углеводами пищи. Поэтому после приема таких продуктов необходимо почистить зубы, либо прополоскать водой рот, чтобы уменьшить концентрацию кислоты.
Больше всего на состояние кислотно-щелочного баланса влияет питание. В каждом продукте согласно таблицы Уокера преобладают либо закисляющие, либо защелачивающие вещества, которые очень быстро сдвигают рН в кислую или в щелочную сторону. Регулирование кислотно-щелочного баланса осуществляется прежде всего за счет правильного и последовательного сочетания кислотно-образующх и щелочеобразующих продуктов питания.
Как правильно питаться, чтобы баланс здоровья зубов был в норме? Прежде всего – ограничение употребления углеводов, особенно простых: сахара, сладостей, кондитерских изделий.
Сахар – главный враг зубов. Больше всего вредит не количество сладкого, а количество его приемов в заданный промежуток времени. Для здоровья зубов менее вредно съесть 10 конфет за один приём, чем такое же количество в течение, например, дня по 1 конфете.
Лимонная кислота - еще один враг наших зубов. Её добавляют во все газированные напитки в качестве консерванта и усилителя вкуса (прежде всего это - сладкие напитки). Она разрушает эмаль, делает её рыхлой и приводит к ее эрозии. Если не можете отказать себе в употреблении таких напитков, пейте их через соломинку, а затем полощите рот водой. Чистить зубы сразу же после приема газировки не следует, так как зубная щётка может повредить размягчённую зубную эмаль.

Индийские исследователи ещё раз подтвердили , что потребление сыра и других молочных продуктов восстанавливает кислотно-щелочной баланс и эффективно защищает зубы от кариеса.
В результате исследования, проведенного с 68 добровольцами в возрасте от 12 до 15 лет были определены уровни кислотно-щелочного баланса в полости рта до и после потребления сыра, молока и йогурта, не содержащего сахар. На основании исследований был сделан выжный вывод - уровень рН Симптомы и последствия закисления полости рта.
Признаками закисления полости рта являются:
- чувствительность зубов;
- оскомина при употреблении горячих и кислых продуктов;
- кислый привкус слюны;
- развитие кариеса;
- трещины на эмали или крошение зубов;
- мигрирующая зубная боль;
- обнажение корней зубов.
Ежедневное «кислое» питание приводит к хроническому пожизненному закислению внутренней среды организма, что с высокой вероятностью способствует развитию таких «болезней цивилизации» , как атеросклероз, гипертония, диабет. При снижении зачения рН отмечаются нарушение иммунной реакции, быстрое размножение вирусов, бактерий и болезнетворных грибков.
Еще в 1932 году Отто Варбург получил Нобелевскую премию по химии за определение условий жизни злокачественных опухолей. В результате его исследований установлено, что клетки опухоли, а так же бактерии и потогенные микроорганизмы, великолепно размножаются при закислении крови при условии снижения величины рН ниже 7,2-7,3 едениц. При нормализации рН опухоль вначале прекращает рост, а затем полностью рассасывается! Если рН крови в норме, то чужеродные бактерии и микроорганизмы не имеют условий для размножения. Если же рН падает резко в сторону окисления и «буферная» зона организма не справляется с этим состоянием, то в жертву приносится скелет, так как в целях ощелачивания необходимые для этого магний и кальций вымываются из костей, что приводит к развитию остеопороза и кариеса. В ответ на закисление организм выбрасывает в кровь избыточное количество кальция, который тут же стремится вывести, но не выводит, а откладывает на поверхности костей и суставов, а так же в почках и желчном пузыре. Отмечается также помутнение хрусталика глаза, ускоряется развитие катаракты и т.д.
Помимо питания причинами закисления организма являются безусловно стрессы, сильные переживания, малоподвижный образ жизни, недостаток свежего воздуха, агрессивное влияние бытовой техники (компьютер, телевизор, микроволновая печь, сотовые телефоны и пр.)

Важным условием сохранения здоровья организма и зубов является поддержание кислотно-щелочного баланса на должном здоровом уровне. Восстановление рН до нормального значения приводит к тому, что отложение солей (камни, песок) рассасывается, а организи благодарит за это хорошим самочувствием.
Есть ещё один фактор нашего здоровья – оптимизм. Если человек заряжен оптимизмом, верой в свою цель, в свою мечту, в собственные силы, горит желанием добиться своего — организму хватит энергии для поддержания рН, а значит и для поддержания здоровья. Эта энергия необходима почкам для полноценной работы и сохранения кислотно-щелочного баланса в крови.
Стрессы и переживания отнимают жизненные силы, гасят «внутренний» огонь. Когда человек «потух» и «перегорел», тогда организму собственной энергии уже не достаточно. Почки при этом не могут удержать баланс и организм теряет щелочные ингредиенты, уровень рН падает и приходят болезни.

Хронический генерализованный пародонтит (ХГП) сопровождается не только глубокими функциональными расстройствами зубочелюстной системы, но и серьезными метаболическими нарушениями в тканях пародонта, что поддерживает хронизацию процесса, ухудшает состояние местной резистентности, создает условия для дальнейшей утраты зубов. В диагностике заболеваний органов и тканей ротовой полости большую роль отводят биохимическим исследованиям ротовой жидкости, поскольку ХГП сопровождается не только морфологическими поражениями со стороны тканей пародонта, но и серьезными отклонениями в биохимических показателях, что отражает глубину нарушения метаболических процессов в ротовой полости. Рядом авторов установлены закономерности между развитием и тяжестью воспалительного процесса и изменениями физико-химических показателей ротовой жидкости [1, 3, 5, 6, 10]. В связи с этим применение комплексного клинико-биохимического анализа состояния полости рта является достаточно перспективным способом прогнозирования течения патологического процесса при заболеваниях пародонта [2, 12, 15]. В развитии воспалительных заболеваний тканей пародонта большую роль играют микроорганизмы, агрессивность действия которых обусловлена наличием в их мембранах протеолитических ферментов и эндотоксинов, способных поражать пародонт.
В регуляции иммунных и метаболических процессов большую роль отводят лизоциму, ферменту, который инициирует синтез лимфокинов, участвует в регуляции роста клеток и их дифференцировке, стимулирует метаболические процессы, способен инактивировать изоантигены, имеющие в составе гликозаминогликаны и гликопротеины [8]. Исследования химического состава ротовой жидкости, определение факторов неспецифической и специфической защиты ротовой полости позволяют решать вопросы как диагностики, так и выбора тактики рационального лечения пациентов.
Целью настоящей работы являлись изучение особенностей биохимического состава ротовой жидкости, определение факторов неспецифической защиты ротовой полости при ХГП.
Материал и методы
Наблюдения были выполнены на базе стоматологической поликлиники ГБОУ ВПО «Кубанский государственный медицинский университет». Все пациенты c отягощенным пародонтологическим статусом, которые дали согласие на участие в проведении данного исследования, состояли на диспансерном учете по заболеваниям пародонта различной степени тяжести. Первую группу составили пациенты с ХГП (n = 105 человек), контрольную группу составили люди без признаков ХГП (n = 35 человек).
Забор ротовой жидкости у пациента осуществлялось во время максимальной секреции слюны в утренние часы (с 9 до 11 часов) натощак или через 1,5- 2,0 часа после приема пищи. Перед взятием ротовой жидкости (за один час) осуществлялось полоскание рта дистиллированной водой, а также исключались факторы, влияющие на секрецию слюнных желез (физические нагрузки, эмоциональный стресс, жевательные резинки, курение). Ротовую жидкость собирали в градуированную пластиковую пробирку методом сплевывания в течение 6 минут. Объем секретируемой ротовой жидкости определяли в мл. Скорость слюноотделения рассчитывали путем деления общего объема собранной ротовой жидкости на время сбора (6 минут), выражали в мл/мин [6]. Полученную ротовую жидкость центрифугировали в течение 15 минут при 3000 об./мин. Для дальнейшего исследования использовали как на досадочную жидкость, так и осадок.
Определение рН ротовой жидкости проводили потенциометрическим методом с использованием измерительных электродов с нормированными координатами рН изопотенциальной точки и комбинированным электродом. Для этих целей применяли рН-метр (ионометр «Эксперт-001», Беларусь).
Концентрацию белка в ротовой жидкости определяли с использованием красителя КумассиG-250, оранжевый цвет которого при связывании белка переходит в синий, максимум поглощения испытуемого раствора при этом смещается с 465 нм на 595 нм. Содержание белка выражали в г/л ротовой жидкости. Определение активности лизоцима в ротовой жидкости турбидиметрическим методом, активность фермента выражали в мг/мл ротовой жидкости [11]. Активность церулоплазмина (ЦП) определяли по методу [9], принцип метода основан на способности фермента - окислять диметилпарафенилендиамин с образованием продуктов, дающих розовое окрашивание. Интенсивность развивающейся окраски пропорциональна каталитической активности церулоплазмина. Активность выражали в мг/л ротовой жидкости.
Статистическую обработку экспериментальных данных проводили в соответствии с методами, принятыми в вариационной статистике, с использованием критерия t-Стьюдента и свободного программного обеспечения. Различия считали достоверными, когда вероятность ошибки составляла р
Актуальность. При генерализованном воспалительно-деструктивном процессе в пародонте отмечаются глубокие нарушения гомеостаза полости рта. Несомненную роль в патогенезе заболеваний пародонта играют процессы образования минерализованных над- и поддесневых назубных отложений [14, 20]. Считается [6], что влияние «зубной» бляшки и «зубного» камня не следует рассматривать только как местный фактор, поскольку их образование и активность зависят от состояния реактивности организма (изменение минерального и белкового состава слюны, десневой жидкости, их ферментативной активности).
Более высокая концентрация неорганического фосфата в смешанной слюне больных с воспалительными заболеваниями пародонта также создает условия для камнеобразования [12, 16, 17]. Весьма интересным является установленное сходство химического состава слюнных и мочевых фосфатных камней, что позволяет рассматривать сиало- и нефролитиаз как единый процесс патогенного минералообразования в организме человека [13, 15].
Интерес к изучению минеральных составляющих организма, его биологических жидкостей и тканей [8], возрос в последние годы со стороны представителей различных специальностей. Из 14 жидкостей организма только в трех (слюна, желчь, моча) могут образовываться камни [4, 5], т. е. камни в организме человека формируются в органах, активно участвующих в поддержании гомеостаза, водно-электролитном и кислотно-щелочном равновесии.
В процессах камнеобразования в почках и слюнных железах много общего. Установлено, во-первых, что усиление секреторной деятельности слюнных желез вызывает угнетение водо- и солевыделительной функции почек. Во-вторых, извитые канальцы почки, как и слюнные трубки, участвуя в солевом обмене организма, очень сходны по строению и функции. В-третьих, клиницистам известны примеры тесных взаимоотношений слюнных желез с мочеполовой системой человека [1].
Из 14 жидкостей организма только в трех (слюна, желчь, моча) могут образовываться камни
Мочекаменная болезнь — наиболее распространенная болезнь мочевой системы. Длительно протекающий нефролитиаз сопровождается стойким нарушением минерального обмена в организме [11]. Показано [3], что причинами образования камней являются нарушение минерального обмена веществ (в основном фосфорно-кальциевого).
Наличие анатомо-физиологической и функциональной взаимосвязи моче- и желчевыводящих путей считается доказанным. Желчнокаменная болезнь является распространенным (не менее чем у 10—15 % взрослого населения) заболеванием, развивающимся в любом возрасте. Если принять во внимание сведения об этиологии и патогенезе желчно- и мочекаменной болезней, то нельзя не заметить некоторого сходства в трактовке механизмов камнеобразования у больных и со слюнно-каменной болезнью [2, 7, 18]. Таким образом, актуальность проблемы множественных заболеваний в организме человека не вызывает сомнений.
Цель исследования
Определить параметры ротовой жидкости больных хроническим генерализованным пародонтитом (ХГП) при наличии патогенного минералообразования и без него.
Материал и методы
Исследовали ротовую жидкость 34 больных ХГП средней степени тяжести. Основную группу составили 24 пациента ХГП (рис. 1), ассоциированного с желчно-, моче- или слюнно-каменной болезнью, контрольную — 10 пациентов ХГП без указанной соматической патологии (без патогенного минералообразования).
Рис. 1. Минерализованные отложения у больного ХГП средней степени тяжести, ассоциированным с мочекаменной болезнью.
Ротовую жидкость собирали утром натощак или через 1—3 часа после приема пищи по 2 мл путем сплевывания в пробирку. Полученный образец центрифугировали при скорости 13 000 об./мин. в течение 6—10 мин. Надосадочную жидкость аспирировали и определяли в ней pH и электролиты (К+, Na+, Ca2+, HCO3-).
Исследования проводили на аппарате RADIOMETER ABL 80 FLEX (Дания) в биохимической лаборатории Смоленской областной клинической больницы (зав. Л. Н. Чемодурова). Количественные показатели результатов исследования рассчитывались автоматически. Полученная информация выдавалась в печатном варианте.
Результаты исследования и их обсуждение
Анализируя полученные данные (табл. № 1), следует отметить, что уровень ионизированного кальция в ротовой жидкости у больных ХГП средней степени тяжести с патогенным минералообразованием оказался достоверно ниже, чем у лиц с ХГП без патогенного минералообразования.
Таблица № 1. Биохимические показатели ротовой жидкости у больных ХГП с патогенным минералообразованием (пм) и без него (бпм).
Ключевые слова: пародонт, фосфатазы
Фосфатазы, ферменты класса гидролаз, катализирующие гидролиз сложных эфиров фосфорной кислоты в организме животных, растений и в микроорганизмах. Функция фосфатазы – поддержание уровня фосфата, необходимого для различных биохимических процессов, и, возможно, транспорт фосфата в клетку. В зависимости от химической природы расщепляемого субстрата различают монофосфатазы, гидролизующие моноэфиры фосфорной кислоты, и дифосфатазы, расщепляющие диэфиры фосфорной кислоты.
Фосфатазы играют важную роль в течении физиологических процессов тканей полости рта. В зависимости от того, при каком pH фосфатаза активна, различают щелочную фосфатазу с оптимумом действия при pH 9,2-9,6 и кислую фосфатазу с оптимумом действия при pH 3,4-6,2.
Впервые фосфатазы в слюне изучены и обнаружены в 1929 году (Demuth). Примерно половина фосфатаз слюны (кислая и щелочная) секретируется мелкими слюнными железами (Барабаш Р. и соавт. 1981), и они участвуют в фосфорно-кальциевом обмене, отщепляя фосфат от соединений фосфорной кислоты и, тем самым, обеспечивая минерализацию костей и зубов. При этом в качестве одного из наиболее важных механизмов регуляции метаболизма на границе слюна-эмаль отмечается так называемая необратимая абсорбция щелочной фосфатазы [3]. По мнению М. Житкова [2], быструю инкорпорацию кальция в реминерализуемую поверхность эмали в присутствии бета-глицерофосфата можно объяснить влиянием иммобилизованной в апатит щелочной фосфатазы.
Основной темой изучения слюнных фосфатаз в стоматологии является выяснение их роли в процессах де- и реминерализации эмали, и в целом ее проницаемости.
В отношении значения фосфатаз при заболеваниях пародонта, долгие годы исследования слюнных фосфатаз проводились исключительно с точки зрения их участия в формировании минерализованных назубных отложений. Однако в последние десятилетия акцент указанных исследований сместился в сторону изучения и выявления других механизмов участия данных ферментов в этиопатогенезе заболеваний пародонта.
Сравнительное изучение содержания фосфатаз и лактатдегидрогеназы в смешанной нестимулированной слюне у здоровых лиц и больных с болезнями пародонта (в возрасте 15-17 лет) показало (Васильева С. и соавт., 1988), что имеется высокая зависимость активности щелочной фосфатазы от воспалительного процесса в тканях пародонта, а в отношении кислой фосфатазы наблюдалась та же тенденция, однако с менее заметным увеличением количества фермента. Подобная зависимость выявлена также у беременных и лиц с гормональными нарушениями другого генеза с болезнями пародонта [8,10], при этом данная зависимость казалась наиболее значимой при пародонтите, чем при гингивитах. Аналогичные результаты также были получены T. Todorovic et al. [9], которые выводят положительные корреляции между активностью слюнных фосфатаз и десневыми индексами при болезнях пародонта в ранг наиболее значимых биохимических маркеров указанной болезни.
Имеются также данные о содержании фосфатаз в десневой жидкости и об изучении их возможного влияния на некоторые биологические параметры при патологии пародонта. Так, F. Yan et al. [13] и O. Daltaban et al. [5] установили, что при пародонтитах наблюдается повышение уровня щелочной фосфатазы в десневой жидкости, содержание которой проявляло тенденцию к снижению при лечении болезни. Кроме того, увеличение содержания щелочной фосфатазы в десневой жидкости отмечается также при периимплантитах [8], на основании чего некоторые авторы предлагают использовать данный тест в прогностических целях [14]. Более того, высказывается мнение [4], что повышенный уровень этого фермента отмечается именно в тех участках, где наблюдается прогрессивное течение потери зубо-десневого прикрепления.
Поскольку при пародонтитах наблюдается высокий уровень щелочной фосфатазы в периодонтальной связке, P. Gibert et al. [6] изучали сравнительное содержание данного фермента в сыворотке крови больных с заболеваниями пародонта и у здоровых лиц. Установлено, что при патологии пародонта активность сывороточной щелочной фосфатазы намного выше. В свою очередь, выяснена также некоторая возрастная динамика активности щелочной фосфатазы периодонтальной связки [11], которая сводилась к следующему: относительно высокий уровень у детей, с уменьшением ее концентрации после периода полового созревания.
Нами проведены сравнительные исследования по определению фосфатаз в слюне в норме (группа контроля – 20 лиц) и при начальных формах поражения пародонта (основная группа – 20 больных). Возрастной диапазон лиц в обеих группах составил 18–23 года. Оценка состояния тканей пародонта проводилась на основе индексных показателей кровоточивости десен, воспаления (РМА), а также анамнеза и субъективных жалоб больных. В основной группе у всех больных диагносцирован генерализованный хронический катаральный гингивит легкой и средней степени тяжести.
Набор нестимулированной слюны в стерильные пробирки проводился натощак и в одно и то же время суток (в 10 часов утра).
Определение щелочной и кислой фосфатаз в слюне проводили с использованием тест-наборов ALP-Col и ACP-kinetic. При этом в случае щелочной фосфатазы метод основан на катализируемой ALP реакции дефосфорилирования тимолфталеин монофосфата до тимолфталеина, количество которого тестируется по хромогенной реакции в щелочной среде (при длине волны 580-630 нм), а в случае кислой фосфатазы – метод основан на регистрации кинетики превращения α-нафтилфосфата до α-нафтола, образующем окрашенный комплекс с диазо-2-амино-5хлотолуеном (при 405 нм). При этом наши комментарии касаются только суммарной активности щелочной и кислой фосфатаз, без учета их изоформ.
Результаты проведенных сравнительных исследований по изучению активности слюнных фосфатаз в норме и при гингивитах представлены в таблице.
Таблица. Активность фосфатаз в слюне в норме и при начальных формах воспаления пародонта

Результаты наших исследований, в части активности слюнной щелочной фосфатазы при патологии пародонта, согласуются с мнением большинства исследователей о том, что болезни пародонта сопровождаются значительным увеличением активности данного фермента в слюне. В частности, наши исследования выявили статистически достоверное практически 5-кратное увеличение указанной активности уже в условиях начального поражения пародонта, что, несомненно, играет определенную роль в процессах, регулирующих проницаемость эмалевой поверхности зуба.
Вместе с тем в отношении ферментативной активности кислой фосфатазы, результаты наших исследований значительно отличаются с данными других авторов, указывающих на повышение уровня этой же группы фосфатаз при патологии пародонта. В нашем случае отмечена обратная тенденция – статистически достоверное снижение активности кислой фосфатазы при начальных формах поражения – гингивитах, с уровнем этого фермента в 22,3 % от среднего нормального значения (контрольная группа). Соотношение ферментативной активности фосфатаз в норме и при гингивитах более ярко представлено на рисунке.

Рисунок. Соотношение фосфатаз в группах исследования
Как показано на рисунке, кроме того что при гингивитах (основная группа – ОГ) отмечается весьма значительное увеличение щелочной фосфатазы и существенное снижение кислой фосфатазы, наблюдается также значительная разница в показателе внутригруппового соотношения фосфатаз (щелочная фосфатаза/кислая фосфатаза). Так, в основной группе этот показатель равен 56,09, а в контрольной группе (КГ) показатель составил всего лишь 2,55.
Таким образом, проведенные нами исследования выявили разнонаправленную активность щелочной и кислой фосфатаз при начальных поражениях пародонта. Указанная активность щелочной фосфатазы, в свою очередь, в известной степени может обусловить высокую интенсивность минерализации поверхности эмали со снижением ее центростремительной проницаемости к слюне. В этом отношении еще раз подчеркиваем значение количественного соотношения щелочной и кислой фосфатаз, т.к. проявляя наибольшую активность в принципиально разных средах (щелочная фосфатаза проявляет максимальную активность при рН 8,4—9,4, а оптимум рН для кислой фосфатазы находится в интервале значений рН между 4,7 и 6,0), они тем самым могут сыграть весьма важное значение в процессах регулирования эмалевой проницаемости.
Однако при интерпретации количественных показателей ферментативной активности слюнных фосфатаз могут быть разночтения, т.е. затруднения придания им конкретной значимости в сложной патогенетической цепи развития патологии пародонта: являются ли такие изменения фосфатаз в слюне результатом уже развившегося гингивита, или их количественные уровни влияют на структурно-функциональный статус поверхности эмали, и в результате этого – на пусковые механизмы развития болезни. С учетом этого, в дальнейших исследованиях обязательным образом нужно провести корреляционный анализ показателей ферментативной активности фосфатаз с другими структурно-функциональными характеристиками эмалевой поверхности и состояния тканей пародонта в целом.
Литература
- Барабаш Р.Д., Гукевич Е.К., Вакуленко Л.В., Бондаренко В.С. Источник ферментов в смешанной человеческой слюне. Вопр. мед. химии, 1981, м. 27, 1, с. 22-27.
- Житков М.Ю. Влияние иммобилизованной слюнной щелочной фосфатазы на процесс реминерализации. Стоматология, 1999, м. 78, 5, с. 12-15.
- Леонтьев В.К., Алексина О.А., Веселова М.Н., Полторак О.М., Чухрай Е.С. Иммобилизация ферментов в эмаль зуба и ее возможная роль в физиологии и патологии полости рта. Стоматология, 1992, 2, с. 6-7.
- Chapple I., Garner I., Saxby M., Moscrop H., Matthews J. Prediction and diagnosis of attachment loss by enhanced chemiluminescent assay of crevicular fluid alkaline phosphatase levels. J. Clin. Periodontol., 1999, 26, 3, p. 190-198.
- Daltaban O., Saygun I., Bal B., Baloş K., Serdar M. Gingival crevicular fluid alkaline phosphatase levels in postmenopausal women: effects of phase I periodontal treatment. J. Periodontol., 2006, 77, 1, p. 67-72.
- Gibert P., Tramini P., Sieso V., Piva M. Alkaline phosphatase isozyme activity in serum from patients with chronic periodontitis. J. Periodontal Res., 2003, 38, 4, p. 362-365.
- Kugahara T., Shosenji Y., Ohashi K. Screening for periodontitis in pregnant women with salivary enzymes. J. Obstet. Gynaecol. Res., 2008, 34, 1, p. 40-46.
- Plagnat D., Giannopoulou C., Carrel A., Bernard J., Mombelli A., Belser U. Elastase, alpha2-macroglobulin and alkaline phosphatase in crevicular fluid from implants with and without periimplantitis. Clin. Oral Implants Res., 2002, 13, 3, p. 227-233.
- Todorovic T., Dozic I., Vicente-Barrero M., Ljuskovic B., Pejovic J., Marjanovic M., Knezevic M. Salivary enzymes and periodontal disease. Med. Oral Patol. Oral Cir. Bucal., 2006, 1, 11, 2, p. 115-119.
- Unsal B., Saygun I., Daltaban O., Bal B., Bolu E. The relationship between periodontal status and alkaline phosphatase levels in gingival crevicular fluid in men with hypergonadotropic hypogonadism. Yonsei. Med. J., 2008, 29, 49, 1, p. 71-78.
- Van den Bos T., Beertsen W.Alkaline phosphatase activity in human periodontal ligament: age effect and relation to cementum growth rate. J. Periodontal Res., 1999, 34, 1, p. 1-6.
- Vassileva S., Zaprjanov M., Targova S. Comparative studies on lactate, proteins and enzymes in saliva of healthy and periodontitis sick juveniles. Stomatologiia (Sofiia), 1988, 70, 2, p. 1-4.
- Yan F., Cao C., Li X. Alkaline phosphatase levels in gingival crevicular fluid of periodontitis before and after periodontal treatment. Zhonghua Kou Qiang Yi Xue Za Zhi., 1995, 30, 4, p. 204-206.
- Zhou Z., Zhou J., Zou S., Wu X. Relation between alkaline phosphatase in gingival crevicular fluid of implant and the curing result. Zhongguo Yi Xue Ke Xue Yuan Xue Bao., 2001, 23, 1, p. 58-59.

24.03.2009

6461 Показ
Подслизистая основа — это рыхлая соединительная ткань, которая обнаруживается только в краевой части десны и в области переходной складки.
Гистохимическими исследованиями установлено, что в межклеточном веществе тканей десны обнаруживаются кислые и нейтральные мукополисахариды. Гликоген в основном локализован в соединительной ткани, а в эпителии его количество обратно пропорционально степени ороговения эпителия. В эпителиальном слое резкое увеличение количества гликогена отмечается при воспалении. Кислая фосфатаза максимальную концентрацию проявляет в шиловидном и поверхностном слоях эпителия, а щелочная фосфатаза в основном обнаруживается в соединительной ткани десны. В тканях десны присутствуют также эстеразы, редуктазы, дегидрогеназы, коллагеназы и другие ферменты, количество и активность которых неодинаковы в разных участках и слоях десны и зависят от функциональных особенностей данного участка.
Ороговевающий эпителий десны покрывает наружную стенку зубодесневой борозды, которая формируется после прорезывания и включения зуба в окклюзию. Внутренняя стенка, примыкающая к эмали зубов, представляет собой соединительный эпителий, который изначально является производным наружного слоя клеток редуцируемого эмалевого эпителия. Под эпителиальным пластом зубодесневой бороздки в виде густых петель располагаются сосуды — капилляры, артериолы и венулы, отличающиеся особо высокой проницаемостью сосудистых стенок.
Артерии в десну доставляют кровь по вестибулярной и оральной поверхностям из сосудистых ветвей надкостничных, периодонтальных и межзубных костных перегородок. Разветвляясь по ходу, артерии в собственно слизистой оболочке образуют плотную капиллярную сеть и артериовенозные анастомозы. В десне (особенно в сосочках) в большом количестве присутствуют так называемые запасные капилляры, которые находятся в спавшемся состоянии и начинают функционировать, когда основная капиллярная система не обеспечивает необходимой микроциркуляции (данная ситуация возникает при воспалении в пародонте).
Десневой желобок содержит жидкость, которую называют десневой, или сулькулярной, жидкостью. В нормальных условиях обнаруживается небольшое количество жидкости, а при патологии пародонта ее количество существенно увеличивается. Усиление тока десневой жидкости отмечается также при раздражении желобка (прием пищи, использование зубной щетки), а также при гормональных изменениях (половое созревание, беременность, прием гормональных препаратов и др.).
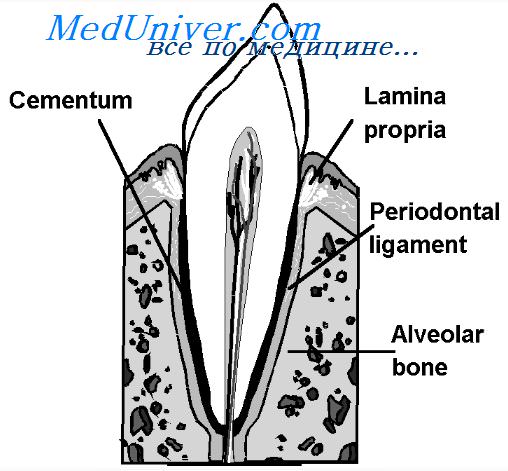
Десневая жидкость представляет собой воспалительный экссудат, который содержит клеточные элементы и многочисленные активные вещества. В ней обнаружены лимфоциты, лейкоциты, моноциты, клетки ороговевающего эпителия и микроорганизмы. Воспалительные клетки в десневой жидкости наблюдаются даже в условиях отсутствия патологических изменений в пародонте.
Наличие в десневой жидкости различных органических соединений (молочная кислота, мочевина и др.) является результатом не только их попадания из крови, но и жизнедеятельности микроорганизмов полости рта. В десневой жидкости обнаружены также другие органические и неорганические вещества: гиалуроновая кислота, сывороточные белки (альбумин, глобулин), иммуноглобулины (IgG, IgA, IgM), компоненты комплемента, ферменты (кислая и щелочная фосфатазы, лизоцим, лактатдегидрогеназа), ионы калия, кальция, магния и др.
Связочный аппарат периодонта расположен в периодонтальной шели, которая представляет собой пространство между поверхностью корня зуба и костной стенкой лунки зуба. Связочный аппарат состоит из коллагеновых (их большинство) и небольшого количества ретикулярных, эластиновых волокон, расположенных в виде пучков, между которыми находятся кровеносные и лимфатические сосуды, нервные окончания, клетки, межклеточное вещество. Ширина периодонтальной щели неодинакова в разных участках корня зуба: максимальная в области верхушки (0,26 мм), в пришеечной области составляет 0,24 мм и минимальная в средней части корня (0,11 мм) — именно поэтому ее сравнивают с песочными часами. В пришеечной части корня зуба пучки коллагеновых волокон почти перпендикулярны к корню, но чем ближе к верхушке корня, тем больше они наклонены.
Таким образом, корень зуба как бы подвешен в лунке. Различают горизонтальные волокна, располагающиеся вокруг пришеечной части зубов, вертикальные — в области верхушечной части и косые — шарпеевы — волокна. Шарпеевы волокна погружены в цемент и альвеолярную кость. Именно погруженные части связочного аппарата пародонта наиболее уязвимы и страдают в первую очередь при развитии воспаления в пародонте.
Коллагеновые волокна мало растяжимы, но очень упруги. Именно они передают напряжение при жевании на челюстные кости. Таким образом, периодонт выполняет функцию амортизатора жевательного давления. Высокая упругость коллагеновых волокон и наклонное их положение в периодонте способствуют возвращению корня зуба в исходное положение после снятия жевательной нагрузки.
В средней части периодонта у лиц молодого возраста имеется густое промежуточное сплетение, состоящее из волокон, которые обладают высоким регенераторным потенциалом. Это зикхеровское сплетение. В возрасте старше 25 лет оно постепенно исчезает. Для клиницистов это сплетение имеет значение для прогноза регенераторных возможностей периодонтальных структур, в частности при ортодонтическом лечении.
Читайте также:

