Как приготовить микропрепарат зубного налета
Опубликовано: 26.04.2024
Только совокупность всех доступных методов лабораторной диагностики позволяет всесторонне обследовать пациента для выявления этиотропного агента, постановки правильного диагноза и, соответственно, назначения адекватного лечения.
Методы лабораторной диагностики воспалительных заболевания тканей пародонта можно систематизировать следующим образом:
• микробиологические;
• иммунологические;
• биохимические;
• цитологические.
Развитие воспалительных изменений в пародонте является следствием повреждающего влияния зубного налета, бактериальная флора которого является первичным фактором, вызывающим поражения пародонта при гингивите и пародонтите.
Для адекватного лечения ВЗП необходимо знать механизмы формирования микробной зубной бляшки, как причинного фактора этих заболеваний.
Зубная бляшка является продуктом микробного размножения. Она состоит из микробных масс, которые прикрепляются к вторичной кутикуле (пелликуле).
Зубная бляшка — это структурированное формирование, состоящее, главным образом, из микроорганизмов, которое визуально определяется на зубах через 1 —2 дня после прекращения чистки зубов в виде белого, сероватого либо желтоватого зубного налета. Ее постоянный прогрессирующий рост сдерживается током слюны, движением губ, языка, пищевого комка, особенно на верхних 2/3 коронок зубов. Поэтому бляшка скапливается и созревает именно в придесневых областях и межзубных промежутках. В 1 мг субстрата зрелой зубной бляшки содержится до 300 млн микроорганизмов.
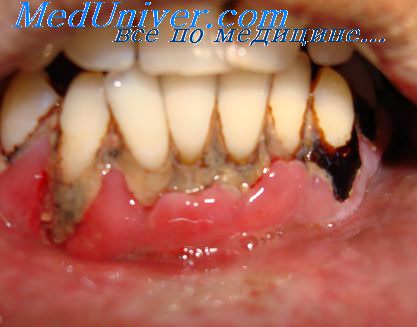
Наряду с плотно прикрепленной к зубу бляшкой существуют и рыхлые микробные скопления на стенках внутри ПК. В ряде случаев именно рыхло прикрепленные микроорганизмы имеют решающее значение в развитии агрессивных форм пародонтита.
В отличие от структурированной плотной тесно связанной с поверхностью зуба бляшки, мягкий зубной налет представляет собой неструктурированную аморфную практически не скрепленную с поверхностями зуба субстанцию. Эта субстанция состоит из микроорганизмов, слущившихся эпителиальных клеток, лейкоцитов и смеси слюнных белков и липидов с частицами пищи. Мягкий зубной налет легко определяется визуально без индикаторов и удаляется простой струей воды.
На основе исследования механизмов взаимодействия между различными бактериями налета и хозяином разработана классификация пародонтальных микробных комплексов. Микробные комплексы поддесневых бляшек различаются по частоте встречающихся в их составе микроорганизмов. Выделяют красный, зеленый, желтый, пурпурный, оранжевый микробные комплексы, которые также способны вызывать поражения пародонта и другие заболевания полости рта.
Данные литературы позволяют утверждать, что при поражениях пародонта как для диагностики, так и для выбора адекватного этиопатогенетического лечения необходим микробиологический анализ. Успех и неуспех лечения часто зависят от того, удается ли идентифицировать возбудителя того или иного заболевания.
В начале истории микробиологии микроорганизмы дифференцировали только с помощью красителей: например, микроорганизмы, окрашивающиеся красителем по Граму (грамположительные) и неокрашивающиеся (грамотрицательные). Разработанные более 100 лет назад техники окрашивания используются для идентификации отдельных видов микроорганизмов и сегодня.
При определении микрофлоры полости рта в настоящее время применяется целый ряд классических методов. Так, для изучения качественного состава микрофлоры идентифицируют микроколонии и/или микробные тела при микроскопии. Количественную оценку микрофлоры проводят путем посева на селективные и неселективные среды с последующим подсчетом колоний микроорганизмов. При выборе метода лечения оценивают чувствительность микрофлоры к лекарственным препаратам.
Вместе с тем за последние полтора столетия были разработаны и внедрены в лабораторную практику десятки новых методов изучения микрофлоры, такие как проточная цитометрия, серологические исследования, анализ белков, сравнение ДНК-последовательностей и др. Однако многие из этих методов требуют приготовления бактериальных культур, что радикально удлиняет время анализа (например, проточная цитометрия), к тому же после культивирования невозможно определить начальную концентрацию микроорганизма в образце, соотношение погибших и живых клеток.
Биохимические методы, основанные на определении специфических для каждого типа клеток соединений (ферментов, витаминов, кислот и пр.), также нельзя считать стопроцентно пригодными для идентификации, поскольку многие микроорганизмы имеют сходные характеристики.
Сравнительно недавно для идентификации бактерий стали использовать масс-спектроскопию. Масс-спектрометр сортирует молекулы клетки по соотношению молекулярная масса/заряд и составляет характеристические наборы значений для каждого типа клеток. Этот метод также ограниченно годен для диагностики, поскольку клетки разных видов микроорганизмов часто обладают очень сходными молекулами, а количество этих молекул может сильно варьировать на разных стадиях клеточного цикла.
Высокоспецифичными методами определения микробных антигенов являются иммуноблоттинг и полимеразная цепная реакция, но и они имеют свои недостатки.
- Вернуться в оглавление раздела "Стоматология."
На середину обезжиренного предметного стекла нанесите петлей 1-2 капли бульонной культуры.
Осторожно покройте каплю чистым покровным стеклом.
Микроскопируйте с приспущенным конденсором. Используйте объективы с увеличением 40 х.
Можно также использовать иммерсионный объектив 100х, нанося на покровное стекло одну каплю иммерсионного масла.
При исследовании живых бактерий следует отличать активную подвижность у отдельных микроорганизмов, свидетельствующую о наличии у них жгутиков, от пассивного броуновского движения (движение бактерий в одном направлении).
Экология микроорганизмов Изучение микрофлоры ротовой полости
Практические навыки, осваиваемые студентами на занятии:
Приготовление мазка из зубного налета, окраска простым методом, микроскопия и зарисовка препарата.
Приготовление мазка из зубного налета
На обезжиренное предметное стекло нанесите петлей каплю физиологического раствора.
В правую руку возьмите деревянную палочку (зубочистку) и проведите ею между зубами и у основания зубов, снимая небольшое количество зубного налета.
Погрузите палочку в каплю физраствора, равномерно распределите зубной налет по стеклу и приготовьте мазок в виде небольшого круга (d2см).
Прожгите в пламени спиртовки конец палочки, потушите и выбросьте ее в урну.
После полного высушивания зафиксируйте мазок.
Окраска мазка простым методом с использованием метиленового синего:
После охлаждения предметного стекла нанесите 1-2 капли водного раствора метиленового синего на фиксированный мазок (чтобы он был полностью покрыт краской).
Окрашивайте в течение 2-3 минут.
Смойте краску водой.
Просушите препарат фильтровальной бумагой.

Основы учения об инфекции Биологический метод исследования
Приготовление мазков-отпечатков из органов трупа инфицированной мыши, окраска по Граму, микроскопия и зарисовка препаратов.
Для приготовления мазков-отпечатков вырезают из печени, селезенки, почек небольшие кусочки ткани, берут их пинцетом и прикасаются к предметному стеклу, прижимая кусочек ткани к поверхностью разреза.
Мазки-отпечатки фиксируют и окрашивают метиленовым синим или по Граму.
При микроскопии отмечают присутствие микроба-возбудителя в различных органах и тканях.
Микробиологические основы химиотерапии бактериальных инфекций Методы изучения чувствительности бактерий к антибиотикам
Определение чувствительности бактерий к антибиотикам методом дисков.
Определение бактериостатического и бактерицидного действия антибиотиков.
Качественный метод определения чувствительности бактерий к антибиотикам (метод дисков).
Бумажные диски, пропитанные определенными антибиотиками, помещают на поверхность мясо-пептонного агара в чашках Петри, предварительно засеянных «газоном» исследуемой бактериальной культуры.
Посевы инкубируют в течение 16—24 ч, после чего учитывают результаты опыта по образованию светлых зон задержки роста бактерий вокруг дисков. По диаметру этих зон ориентировочно судят о чувствительности бактерий к антибиотикам.
Так, зоны диаметром до 15 мм указывают на слабую, а с диаметром до 25 мм — на среднюю и более 25 мм — на сравнительно высокую чувствительность исследуемого микроорганизма к антибиотику.
Количественный метод определения чувствительности бактерий к антибиотикам (определение бактериостатического и бактерицидного действия антибиотиков).
Данный метод считается наиболее точным для количественного определения чувствительности бактерий к антибиотикам.
Основной раствор антибиотика, содержащий, например, 100 ЕД/мл, готовят с помощью буферного раствора или специального растворителя.
Серийные разведения препарата (двукратные – 1:2 1:4 1:8 1:16 1:32 1:64 1:128) готовят в пробирках, содержащих 1 мл мясо-пептонного бульона: в 1-ю пробирку вносят 1 мл исходного раствора препарата, перемешивают и переносят в следующую, в которой уже содержится 1 мл МПБ, и т.д. – таким методом делают серию (ряд) последовательных разведений препарата от 50 до 0,39 ЕД/мл в равных объемах питательной среды.
В каждую пробирку вносят 0,1 мл испытуемой бактериальной суспензии, густотой 1 млрд/мл по оптическому стандарту. Одновременно ставят контроли — бактерий (1 мл мясо-пептонного бульона+ +0,1 мл суспензии бактерий) и антибиотика (мясо-пептонный бульон + антибиотик).
Посевы инкубируют, после чего отмечают результаты. Отсутствие помутнения среды свидетельствует о задержке роста бактерий в присутствии данной концентрации препарата.
Бактериостатической дозой или минимальной ингибирующей концентрацией (МИК) называется наименьшая концентрация антибиотика, в присутствии которой угнетается видимый рост бактерий.
Для определения бактерицидного действия препарата дополнительно производят высевы из пробирок, в которых отсутствует видимый рост бактерий, на чашки Петри с плотной питательной средой, не содержащей антибиотика.
Наименьшая концентрация антибиотика, вызывающая полную гибель испытуемых бактерий, о чем свидетельствует отсутствие роста на агаре без антибиотинка, называется минимальной бактерицидной концентрацией (МБК).
2. Статистические данные развития кариеса в с. Новоселенгинск
3. Изучение причины возникновения кариеса с точки зрения микробиологии.
4. Методика проведения исследований, по изучению микрофлоры ротовой полости (практическая часть).
5. Результаты исследований.
6. Изучение и классификация предметов гигиены ротовой полости.
7. Комплекс мер по профилактике заболеваний кариесом.
8. Список литературы.
| Вложение | Размер |
|---|---|
| mikroflora_zubnoy_polosti.doc | 982.5 КБ |
Предварительный просмотр:
Государственное бюджетное общеобразовательное учреждение
«Новоселенгинская школа-интернат среднего общего образования»
ГИсследовательская работа на тему:
«Микрофлора ротовой полости и ее влияние на состояние зубов»
Автор работы: Ларионов Никита
Руководитель: Дугаржапова Т.Д.
Учитель биологии 1К
- Введение
- Статистические данные развития кариеса в с. Новоселенгинск
- Изучение причины возникновения кариеса с точки зрения микробиологии.
- Методика проведения исследований, по изучению микрофлоры ротовой полости (практическая часть).
- Результаты исследований.
- Изучение и классификация предметов гигиены ротовой полости.
- Комплекс мер по профилактике заболеваний кариесом.
- Список литературы.
В течение последних 120 лет исследователи-стоматологи пытаются понять микробную природу болезней ротовой полости. Специалисты считают, что в ротовой полости человека постоянно живёт до 500 видов микроорганизмов. Из них изучили примерно 50.
Микрофлора полости рта в норме представлена различными видами микроорганизмов. Сними, связаны такие заболевания полости рта, как кариес и парадантоз, которые появляются тогда, когда нарушается нормальный баланс между микроорганизмами, что приводит к образованию налёта на поверхности зуба. Именно в зубном налёте локализуется основная масса микроорганизмов полости рта, 70% объёма зубного налёта составляют микробы. В 1 мг его сухой массы содержится около 250 микробов.
Всю микрофлору полости рта подразделяют на два группы:
- Патогенная микрофлора , которая оказывает негативное воздействие на органы и ткани полости рта и всего организма и вызывает развитие различных заболеваний. Этой микрофлоры в идеальном варианте не должно быть, или возможно ей присутствие в ограниченном количестве, существенным образом, не влияющим на состояние полости рта и организма в целом.
- Сапрофитная микрофлора , то есть постоянная микрофлора ротовой полости, присутствие которой необходимо для нормального функционирования зубной системы, а так же всего организма.
Сапрофитная микрофлора влияет на состояние местного иммунитета, препятствует развитию патологических состояний, поддерживает бактериальное равновесие.
Кариес называют болезнью века наряду с сердечно-сосудистыми заболеваниями и раком.
Кариес зубов - серьёзная медицинская и социальная проблема. Несмотря на некоторое снижение его распространенности, происшедшее за последние 10 лет, всё ещё наблюдается высокий уровень заболевания, особенно среди детей дошкольного возраста, значительная часть которых по-прежнему поражена кариесом зубов. Наиболее высокий уровень распространённости кариеса отмечается у детей принадлежащих к экономически неблагополучным семьям, по сравнению с детьми из более обеспеченных семей.
ВОЗ была поставлена цель: добиться к 2000 году среднего показателя кариесных, пломбированных и удалённых зубов менее трёх. Однако эта проблема осталась нерешённой, заболевание продолжает поражать подавляющее большинство населения, начиная с раннего возраста.
Мы обратились в стоматологическую поликлинику г. Гусиноозерск с целью получения информации о распространении заболевания кариесом в нашем городе. Получив необходимую информацию, мы обработали ее и создали таблицу и график распространенности кариеса в Селенгинском районе.
Обратились на прием
Выявлено с кариесом
3. Изучение причины возникновения кариеса с точки зрения микробиологии.
Заболевание зубов не является неизбежным явлением жизни, но оно может быть значительно снижено путём хорошо организованного просвещения населения по вопросам гигиены ротовой полости. Ведущее место в обеспечении хорошего здоровья зубов на долгие годы принадлежит выработке здоровых привычек ухода ротовой полостью и приёма пищи в грудном и раннем возрасте.
Процесс возникновения кариеса начинается с того момента, когда эмаль на поверхности зуба становится деминерализованной вследствие выхода из эмали ионов кальция и фосфора. Разрушение распространяется на более мягкую, чувствительную часть зуба - дентин, расположенный под эмалью, и тогда ослабленная эмаль спадает и образуется кариозная полость. Процесс этот продолжается и постепенно разрушает зуб.
Причиной кариеса является действие на зубную эмаль органических кислот. Кислота является побочным продуктом метаболизма пищевых углеводов, в первую очередь Сахаров, в результате активности бактерий, находящихся в слое зубного налёта, покрывающего поверхности зубов. Сахара способствуют росту и расширению зубного налёта, рацион питания с высоким содержанием Сахаров благоприятствует размножению бактерий, которые используют сахара в качестве своего источника энергии и могут эффективно превращать их в кислоту. Зубной налёт не только удерживает кислоту у поверхности зуба, но и действует как препятствие для нейтрализующего эффекта слюны. Тем самым, способствуя деминерализации и разрушению эмали.
Главным средством, имеющемся во рту для защиты от заболевания зубов, является слюна, которая, благодаря своим свойствам, препятствует образованию кислот и помогает смыть сахара с поверхности зубов. Кроме того, слюна содержит кальций и фосфат, который ускоряет процесс деминерализации. В ночное время в результате уменьшения интенсивности слюноотделения подверженность зубов разрушительному действию возрастает.
На начало, и развитие кариеса влияют многие факторы. Во-первых, зубы просто не способны сопротивляться следствием плохого питания. Во-вторых, самое сильное влияние на разрушение зубов оказывает взаимодействие местных факторов вокруг зуба.
Главными виновниками возникновения кариеса зубов являются добавляемые в пищу сахара. Это сахара, которые добавляются при промышленном производстве, приготовлении или перед употреблением продуктов. Которые, в первую очередь, находятся в кондитерских изделиях, безалкогольных напитках, пирожных, печенье, а так же в столовом сахаре - продуктах, которые часто употребляются между приёмами пищи как лёгкие закуски и напитки. Наиболее кариесогенным сахаром является сахароза, но фруктоза, глюкоза и мальтоза лишь немногим уступает ей в этом. Сахара, присутствующие в свежих фруктах, овощах и в крахмалосодержащих пищевых продуктах, не являются важной причиной разрушения зубов, как и лактоза не является кариесогенной.
С 1890 года считалось, что кариес вызван бактериями, которые ферментируют сахарозу, образуя кислоты, они начинают разрушать эмаль зуба. Существовали ещё другие теории: Наличие "червяков", диспропорция жидкости тела, аутоиммунные нарушения, но эти теории не были подтверждены научно.
Эксперименты показывают, что возможен симбиоз различных кариесогенных бактерий, таких как Streptococci (S), S mutants и Veilonella alcalenscens. Виды Veilonella, используя молочную кислоту, производимую S. mutants, препятствуют деминерализации эмали зубов. Это только один пример взаимодействия микроорганизмов в сложной экологической системе, которые существуют на поверхности зуба.
Наибольшее внимание исследователи уделяют группе стрептококков, которые включают в себя S. mutants, S. sobrinus, S. cricentus, S. rattus, S. ferrus, S. downei, S. macacae. Вначале считали, что все они серовары или биовары, но действительные таксономические исследования чётко показали, что каждый из них представлен отдельным видом. Тем не менее, в основном это: S mutants и S. sobrinus, которые выделяют не только у человека, они также вызывают кариес и у животных.
Кариес у человека вызывают и другие бактерии, это - лактобациллы и актиномицеты. Кариес протекает стадийно, ферментативная деятельность бактерий зубной бляшки приводит к образованию органических кислот, вызывая локальное уменьшение рН, и начинается деминерализация, затем нарушается, микроскопические связи и появляются щели вдоль эмалевых призм, идёт образование полости и вовлечение нижележащих тканей зубов.
В соответствии с современными взглядами — во время развития кариеса, баланс между транзитной флорой на поверхности зуба и облигатной флорой, ведёт к началу деминерализации эмали зуба.
Растёт количество микроорганизмов, что наверняка связано с понижением рН, образуется белый налёт.
Обнаруживается большое количество других видов микроорганизмов, таких как S. mitis и Lactobacillus указывает на образование налёта, важного для последующего развития кариеса. Таким образом, обнаружение различных комбинаций бактерий может служить индикатором образования патологического налёта.
Итак, кариес является результата взаимного действия микроорганизмов в зубном налёте. Выявление уровня кариесогенных бактерий во рту можно получить при исследовании всей слюны. Подсчёт Lactobacillus в слюне использовался уже много лет назад для определения риска кариеса. Во многих исследованиях есть корреляция между S. mutants и Lactobacillus и распространением кариеса: высокий титр наблюдался при наличии зубных отложений . Исследования показывают. Что высокий уровень кариесогенных бактерий в слюне указывает на будущее развития кариеса. Подсчет позволяет определить порог количества микроорганизмов, указывающих на развитие кариеса: Высокий и Низкий риск (таблица). Очевидно преимущество, когда речь идёт о применении интенсивных профилактических программ. Уровень бактерий, которые служат индикатором высокого риска кариеса различно у разных людей, и зависит от многих причин: возраста и состояния зубов, экологии. Таким образом, трудно определить микробный порог с абсолютной точностью для всех категорий. Тем не менее, предлагаемая таблица может быть полезной в клинических условиях.
Изучив подробно данную проблему мы выяснили, что микрофлора ротовой полости делится на: резистентную и транзитную. Резистентная микрофлора постоянно присутствует в ротовой полости, а транзитная развивается на фоне ослабления иммунитета. Нарушение баланса этих микроорганизмов, в ротовой полости может быть вызвано применением антибиотиков, местных дезинфекторов, которые являются губительными, как для транзитной, так и для полезной микрофлоры. Нарушение баланса микрофлоры ротовой полости сказывается на микрофлоре всего желудочно-кишечного тракта, а значит, на его нормальном функционировании. Массовое размножение патогенной микрофлоры в ротовой полости создаёт проблемы не только в тканях, прилегающих к зубам, но и может вызвать дисбактериоз кишечника. "Местом обитания" микроорганизмов ротовой полости является зубной налёт, в котором кроме бактерий скапливаются продукты их жизнедеятельности, в частности, токсины. Именно под слоем зубного налёта образуются кариесные бляшки, которые разрушают зубную эмаль и вызывающие воспаление дёсен. В ротовой полости существует целая система защиты от болезнетворных микробов, но при пониженном иммунитете организм не в силах самостоятельно справится с ними. Сегодня мы предложим вам средства для сохранения здоровой полости рта и зубов, для нормализации макрофлоры ротовой полости.
Основными действующими веществами в этих средствах являются бактерицидные факторы различной природы из растений: донника, зверобоя, тысячелистника, крапивы, алоэ, солодки, душицы, шалфея, чабреца, пихты, лаванды. Экстракты этих растений, широко применяются в традиционной и народной медицине, в гомеопатических средствах для лечения воспалений слизистой ротовой полости. На базе активных биологических веществ мы создали специфический комплекс, обладающий избирательным, бактерицидным действием на стрептококки, т. е. комплекс, который не влияет на резистентную микрофлору ротовой полости.
В своей исследовательской работе мы основывались на медицинскую микробиологию, это раздел микробиологии, который изучает микроорганизмы, вызывающие заболевания человека, и процессы, происходящие в организме при внедрении болезнетворных микроорганизмов и бактериологический метод, который заключается в посеве исследуемого материала на питательные среды. Этот метод позволяет выделить возбудителя в чистом виде и изучить его морфологические признаки и ферментативную активность. Для изучения влияния стрептококка на развитие кариеса мы изучили его морфологические и физиологические данные.
Стрептококки mutants относятся к группе зеленящих стрептококков – это бактерии округлой формы 1-1,5 мм в диаметре, белого цвета с ровными краями. Располагаются попарно или в цепочках. Стрептококки этой группы выделяют из полости рта человека. Обитая в полости рта, они расщепляют углеводы или азотистые вещества пищи с образованием молочной кислоты и щёлочи, избыток которых способствует растворению зубной эмали, что приводит к кариесу зубов.
4. Методика проведения исследований, по изучению микрофлоры ротовой полости (практическая часть).
Прежде чем приступить к практической части мы изучим методику проведения данного исследования. Подготовим необходимые материалы: микроскоп, чашки Петри, пинцеты, шпатель, питательная среда. Изучили потребности стрептококков в питательных веществах и факторах роста, это помогло нам в создании питательных сред необходимых для их выращивания.
Питательные среды являются основой микробиологической работы, и их качество нередко определяет результат всего исследования, т. к. именно среда должна создавать оптимальные условия для жизнедеятельности микробов.
Все питательные среды делят на четыре основные группы:
- универсальные
- избирательные
- питательные
- дифференциально-диагностические.
В нашем случае питательная среда универсальна, хота по своему составу она проста, т. к. состоит из мясопептонного бульона, и пептонной воды, но для выращивания стрептококка к данной среде прибавляют сахар. Жизнь микроорганизмов зависит от условий окружающей среды. На микромир существенное влияние оказывают различные факторы окружающей среды. Их можно разделить на три группы:
- химические
- физические
- биологические
Особо важное влияние оказывает температура, высушивание, давление.
Для стрептококков оптимальная t=37°C (температура тела), мin t= -10°C,
max t=45°С. Эти данные важны для выращивания стрептококков на питательной среде вне организма. Успех бактериологического исследования зависит от правильности забора материала.
1. Материал для бактериологического исследования рекомендуется брать у испытуемого, который в течение последних трёх недель не принимал антибиотики, т. к. под их влиянием патогенные микробы утрачивают способность к росту на искусственных срезах.
2. Для выращивания микроорганизмов в искусственных условиях in vitro необходимы питательные среды, которые создадут оптимальные условия для жизнедеятельности микробов.
3. Только после этого можно начинать исследование:
I.) Помещаем пробирки с агаром в водяную баню и расплавляем его.
II.) Расплавленный агар выливаем в чашки Петри и охлаждаем.
III.) А теперь производим забор материала для исследования. Испытуемый широко открывает рот, язык придавливается шпателем к низу, правой рукой в полость рта вводится стерильный ватный тампон, снимается зубной налёт, содержащий обильную микрофлору, и переносится на агар. Процедура проводится в стерильных условиях.
IV.) Полученный материал помещаем в термостат на 24 часа, при t=37°C.
V.) Через 24 часа изучаем материал и отмечаем увеличение количества микроорганизмов.
VI.) Через 48 часов берём стерильные предметные стекла, еще раз прокаливаем их над пламенем спиртовки - охлаждаем. Часть материала используем для приготовления микропрепарата, а часть используем для исследования.
VII.) Стерилизуем специальную петлю для забора материала в пламени спиртовки, охлаждаем и наносим ею на предметное стекло мясопептонный бульон. Петлю после этой процедуры опять прожигаем до появления красноты, охлаждаем, и теперь переносим колонии микроорганизмов на стекло с мясопептонным бульоном.
VIII.) Полученный мазок фиксируем трёхкратным проведением над пламенем горелки.
IX.) Проводим окрашивание по Грамму
4. Окрашивается по грамму.
- небольшое количество генцианвиолета наливается на препарат, время окраски - 2 минуты.
- Избыток краски сливается в поток, а на препарат наносится пипеткой несколько капель раствора люголя на одну минуту.
- На препарат наливаем несколько капель спирта, происходит обесцвечивание (не более 30 секунд).
- Мазок промыть водой.
- Докрасить разведённым фуксином - 2 минуты.
- Промывается водой.
- Высушивается фильтровальной бумагой на воздухе.
- Микроскопируется (рассматривается)
5. Результаты исследований.
При изучении микропрепарата под микроскопом мы увидели бактерии двух видов:
В малом количестве шаровидные цепочки - стрептококки, и в большом количестве гроздевидные - стафилококки
Это исследование проводилось на базе бактериологической станции.
Действие антибиотиков на культуру стафилококка.
Лабораторная работа №1
Устройство микроскопа и правила работы с ним.
Приготовление фиксированных препаратов бактерий
и окраска их простыми методами.
Цель работы: Изучить устройство светового биологического микроскопа и освоить правила работы с ним. Ознакомиться с приготовлением фиксированных препаратов бактерий и освоить технику окраски препаратов бактерий простыми методами.
Оборудование, материалы: Микроскоп; бактериологические петли; предметные стекла; спиртовка; иммерсионное масло; фильтровальная бумага; зубочистки; фуксин; лоток с рельсами; промывалка.
Устройство микроскопа и правила работы с ним
Микроскоп (от греч. micros – малый и scopio – смотрю) – это оптический прибор, предназначенный для получения увеличенных изображений, а также измерения объектов или деталей структуры, невидимых или плохо видимых невооружённым глазом.
Устройство микроскопа
Схема светового биологического микроскопа представлена на рис. 1.
Механическая часть или штатив состоит из ножки, основания, тубусодержателя, предметного столика, монокулярной насадки (тубуса), револьверного устройства, рукоятки грубой фокусировки (макрометрического винта), рукоятки тонкой фокусировки (микрометрического винта).
Тубус – зрительная труба микроскопа. В верхнее отверстие тубуса свободно вставляется окуляр, на нижнем конце тубуса находится вращающееся вокруг своей оси револьверное устройство (револьвер), в которое ввинчиваются объективы. Вращая револьвер, можно быстро сменить объективы во время работы с микроскопом, подводя любой объектив под тубус. Объектив должен быть центрирован, т.е. установлен на оптическую ось микроскопа. Для этого револьвер поворачивают вокруг своей оси до появления щелчка.
Предметный столик служит для размещения на нем изучаемого препарата. Препарат закрепляют на столике зажимами (клеммами). В центре предметного столика находится отверстие для прохождения лучей света и освещения препарата. В некоторых конструкциях микроскопа предметный столик может передвигаться с помощью винтов, расположенных по периферии предметного столика. Это дает возможность рассмотреть препарат в различных полях зрения.

1 – окуляр
2 – монокулярная насадка
3 – револьверное устройство
4 - объектив
5 – предметный столик
6 - конденсор
7 – корпус коллекторной линзы
8 – патрон с лампой
9 - шарнир
10 – рукоятка перемещения кронштейна конденсора
11 – рукоятка тонкой фокусировки (микрометрический винт)
12 – рукоятка грубой фокусировки (макрометрический винт)
13 - тубусодержатель
14 – винт для крепления насадки
Схема устройства светового биологического микроскопа
Рукоятки грубой и тонкой фокусировки (макро- и микровинты) служат для перемещения тубуса вверх и вниз, что позволяет установить его на необходимом расстоянии от препарата. При вращении винтов по часовой стрелке тубус опускается, а при вращении против часовой стрелки – поднимается. При вращении макрометрического винта объектив ориентировочно устанавливается на фокус, т.е. на то расстояние от препарата, при котором он делается видимым. Микрометрический винт служит для точной установки на фокус.
Оптическая часть является наиболее ценной частью микроскопа. Она состоит из объективов и окуляра.
Окуляр (от лат. oculus – глаз) состоит их двух плосковыпуклых линз, заключенных в общую металлическую оправу. Отечественные микроскопы снабжены тремя сменными окулярами, увеличение которых указано на корпусе окуляра (х7; х10; х15).
Объективы ввинчиваются в гнезда револьверного устройства и состоят из системы линз, заключенных в металлическую оправу. В гнезда револьверного устройства ввинчиваются четыре объектива, увеличение которых указано на корпусе объектива (х8; х20; х40; х90 или 100).
Объективы подразделяются на сухие и иммерсионные .
При работе с сухими объективами (х8, х20, х40) между фронтальной линзой и препаратом находится воздух. В этом случае лучи света проходят среды с различными показателями преломления (покровное стекло, воздух), часть их отклоняется и не попадает в объектив.
При работе с иммерсионными объективами (х90 или х100) для устранения светорассеяния расстояние между фронтальной линзой объектива и препаратом заполняют иммерсионным (кедровым) маслом, показатель преломления лучей света которого близок к показателю преломления лучей света, проходящего через стекло.
Общее увеличение микроскопа определяется как произведение увеличения объектива на увеличение окуляра. Например, если в работе используют окуляр х15, а под тубусом находится объектив х90, то увеличение рассматриваемого с помощью микроскопа объекта составит х1350.
Правила работы с микроскопом
На рабочем столе микроскоп ставят тубусодержателем к себе на расстоянии 3-5 см от края стола;
Включают микроскоп в сеть и устанавливают правильное освещение;
На предметный столик помещают исследуемый препарат и закрепляют его клеммами;
Под тубус помещают нужный объектив и с помощью макро- и микровинтов устанавливают фокусное расстояние. Так, при работе с иммерсионными объективами на препарат предварительно наносят каплю иммерсионного масла и осторожно опускают тубусодержатель макровинтом до соприкосновения со стеклом. Затем, внимательно смотря в окуляр, очень медленно поднимают тубусодержатель, вращая его против часовой стрелки, до тех пор, пока не увидят изображение. Точную наводку объектива на фокус производят микрометрическим винтом. При работе с сухими объективами препарат вначале рассматривают с объективом х8. Поднимая с помощью макровинта тубусодержатель и внимательно смотря в окуляр, устанавливают фокусное расстояние (около 9 мм) и добиваются четкости изображения, используя микрометрический винт. Далее, двигая предметный столик или предметное стекло, устанавливают в центр поля тот участок препарата, в котором лучше всего виден изучаемый объект. Затем, вращая револьверное устройство вокруг своей оси, под тубус помещают объектив на х20 или х40. При этом под тубус не должен попасть объектив х90. В револьверном устройстве объективы располагаются таким образом, что если найдено изображение с объективом х8, то при рассмотрении препарата с объективами большего увеличения нужно слегка подрегулировать четкость изображения с помощью макро- и микрометрических винтов;
Во время микроскопирования необходимо держать оба глаза открытыми и пользоваться ими попеременно;
После окончания работы следует убрать препарат с предметного столика, опустить вниз конденсор, поставить под тубус объектив х8, удалить мягкой тканью или марлей, смоченной в спирте, иммерсионное масло с фронтальной линзы объектива х90, под объектив положить марлевую салфетку, опустить тубусодержатель.
Приготовление препаратов фиксированных клеток
Фиксированными считают клетки микроорганизмов, в которых прерваны жизненные процессы, но полностью сохранена тонкая структура.
Для получения фиксированных препаратов важно правильно подготовить предметные стекла. Они должны быть чистыми и тщательно обезжиренными. Берут стекла пинцетом или аккуратно за грани, так как пальцы оставляют на поверхности жирные пятна.
Приготовление фиксированных препаратов ведут в следующей последовательности:
На середину чистого обезжиренного предметного стекла стерильной петлей наносят небольшую каплю воды. В нее вносят исследуемый материал. Полученную суспензию равномерно распределяют по поверхности стекла тонким слоем.
Полученный мазок высушивают при комнатной температуре на воздухе.
Производят фиксацию мазка. Для этого стекло с высохшим мазком проводят 3-4 раза над пламенем горелки той стороной, где мазок отсутствует. Цель фиксации:
умертвить клетки микроорганизмов и сделать их безопасными (что особенно важно при работе с патогенными микроорганизмами);
зафиксировать (закрепить) мазок на стекле (чтобы они не смывались при окрашивании);
улучшить окрашивание, поскольку мертвые клетки лучше адсорбируют на своей поверхности различные красители.
Окраска фиксированных препаратов микроорганизмов
простыми методами
Фиксированные препараты нельзя рассмотреть под микроскопом, так как они являются бесцветными и пропускают световые лучи. Поэтому их окрашивают, используя простые или сложные методы.
Тинкториальные свойства микроорганизмов - свойства бактерий, грибов и простейших, характеризующие их способность вступать в реакцию с красителями и окрашиваться определенным образом.
При окрашивании фиксированных мазков простыми методами используют один краситель (фуксин, краска Муромцева, генцианвиолет, метиленовая синь и др.).
Последовательность окрашивания мазка простыми методами следующая:
На фиксированный препарат наносят несколько капель красителя таким образом, чтобы он покрывал всю поверхность мазка и выдерживают в течение определенного времени. Так, при окраске фуксином на мазок наносят несколько капель красителя и выдерживают его на мазке 2-3 мин.
Краску смывают с мазка слабой струей до бесцветной смывной воды. При этом стекло держат в наклонном положении над лотком.
Мазок подсушивают фильтровальной бумагой, которую осторожно прикладывают к стеклу, и досушивают на воздухе.
На окрашенный мазок наносят каплю иммерсионного масла и рассматривают препарат с объективом х90 или х100.
Микроскопирование зубного налета.
Цель: изучить микрофлору полости рта.

Оборудование: микроскоп; предметные и покровные стекла; спиртовка; иммерсионное масло; фильтровальная бумага; зубочистки; фуксин; лоток с рельсами; промывалка.
1. Приготовление микропрепарата.
Бактерии зубного налета
На предметное стекло наносится капля воды, затем спичкой берут немного зубного налета у самых десен и смешивают его с каплей воды. Затем препарат фиксируют и окрашивают фуксином. Высушивают, накрывают покровным стеклом и рассматривают сначала под средним увеличением, а затем с иммерсионным объективом.
2. Определение разнообразие форм бактерий.
Что же мы увидим? Микробов самой разнообразной формы: палочки, кокки, спириллы и клетки слизистой оболочки полости рта.
3. Оформление результатов.
1. Внимательно изучите предложенный материал.
2. Посмотрите видео ролики:
3. Письменно ответьте на следующие вопросы:
Каково устройство биологического микроскопа?
Объективы бывают сухие и иммерсионные. Что это значит?
Перечислить основные правила работы с микроскопом.
Перечислите основные этапы приготовления фиксированного окрашенного препарата.
Лабораторная работа №1
Устройство микроскопа и правила работы с ним.
Приготовление фиксированных препаратов бактерий
и окраска их простыми методами.
Цель работы: Изучить устройство светового биологического микроскопа и освоить правила работы с ним. Ознакомиться с приготовлением фиксированных препаратов бактерий и освоить технику окраски препаратов бактерий простыми методами.
Оборудование, материалы: Микроскоп; бактериологические петли; предметные стекла; спиртовка; иммерсионное масло; фильтровальная бумага; зубочистки; фуксин; лоток с рельсами; промывалка.
Устройство микроскопа и правила работы с ним
Микроскоп (от греч. micros – малый и scopio – смотрю) – это оптический прибор, предназначенный для получения увеличенных изображений, а также измерения объектов или деталей структуры, невидимых или плохо видимых невооружённым глазом.
Устройство микроскопа
Схема светового биологического микроскопа представлена на рис. 1.
Механическая часть или штатив состоит из ножки, основания, тубусодержателя, предметного столика, монокулярной насадки (тубуса), револьверного устройства, рукоятки грубой фокусировки (макрометрического винта), рукоятки тонкой фокусировки (микрометрического винта).
Тубус – зрительная труба микроскопа. В верхнее отверстие тубуса свободно вставляется окуляр, на нижнем конце тубуса находится вращающееся вокруг своей оси револьверное устройство (револьвер), в которое ввинчиваются объективы. Вращая револьвер, можно быстро сменить объективы во время работы с микроскопом, подводя любой объектив под тубус. Объектив должен быть центрирован, т.е. установлен на оптическую ось микроскопа. Для этого револьвер поворачивают вокруг своей оси до появления щелчка.
Предметный столик служит для размещения на нем изучаемого препарата. Препарат закрепляют на столике зажимами (клеммами). В центре предметного столика находится отверстие для прохождения лучей света и освещения препарата. В некоторых конструкциях микроскопа предметный столик может передвигаться с помощью винтов, расположенных по периферии предметного столика. Это дает возможность рассмотреть препарат в различных полях зрения.

1 – окуляр
2 – монокулярная насадка
3 – револьверное устройство
4 - объектив
5 – предметный столик
6 - конденсор
7 – корпус коллекторной линзы
8 – патрон с лампой
9 - шарнир
10 – рукоятка перемещения кронштейна конденсора
11 – рукоятка тонкой фокусировки (микрометрический винт)
12 – рукоятка грубой фокусировки (макрометрический винт)
13 - тубусодержатель
14 – винт для крепления насадки
Схема устройства светового биологического микроскопа
Рукоятки грубой и тонкой фокусировки (макро- и микровинты) служат для перемещения тубуса вверх и вниз, что позволяет установить его на необходимом расстоянии от препарата. При вращении винтов по часовой стрелке тубус опускается, а при вращении против часовой стрелки – поднимается. При вращении макрометрического винта объектив ориентировочно устанавливается на фокус, т.е. на то расстояние от препарата, при котором он делается видимым. Микрометрический винт служит для точной установки на фокус.
Оптическая часть является наиболее ценной частью микроскопа. Она состоит из объективов и окуляра.
Окуляр (от лат. oculus – глаз) состоит их двух плосковыпуклых линз, заключенных в общую металлическую оправу. Отечественные микроскопы снабжены тремя сменными окулярами, увеличение которых указано на корпусе окуляра (х7; х10; х15).
Объективы ввинчиваются в гнезда револьверного устройства и состоят из системы линз, заключенных в металлическую оправу. В гнезда револьверного устройства ввинчиваются четыре объектива, увеличение которых указано на корпусе объектива (х8; х20; х40; х90 или 100).
Объективы подразделяются на сухие и иммерсионные .
При работе с сухими объективами (х8, х20, х40) между фронтальной линзой и препаратом находится воздух. В этом случае лучи света проходят среды с различными показателями преломления (покровное стекло, воздух), часть их отклоняется и не попадает в объектив.
При работе с иммерсионными объективами (х90 или х100) для устранения светорассеяния расстояние между фронтальной линзой объектива и препаратом заполняют иммерсионным (кедровым) маслом, показатель преломления лучей света которого близок к показателю преломления лучей света, проходящего через стекло.
Общее увеличение микроскопа определяется как произведение увеличения объектива на увеличение окуляра. Например, если в работе используют окуляр х15, а под тубусом находится объектив х90, то увеличение рассматриваемого с помощью микроскопа объекта составит х1350.
Правила работы с микроскопом
На рабочем столе микроскоп ставят тубусодержателем к себе на расстоянии 3-5 см от края стола;
Включают микроскоп в сеть и устанавливают правильное освещение;
На предметный столик помещают исследуемый препарат и закрепляют его клеммами;
Под тубус помещают нужный объектив и с помощью макро- и микровинтов устанавливают фокусное расстояние. Так, при работе с иммерсионными объективами на препарат предварительно наносят каплю иммерсионного масла и осторожно опускают тубусодержатель макровинтом до соприкосновения со стеклом. Затем, внимательно смотря в окуляр, очень медленно поднимают тубусодержатель, вращая его против часовой стрелки, до тех пор, пока не увидят изображение. Точную наводку объектива на фокус производят микрометрическим винтом. При работе с сухими объективами препарат вначале рассматривают с объективом х8. Поднимая с помощью макровинта тубусодержатель и внимательно смотря в окуляр, устанавливают фокусное расстояние (около 9 мм) и добиваются четкости изображения, используя микрометрический винт. Далее, двигая предметный столик или предметное стекло, устанавливают в центр поля тот участок препарата, в котором лучше всего виден изучаемый объект. Затем, вращая револьверное устройство вокруг своей оси, под тубус помещают объектив на х20 или х40. При этом под тубус не должен попасть объектив х90. В револьверном устройстве объективы располагаются таким образом, что если найдено изображение с объективом х8, то при рассмотрении препарата с объективами большего увеличения нужно слегка подрегулировать четкость изображения с помощью макро- и микрометрических винтов;
Во время микроскопирования необходимо держать оба глаза открытыми и пользоваться ими попеременно;
После окончания работы следует убрать препарат с предметного столика, опустить вниз конденсор, поставить под тубус объектив х8, удалить мягкой тканью или марлей, смоченной в спирте, иммерсионное масло с фронтальной линзы объектива х90, под объектив положить марлевую салфетку, опустить тубусодержатель.
Приготовление препаратов фиксированных клеток
Фиксированными считают клетки микроорганизмов, в которых прерваны жизненные процессы, но полностью сохранена тонкая структура.
Для получения фиксированных препаратов важно правильно подготовить предметные стекла. Они должны быть чистыми и тщательно обезжиренными. Берут стекла пинцетом или аккуратно за грани, так как пальцы оставляют на поверхности жирные пятна.
Приготовление фиксированных препаратов ведут в следующей последовательности:
На середину чистого обезжиренного предметного стекла стерильной петлей наносят небольшую каплю воды. В нее вносят исследуемый материал. Полученную суспензию равномерно распределяют по поверхности стекла тонким слоем.
Полученный мазок высушивают при комнатной температуре на воздухе.
Производят фиксацию мазка. Для этого стекло с высохшим мазком проводят 3-4 раза над пламенем горелки той стороной, где мазок отсутствует. Цель фиксации:
умертвить клетки микроорганизмов и сделать их безопасными (что особенно важно при работе с патогенными микроорганизмами);
зафиксировать (закрепить) мазок на стекле (чтобы они не смывались при окрашивании);
улучшить окрашивание, поскольку мертвые клетки лучше адсорбируют на своей поверхности различные красители.
Окраска фиксированных препаратов микроорганизмов
простыми методами
Фиксированные препараты нельзя рассмотреть под микроскопом, так как они являются бесцветными и пропускают световые лучи. Поэтому их окрашивают, используя простые или сложные методы.
Тинкториальные свойства микроорганизмов - свойства бактерий, грибов и простейших, характеризующие их способность вступать в реакцию с красителями и окрашиваться определенным образом.
При окрашивании фиксированных мазков простыми методами используют один краситель (фуксин, краска Муромцева, генцианвиолет, метиленовая синь и др.).
Последовательность окрашивания мазка простыми методами следующая:
На фиксированный препарат наносят несколько капель красителя таким образом, чтобы он покрывал всю поверхность мазка и выдерживают в течение определенного времени. Так, при окраске фуксином на мазок наносят несколько капель красителя и выдерживают его на мазке 2-3 мин.
Краску смывают с мазка слабой струей до бесцветной смывной воды. При этом стекло держат в наклонном положении над лотком.
Мазок подсушивают фильтровальной бумагой, которую осторожно прикладывают к стеклу, и досушивают на воздухе.
На окрашенный мазок наносят каплю иммерсионного масла и рассматривают препарат с объективом х90 или х100.
Микроскопирование зубного налета.
Цель: изучить микрофлору полости рта.

Оборудование: микроскоп; предметные и покровные стекла; спиртовка; иммерсионное масло; фильтровальная бумага; зубочистки; фуксин; лоток с рельсами; промывалка.
1. Приготовление микропрепарата.
Бактерии зубного налета
На предметное стекло наносится капля воды, затем спичкой берут немного зубного налета у самых десен и смешивают его с каплей воды. Затем препарат фиксируют и окрашивают фуксином. Высушивают, накрывают покровным стеклом и рассматривают сначала под средним увеличением, а затем с иммерсионным объективом.
2. Определение разнообразие форм бактерий.
Что же мы увидим? Микробов самой разнообразной формы: палочки, кокки, спириллы и клетки слизистой оболочки полости рта.
3. Оформление результатов.
1. Внимательно изучите предложенный материал.
2. Посмотрите видео ролики:
3. Письменно ответьте на следующие вопросы:
Каково устройство биологического микроскопа?
Объективы бывают сухие и иммерсионные. Что это значит?
Перечислить основные правила работы с микроскопом.
Перечислите основные этапы приготовления фиксированного окрашенного препарата.
Читайте также:

