Процесс образования биопленки на поверхности зуба
Опубликовано: 01.05.2024
Автор: Грегори М. Курцман
Автор: Грегори М. Курцман, DDS, MAGD, DICOI
Перевод: Станкевич Екатерина Владимировна, врач Авторской клиники микроскопной стоматологии Любимый Стоматолог
Исследования коренным образом изменили наше понимание заболеваний периодонта и их влияние на организм. В течение многих десятилетий информация о болезнях периодонта оставалась практически неизменной, но научные достижения последних 10 лет показали связь полости рта с состоянием общего здоровья, где периодонтиты являются ключом к ряду системных болезней, являясь их причиной либо осложняя их течение.
Многие состояния организма связаны с биопленкой полости рта: кардиоваскулярные заболевания, диабет, заболевания легких, почек и остеопороз. Также доказана связь заболеваний простаты, рака прямой кишки и поджелудочной железы, проблемного разрешения беременности (в том числе преждевременных родов и низкого веса новорожденного) с оральной биопленкой, которая вызывает болезни периодонта. Но что же такое биопленка полости рта?
Биопленка полости рта: Что это?
Мы привыкли называть её бляшкой, мягким липким налетом, содержащим частицы пищи и бактерии, который непрерывно образуется на поверхности зубов и десны. Но теперь уже понятно, что этот налет гораздо более сложен, чем предполагалось ранее. Лучшее определение биопленки - это специфическая, но высоко вариабельная структура, состоящая из микроорганизмов и продуктов их жизнедеятельности, внедренных в высокоорганизованный межклеточный матрикс. Биопленка состоит из различных микроорганизмов, вовлеченных в широкий спектр физических, метаболических и молекулярных взаимодействий. Кооперативный характер микробного сообщества в биопленке обеспечивает преимущество роста для бактерий, большую устойчивость к защитным силам организма хозяина и антимикробным средствам, что также усиливает патогенность микробного сообщества.
Чтобы понять, как справиться с биопленкой, мы должны понимать, что она из себя представляет. Costerton впервые представил этот термин в 1978 году, чтобы подчеркнуть, что бактерии объединяются в "живую пленку", которая взаимодействует со своим окружением.Биопленка формируется практически на любой поверхности, находящейся в естественной влажной среде. У бактерий биопленки наблюдаются новые свойства, не характерные для бактерий в планктонном состоянии. Физиологически бактерии биопленки отличаются от планктонных клеток, свободно передвигающихся в жидкостях организма: слюне или крови. Формирование биопленки – сложный процесс, претерпевающий несколько различных фаз (рис. 1).

рис.1 Фазы жизни биопленки: прикрепление, рост и отсоединение
Процесс начинается с адсорбции клейкой пленки из бактерий и молекул организма хозяина на поверхности зуба. За этим следует процесс пассивного транспорта бактерий, опосредованного слабыми силами притяжения дальнего действия. Эти силы ковалентны водородным связям, поэтому приводят к необратимому прикреплению микроорганизмов к поверхности.Далее биопленка формируется путем аутоагрегации бактерий одного вида и коагрегации между разнородными видами бактерий, что приводит к функциональной организации всех микроорганизмов структуры. Микроклимат меняется от аэробного до факультативно-анаэробного с соответствующими бактериями, секретирующими внеклеточный матрикс биопленки.
В дальнейшем процесс созревания биопленки включает внедрение новых видов бактерий и формирование сложного сообщества. После созревания части биопленки отсоединяются и рассеиваются на другие участки полости рта, формируя новую биопленку или оказывая влияние на организм. Биопленка формируется в течение 2-3-х дневного периода. Это значит, что при условии профессиональной гигиены и домашнейчистки восстановление происходит довольно быстро. К тому же биопленка может отличаться по составу в различных местах образования, даже если это соседние карманы, что усложняет ее устранение (рис. 2).

Слизь, покрывающая биопленку, обеспечивает максимальную защиту бактерий от антибактериальных механизмов хозяина и других «токсичных» средств, вроде антибиотиков и антисептиков. Общая чувствительность, которая наблюдается у бактерий биопленки, также увеличивает устойчивость к внешним воздействиям. Через общую чувствительность генетическая регуляция устойчивости к антибиотикам может обеспечивать защиту бактериий биопленки. Кроме того, бактериальное сообщество может влиять на свой видовой состав, поддерживая рост необходимых микроорганизмови препятствуя росту конкурентов.
Как можно управлять биопленкой?
Механическая очистка пародонтальных карманов удаляет лишь 50% присутствующей биопленки. Но повторный её рост происходит в течение трёх часов с 4-х кратным (400%) приростом массы биопленки. И поскольку содержимое кармана недоступно для гигиены щеткой и нитью, эффект домашней гигиены сомнителен, независимо от степени прилежности пациента. Щетинки зубной щетки не способны проникнуть более 3 мм в десневой карман и не могут механически воздействовать на биопленку, расположенную глубже. Похожие проблемы возникают с ирригаторами. Ирригация дна кармана на всех зубах технически затруднительна, и большинство пациентов не применяют ее ежедневно. Даже если биопленка удаляется механически, бактерии размножаются настолько быстро, что установит контроль над этим невозможно. Структура биопленки после ее удаления восстанавливается в течение двух дней и становится еще более сложной.
Докторам необходимо сотрудничать с пациентами и использовать методику, удобную для них в использовании, но при этом эффективную в отношении биопленки, достигая дна карманов и, таким образом, предотвращая ее повторный рост. Антибиотики крайне ограничены для решения данной задачи. Бактерии биопленки в 1000 раз более устойчивы к антибиотикам по сравнению с планктонной формой. Использование антибиотиков системно, в виде полосканий или аппликаций не способно устранить или адекватно контролировать бактерии биопленки. Это имеет значение как для естественных зубов, так и для периодонтальных проблем вокруг имплантов, ведущих к периимплантитам.
Известно, что хлоргексидин воздействует на молодую биопленку, но бактерии зрелой пленки более устойчивы к его воздействию. Перекись водорода, наоборот, достоверно является эффективным средством не только в устранении биопленки, но также предотвращает ее реформацию без формирования устойчивости, характерной для других методов лечения. Исследовано применение перекиси водорода ежедневно вплоть до 6 лет без побочных эффектов или канцерогенной активности, показано достоверное уменьшение биопленки и улучшение заживления ран, уменьшение кровоточивости десны. Более того к ней не зафиксировано аллергических реакций и формирование устойчивости бактерий. Перекись разрушает слизь матрикса биопленки и стенки бактериальных клеток, по сути “отшелушивая” пленку слой за слоем. Это происходит за счет необратимого разрушения белковых цепочек до аминокислот.
Перекись уничтожает протеиновую пелликулу, прикрепляющую биопленку к поверхности зуба, и снижает воспаление в кармане, ингибируя интерлейкин-8 mRNA. Кислород требуется для успешного заживления раны, так как потребность в нем при репаративных процессах увеличивается: пролиферация клеток, ангиогенез, синтез коллагена - перекись поставляет кислород для процессов репарации. Кроме того, кислорода требует рост новых клеток, в т.ч. новые сосуды. Они же приносят обогащенную кислородом кровь к ране, начиная заживление. В результате новая грануляционная ткань, обогащенная кислородом, лучше васкуляризирована. Это ведет к образованию более упругих коллагеновых волокон.
Разрушение биопленки перекисью водорода
Множественные научные исследования публикуют данные об идеальной концентрации перекиси водорода 1.7%, так как она разрушает биопленку и практически не вызывает раздражения тканей, характерного для более высоких концентраций. Проблемой является доставка перекиси на дно пародонтального кармана и экспозиция ее там на время воздействия на биопленку. Физиологически в кармане постоянно секретируется жидкость для элиминации бактерий. Она, к сожалению, вымывает все препараты, используемые для ирригации кармана. В норме цервикулярная жидкость замещается 40 раз в час. В воспаленной ткани продукция десневой жидкости может увеличиваться в 30 раз. Это ведет к крайне быстрому вымыванию любых используемых местно препаратов из десневого кармана. И поскольку гелю перекиси водорода требуется некоторое время для контакта, внесение его в карман ирригационным шприцом не эффективно из-за тока десневой жидкости и слишком затратно по времени для пациента.
Было определено, что 10-минутная экспозиция 1.7% геля перекиси водорода приводит к проникновению через слизь матрикса и разрушению клеточной стенку бактерий биопленки. Находясь в пародонтальном кармане, перекись выделяет кислород, изменяя поддесневой микроклимат, что затрудняет выживаемость анаэробных бактерий. Поскольку меняется среда обитания микроогранизмов, разрушается матрикс, связывающий биопленку, то под воздействие кислорода попадают глубоко расположенные бактерии. Чтобы вылечить заболевания периодонта, перекись должна проникать до дна кармана и находиться там достаточное количество времени для воздействия на биопленку. Исследования показали, что ополаскиватели и другие средства гигиены с перекисью не могут быть эффективными для доставки вещества глубоко в пародонтальный карман для воздействия на инфекцию.
Чтобы добиться максимального проникновения перекиси вглубь кармана и повысить уровень исполнительности пациентов можно изготовить индивидуальные каппы наподобие PerioTray®, PerioProtect®. При ношении каппы с гелем перекиси водорода в течение 15 мин., препарат проникает до дна кармана >7 мм (рис 3-5).

рис 3. Биопленка до применения перекиси водорода 1.7%

рис 4. Биопленка после использования капп с 1.7% гелем перекиси водорода, демонстрирующая разрушение биопленки через 2 дня использования. ©PerioProtect, LLC. Imagesusedwithpermission

рис 5. Биопленка после использования капп с 1.7% гелем перекиси водорода, демонстрирующая разрушение биопленки через 2 дня использования.©Perio Protect, LLC. Images used with permission
Документально подтвержден эффект гипербарической оксигенации на анаэробные бактерии. Действительно, когда перекись длительно находится в кармане, происходит его оксигенация, изменение анаэробной среды на аэробную, создается эффект гипербарической камеры в десневой борозде, разрушающий ее патогенное содержимое. В дополнение нейтрофилы организма пациента в присутствии перекиси и хлоридов образуют озон путем озонолиза холестерина. Озон оказывает антимикробную активность, окисляя предшественников биомолекул и микробные токсины, участвующиев периодонтальных заболеваниях. Это, в свою очередь, ведет к заживлению и регенерации тканей, ведь также, как и в закрытом лотке, 1.7% перекись водорода выделяет в 5.7 раз больше кислорода по объему при разложении, что теоретически увеличивает давление в закрытой системе.
Лечение перекисью водорода в каппах используется в дополнение к профессиональной механической обработке и лазерной терапии для лучшего контроля биопленки в процессе лечения. После окончания офисного лечения каппы могут использоваться дома в поддерживающей терапии. Обычно в зависимости от тяжести состояния десны пациента предупреждают об использовании капп 3-4 раза в день по 15 минут в течение двух недель параллельно офисному лечению. После окончания механической чистки карманов режим поддерживающего лечения подразумевает использование капп дважды в деньна протяжении6-12 недель, т. е. до момента повторной проверки пародонтального статуса. Если гингивальный край остается невоспаленным, отсутствует кровоточивость, то ношение каппы сокращают до 1 раза в день. Пациента назначают на повторный осмотр через 3 месяца, когда можно пересмотреть частоту использования перекиси.
Пациенты с активной пародонтальной инфекцией и явлениями экссудации, сильной потерей кости или с недостаточным результатом лечения перекисью могут лечиться, используя сироп Вибрамицина. Вибрамицин помогает уменьшить оксидативный стресс в начальной фазе лечения острого воспалительного процесса, ослабляет матричные металлопротеиназы, уменьшая разрушение соединительной ткани ингибирует остеокласты и стимулирует работу остеобластов. Клинически это проявляется уменьшением потери кости и костной регенерацией. Вибрамицин - это антибиотик группы доксициклина, назначается в дозе 50 мг/5мл. Пациента инструктируют наносить Вибрамицин каплями в каппу с гелем перекиси водорода: по капле на боковые зубы с каждой стороны и одна капля на фронтальный участок, затем тщательно распределить их равномерно перед фиксацией каппы.
Длительность лечения Вибрамицином зависит от тяжести воспаления и потери кости. Исследования выявили, что на начальной стадии лечения в первые 2 недели (острый воспалительный процесс) 3 капли Вибрамицина могут использоваться с каппой 4 раза в день по 15 минут, что поможет снизить кровоточивость десны. Для управления остеокластами и остеобластами может потребоваться более длительное лечение. Поверхностное окрашивание тканей зуба вследствие длительного лечения Вибрамицином легко убирается профгигиеной. Чистка зубов после аппликации может предотвратить их окрашивание. Поскольку это субтерапевтическая доза, клиницист должен помнить, что при назначении Доксициклина системно, он может вызвать побочные реакции у пациентов, принимающих антикоагулянты типа Варфарина, и им может потребоваться коррекция дозы антикоагулянтов до начала приема антибиотиков.
Пациенты, проходящие лечение у пародонтолога, как правило, уже страдают от повышенной чувствительности оголенных корней зубов. Автор выяснил, что использование пациентами в каппах нейтральных гелей фторида натрия (например, Pro-DenRx®, DenMat; PreviDent®, Colgate®) дважды в неделю на 15 мин помогает устранить чувствительность корней, а длительное применение может предотвратить рецидив гиперчувствительности.
Заключение
Скайлинг и сглаживание корня до сих пор являются неотъемлемой частью периодонтальной терапии и помогают разрушать биопленку в десневой борозде. Дополнительное лечение 1.7% гелем перекиси водорода в каппе ни в коем случае не заменяет механическую обработку корней и карманов. Каппы усиливают профессиональное лечение и помогают пациенту поддерживать гигиену в участках, недоступных для зубного ершика и нити. Использование перекиси водорода в каппах можно рассматривать как эффективный метод поддерживающей терапии, легкий и удобный для пациента, требующий минимального времени для выполнения.

Важным аспектом каждодневной деятельности стоматолога-эндодонтиста является, на мой взгляд, четкое понимание биологии происходящих процессов. Долгие годы многие такие аспекты, как микробиология или иммунология, казались очень далекими от клинической работы. Накопленные сегодня знания подталкивают нас к изменению наших клинических решений. Одна из наиболее изучаемых и дискутируемых сегодня тем — это тема биопленки.
Биопленка — это конгломерат колоний микроорганизмов, которые погружены во внеклеточный матрикс и прикреплены к поверхности. Микроколонии занимают примерно 15% от общей массы биопленки.
Экстрацеллюлярный матрикс, состоящий из экзополисахаридов, выделяемый микробами и несущий важные функции в жизнедеятельности биопленки, занимает 85% массы биопленки. Несмотря на название биопленка не является однородной субстанцией, она гетерогенна в пространстве и во времени, сквозь биопленку проходят водные каналы, несущие питательные вещества и вымывающие продукты жизнедеятельности микроорганизмов.
Экстрацеллюлярный матрикс является мощным биологическим клеем, с помощью которого биопленка прочно прикрепляется к поверхности. В области стоматологии речь идет о эмали зубов, если мы обсуждаем начальный кариес, и о поверхности корня, если говорим о патологии пародонта, в области эндодонтии мы говорим о биопленке, прикрепляющейся к поверхности дентина канала корня.
Кроме того, экстрацеллюлярный матрикс может являться и питательным субстратом для бактерий. Кстати, в эндодонтии биопленка была описана уже в 1987 году Nair P. как конгломерат микробов различной формы, погруженный в экстрацеллюлярный аморфный матрикс [1], однако термин «биофильм» в то время не звучал, и на это наблюдение не обратили внимание.
Сегодня медики уверены, что более чем в 80% случаев инфекционные поражения организма проходят в форме биопленочной инфекции. В такой ситуации предложение Nair P. «относиться к хроническому апикальному периодонтиту, как к инфекционному заболеванию, вызванному внутриканальной биопленкой» абсолютно логично [2].
Стадии развития биоплёнки
- Сначала происходит первичное прикрепление микроорганизмов к поверхности (адгезия, сорбция) из окружающей среды (обычно жидкости). Эта стадия обратима.
- Окончательное (необратимое) прикрепление, иначе называемое фиксацией. На этой стадии микробы выделяют внеклеточные полимеры, обеспечивающие прочную адгезию.
- Созревание (в англоязычной литературе — созревание-I). Клетки, прикрепившиеся к поверхности, облегчают прикрепление последующих клеток, внеклеточный матрикс удерживает вместе всю колонию. Накапливаются питательные вещества, клетки начинают делиться.
- Рост (в англоязычной литературе — созревание-II). Образована зрелая биоплёнка, и теперь она изменяет свой размер и форму. Внеклеточный матрикс служит защитой клеток от внешних угроз.
- Дисперсия (выброс бактерий): в результате деления периодически от биоплёнки отрываются отдельные клетки, способные через некоторое время прикрепиться к поверхности и образовать новую колонию.

Чем же так интересна эта структура? Внутри биопленки создаются уникальные условия с точки зрения взаимодействия между микроорганизмами: близкий контакт позволяет резко усилить обмен генетической информацией, соответственно, образование резистентных штаммов микроорганизмов происходит намного быстрее, чем у микроорганизмов, находящихся в форме планктона.
Между колониями микробов возникает свой язык общения по типу феромонов: сигнальные молекулы вызывают изменение в поведении микроколоний и влияют на скорость размножения микробов и проявления тех или иных фенотипических свойств [3]. И наконец, внутри биопленки возникают сложнейшие пищевые цепочки, где продукты жизнедеятельности одних микроорганизмов являются основой для существования других. Экстрацеллюлярный матрикс защищает микробов от воздействия внешних факторов, к которым относятся и наши попытки их уничтожения.
Как выяснилось, большинство международных микробиологических исследований изучало микробов в форме планктона, и поэтому часто исследователи не понимали, в чем такая большая разница результатов исследований in vitro и конечного эффекта in vivo. Характерным примером являются данные о возможной разнице резистентности микробов к амоксициллину в форме планктона и биопленки в 1000 раз [4].
Понимание взаимодействия микробов в биопленке помогает нам ответить на старый вопрос микробиологов: все ли микробы, что мы находим в инфицированном канале, нужны для возникновения апикального периодонтита или есть главные игроки, а часть микробов просто попала в канал и никакой роли в патогенезе не играет? Учитывая наши знания о биопленке, мы понимаем, что безобидные, на первый взгляд, микробы несут такие важные функции, как образование экстрацеллюлярного матрикса, и являются незаменимыми в пищевых цепочках [5]. Все эти данные рисуют непростую картину борьбы с инфекционными заболеваниями как в области общей медицины, так и в стоматологии. Наиболее логичным путем является механическое удаление биопленки с поверхности.
В терапевтической стоматологии мы часто совмещаем удаление биопленки с подлежащей поверхности. Пародонтологи уже много лет говорят о необходимости качественного удаления зубного камня и полировки корня как об основе любого пародонтологического лечения. Абсолютно естественно, что мы акцентируем наше внимание на инструментальной обработке канала как на основном этапе борьбы с биопленкой. Однако данные последних десятилетий неутешительны: даже при агрессивной обработке канала при использовании вращающихся никель-титановых инструментов 25—35% поверхности каналов остаются необработанными [6]. Мы не должны забывать, что основной целью инструментальной обработки канала является придание ему формы, а за очистку в основном ответственны ирригация и внутриканальная антисептическая обработка.
С вхождением в обиход термина «биопленка» многие исследователи начали поиски антидотов. Различают два основных направления: поиск новых методик и средств и проверка старых известных игроков на поле боя с инфекциями в новых лабораторных условиях. Одно из самых интересных направлений — фотоактивируемая дезинфекция (PTD, PAD). Эта процедура была разработана в области онкологии: нетоксичные маркеры, называемые фотосенситайзерами, наносились на злокачественные или предраковые ткани и затем активировались низкоэнергетическим лазером, вследствие чего образовывался активный кислород и свободные радикалы, приводящие к гибели раковой клетки [7].
В эндодонтии корневой канал прокрашивается, как правило, метиленовым синим или толуидиновым синим, и эти фотосенситайзеры прикрепляются к наружной поверхности микробов. После этого канал облучается низкоэнергетическим лазером (CO2) с длиной волны 665 нм. Данная процедура вызывает уничтожение бактерий. Естественно, что если бактерии находятся в форме планктона, такая система работает со 100%-ной эффективностью, но биопленка не позволяет красителям достичь внутренних слоев, и поэтому многие исследователи [8] показывают невозможность полного уничтожения микробной биопленки такими системами и как вывод пишут о создании мощной дополнительной антибактериальной системы, но не альтернативной [9].
Биоплёнки как форма существования микроорганизмов и их сообществ

Как бактерии образуют биоплёнку
Сегодня под термином биоплёнка понимают особую форму существования микроорганизмов и их сообществ, образующуюся на границе раздела фаз (обычно твёрдой и жидкой) и характеризующуюся набором свойств, отличных от совокупности автономных клеток микроорганизмов в чистой культуре. К образованию биоплёнок способно подавляющее большинство микроорганизмов.
Биоплёнка - множество (конгломерат) микроорганизмов, расположенных на какой-либо поверхности, клетки которых прикреплены друг к другу. Обычно клетки погружены в выделяемое ими внеклеточное полимерное вещество - слизь. Биоплёнка - обладающее пространственной и метаболической структурой сообщество (колония) микроорганизмов, расположенных на поверхности раздела сред и погружённых во внеклеточный полимерный матрикс (слизь). Обычно биоплёнки образуются в контакте с жидкостями при наличии необходимых для роста веществ. Поверхность, к которой прикреплена биоплёнка, может быть как неживой (камни), так и поверхностью живого организма (стенки кишечника). Считается, что 95-99% всех микроорганизмов в естественной среде существует в виде биоплёнки.
Биопленка как основа иммунной защиты

Перед тем, как рассмотреть вопрос формирования и состава микробной биопленки, отметим ее важность для иммунной защиты человеческого организма. Как было отмечено выше, 95-99% всех микроорганизмов в естественной среде существует в виде биоплёнки. Это касается и нашего кишечника, в котором, в свою очередь, сосредоточено около 70% всех иммунных клеток организма человека. Так как основной функцией иммунной системы кишечника является защита от проникновения бактерий в кровь, а также устранение патогенов, то состояния биопленки, которая является микробиологической составляющая эпителиального барьера кишечника, во многом зависит эффективность иммунитета.
Эпителиальный барьер в целом - это микроколонии бактерий и их метаболиты, пищевые волокна, слизь, гликокаликс, эпителиоциты, клетки стромы слизистой оболочки (фибробласты, лейкоциты, лимфоциты и др.).
Именно правильный состав и метаболическая активность собственной микрофлоры, активные эпителиальные клетки слизистой с рабочими сайтами адгезии, качественное питание (содержащее пищевые волокна, витамины и минералы), а также моторно-эвакуаторное функционирование ЖКТ – все это является основой защиты кишечника от его заселения патогенными и условно-патогенными микроорганизмами.
Микробная биопленка – это сложный комплекс, образованный многовидовыми микробными ассоциациями и поверхностными структурами организма, к которым они адгезировались. Биопленка может быть «плохой» (патогенной) и «хорошей» (из защитной микрофлоры). От состава и активности микрофлоры биопленок зависят гомеостаз и гемостаз любого живого организма. Симбиотические ассоциации, составляющие нормальную микрофлору человека и животных, сформировались в результате взаимодействия макро- и микроорганизмов, эволюционирующих параллельно и взаимосвязано. При этом произошел отбор видов микробов, способных к прикреплению (адгезии) и колонизации слизистых и кожных покровов и использующих организм хозяина в качестве среды обитания. Без прямого или косвенного участия микрофлоры не обходится ни один процесс, ни одна функция в организме. Без микрофлоры нет иммунитета (а без дисбиоза нет инфекционного процесса). Микробиом контролирует не только иммунитет и пищеварение, но и гормональную систему, и условно-рефлекторную деятельность.
Как бактерии образуют биопленку:
Представленная анимация и покадровые иллюстрации показывают, как бактерии образуют биопленку. Биопленка, более известная как "слизь", представляет собой поверхностно-прикрепленное сообщество микроорганизмов. Формирование биопленки включает в себя ряд бактериальных процессов, включая бактериальную сигнализацию и зондирование кворума, производство пили и секрецию внеклеточной полимерной матрицы. Эта анимация была произведена для центра микробных инноваций, в университете Окленда, Новая Зеландия.












О биопленке более подробно:
Составные компоненты биоплёнки
Биоплёнки представляют собой сложные многокомпонентные трёхмерные структуры. В большинстве случаев в составе любой биоплёнки можно выделить как минимум два исходных компонента – клеточная биомасса и матрикс. В составе биоплёнок клетки микроорганизмов, прикреплённые к поверхности субстрата, равномерно покрываются матриксом – сложным комплексом биополимеров (рис.1).

По своему клеточному составу можно выделить два основных типа биопллёнок:
Моновидовые биоплёнки содержат в своём составе только один вид микроорганизмов. В природных условиях такие биоплёнки встречаются достаточно редко. В основном они формируются некоторыми патогенными микроорганизмами в тех органах и тканях макроорганизма, которые в норме являются стерильными. Примером таких биоплёнок и вызываемых ими поражений может служить образование биоплёнки P.aeruginosa в лёгких людей больных муковисцидозом.
Поливидовые биопленки. Большинство биоплёнок, образующихся в окружающей среде, относится к поливидовым биоплёнкам. Такие биоплёнки представляют сложные сообщества, состоящие из многих видов микроорганизмов. В пределах такого сообщества можно обнаружить клетки бактерий, дрожжевых и плесневых грибов, простейших, а так же частицы вирусов, в основном бактериофагов.
МАТРИКС

Важнейшим компонентом биоплёнки является матрикс (внеклеточная полимерная субстанция). Он представляет собой комплекс биополимеров, синтезируемый клетками микроорганизмов, входящих в состав биоплёнки. В состав матрикса входят полисахариды, структурные белки, экзоферменты, нуклеиновые кислоты (рис.2.-слева).
Матрикс играет огромную роль в организации и функционировании биоплёнок. Прежде всего, он способствует пространственной организации этих структур, отграничивая биоплёнки от негативного влияния внешней среды. Значительная степень вязкости матрикса, за счёт полисахаридов позволяет с одной стороны сконцентрировать синтезируемые экзоферменты рядом с клетками, тем самым, повышая их концентрацию в определённой точки пространства, а, с другой стороны, препятствует равномерному распределению по всей биоплёнке неблагоприятных для неё веществ, таких как, например, антибиотики и дезинфектанты. Компоненты матрикса биоплёнки так же могут служить резервными источниками основных биогенных элементов в случае прекращения поступления питательных веществ, что позволяет клеткам, входящим в состав биоплёнки некоторое время существовать в условиях сокращающегося притока питательных веществ.
Среди основных функций матрикса можно выделить следующие:
- Участие в процессе адгезии – матрикс обеспечивает начальные этапы колонизации различных поверхностей клетками и долговременное прикрепление биоплёнок к поверхностям.
- Участие в агрегации клеток – создание связей между клетками, временная иммобилизация популяции, повешение плотности клеток в определённой точке пространства.
- Когезия – формирование полимерных сетей обеспечивающих механическую стабильность биоплёнок и формирование сложной архитектуры.
- Удержание воды – создание сильно увлажнённой микросреды в биоплёнках, противодействие потере жидкости в сухих условиях.
- Создание защитного барьера – обеспечение резистентности к неспецифическим и специфическим факторам защиты организма, толерантность к антимикробным средствам, защита ферментных систем от неблагоприятного влияния (например, нитрогеназы цианобактерий от негативного влияния кислорода), противодействие пожиранию некоторыми простейшими.
- Сорбция органических соединений и неорганических ионов – связывание питательных веществ, ксенобиотиков, ионов тяжёлых металлов; участие в обмене ионов; формирование полисахаридного геля.
- Каталитическая активность – обеспечение повышенной активности экзоферментов за счёт их иммобилизации на полисахаридной матрице. Обеспечение переработки питательных веществ.
- Запасание источников питания – создание запасов углерод- азот- и фосфорсодержащих соединений утилизируемых клетками биоплёнок.
- Обеспечение генетической изменчивости – обеспечение горизонтального переноса генетического материала между клетками в биоплёнках.
- Поддержание окислительно-восстановительного потенциала – обеспечение интерцеллюлярного переноса электронов (фимбрии, белковая «нанопроволка»).
- Экспорт клеточных компонентов – обеспечение обмена с окружающей средой с помощью везикул содержащих белки, нуклеиновые кислоты, липополисахариды и фосфолипиды
Полисахариды матрикса биоплёнки
Среди всех компонентов входящих состав матрикса биоплёнки основную роль в его построении играют экзополисахариды (ЭПС). В количественном соотношении это наиболее распространённые в матриксе биополимеры. В среднем, в зависимости от конкретной биоплёнки их количество варьирует от 50 до 90 % от общей сухой массы веществ матрикса.
Большинство экзополисахаридов биоплёнки представляют собой достаточно длинные полимеры с молекулярной массой от 0,5 х 10 6 до 2 х 10 6 дальтон. На сегоднешний день полисахариды найдены в матриксах биоплёнок практически всех микроорганизмов. Применение различных биохимических методов, а так же методов электронной и флуорисцентной микроскопии (с использованием меченных флуорисцентными красителями лектинов и моноклональных антител) позволило детально охарактеризовать многие из этих биополимеров. Основная роль полисахаридов в составе матрикса биоплёнки – придание жесткости конструкции за счёт взаимодействия между отдельными полимерами. Это обусловлено тем, что между цепями ЭПС осуществляются слабые физико-химические взаимодействия, стабилизирующие структуру (рис.3).
Рис.3. Слабые физико-химические взаимодействия между цепями ЭПС матрикса биоплёнки
Среди таких взаимодействий можно выделить следующие:
- Формирование водородных связей – образуются между ОН – группами обращёнными во вне от основного полимерного скелета.
- Электростатические взаимодействия – возникают между гидрофильными и гдрофобными группами полисахаридных цепей (например, между ОН – и СН3 – группами)
- Ионные взаимодействия – обусловлены связыванием отрицательно заряженных групп полисахаридных цепей посредством катионов двухвалентных металлов ( например, СОО - -Са 2+ - - ООС)
- Силы отталкивания – возникают между одинаково заряженными группами предотвращая коллапс структуры.
- ван дер Ваальсовы взаимодействия – ориентированные взаимодействия в тех участках полисахаридных цепей где внешние группировки полисахаридов формируют диполи.
По своему составу полисахариды матрикса биоплёнки можно разделить на два основных типа – гомополисахариды и гетерополисахариды. Гомополисахариды в составе матрикса биоплёнки встречаются лишь у относительно небольшого числа микроорганизмов. Они обычно представляют собой производные сахарозы, например, глюканы и фруктаны синтезируемые бактериями рода Streptococcus в биплёнках на поверхности зубов, и целлюлоза, синтезируемая Gluconobacter xylinus, Agrobacterium tumifaciens, Rhizobium spp. а так же некоторыми представителями семейства Enterobacteriaceae.
Экзополисахариды матрикса биоплёнки большинства бактерий относятся к гетерополисахаридам, которые представляют собой смесь из нейтральных и заряженных остатков сахаров. Так же они содержат значительное количество различных органических и неорганических заместителей, которые в значительной степени влияют на их физические и биологические свойства. Так, в связи с наличием в составе уроновых кислот (а так же иногда пирувата и сульфатов) некоторые такие полисахариды, включая альгинат, ксантан и колановую кислоту являются полианионными. Так же существуют и поликатионные адгезины.
Белки матрикса биоплёнки.
Вторым по содержанию компонентом матрикса биоплёнки являются экзобелки. В некоторых природных биоплёнках их количество может приблежаться к количеству экзополисахаридов, а иногда и превосходить их. Белки матрикса биоплёнки делятся по своему назначению на две большие группы: Структурные белки и Экзоферменты .
В биоплёнках обнаруживается значительное количество различных экзоферментов, многие из которых вовлекаются в деградацию биополимеров. Субстратом для этих ферментов являются водорасстворимые компоненты (такие как полисахариды, нуклеиновые кислоты и белки), а так же некоторые водонерасстворимые полимеры (целлюлоза, хитин, липиды) и различные органические частицы захваченные биоплёнками. Основные ферменты матрикса биоплёнки приведены в таблице 1.
Таблица 1. Основные ферменты матрикса биоплёнки
- Издательство «Медиа Сфера»
- Об издательстве
- Рекламодателям
- Доставка / Оплата
- Контакты
лаборатория молекулярно-биологических исследований Научно-исследовательского медико-стоматологического института
Московский государственный медико-стоматологический университет
ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, Российская Федерация
НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи РАМН, ул. Гамалеи, 18, Москва, 123098, Российская Федерация
Микробные биопленки на поверхности стоматологических полимерных материалов как основной фактор персистенции микроорганизмов при патологии зубов и пародонта
Журнал: Российская стоматология. 2016;9(1): 92-93
Ипполитов Е. В., Царев В. Н., Автандилов Г. А., Царева Е. В., Диденко Л. В. Микробные биопленки на поверхности стоматологических полимерных материалов как основной фактор персистенции микроорганизмов при патологии зубов и пародонта. Российская стоматология. 2016;9(1):92-93.
лаборатория молекулярно-биологических исследований Научно-исследовательского медико-стоматологического института





лаборатория молекулярно-биологических исследований Научно-исследовательского медико-стоматологического института
Московский государственный медико-стоматологический университет
ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России
ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, Российская Федерация
НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи РАМН, ул. Гамалеи, 18, Москва, 123098, Российская Федерация
В последние годы в практике стоматологического материаловедения все шире используются различные композитные материалы, стеклоиономерные цементы, акриловые пластмассы, полиуретан, стекловолоконные и прочие полимеры для протезирования, имплантации, реставрации и реконструкции зубных рядов [1—3]. Поскольку все эти изделия прямо или косвенно контактируют с тканями организма человека, в частности, пародонтом, эмалью и дентином, слизистой оболочкой полости рта, к ним предъявляются жесткие санитарно-гигиенические требования. Однако в перечне требований отсутствуют нормативы, касающиеся колонизации этих материалов резидентной и патогенной микрофлорой [1, 4]. Вместе с тем, искусственные полимерные материалы, в том числе и материалы медицинского назначения, могут быть колонизированы микроорганизмами и подвергаться процессам биокоррозии или биодеструкции [3, 5—7]. Такого рода исследования наиболее актуальны в стоматологической практике, поскольку все используемые зуботехнические материалы длительное время находятся в ротовой полости, постоянно контактируя с микрофлорой, в составе которой могут быть патогенные виды бактерий и грибов [1, 2, 4]. Более того, способность патогенных микроорганизмов прикрепляться к предполагаемому для использования биоматериалу и его способность к формированию биопленки должны рассматриваться как важнейший фактор противодействия механизмам врожденного иммунитета и, соответственно, развития патологии [1, 3]. Особое значение имеет образование микробных биопленок на поверхности реставрационных (пломбировочных) материалов, используемых для лечения кариеса зубов и его осложнений. Установлено, что микробная биопленка активно образуется в пораженной инфекцией полости зуба, корневых каналах и даже дентинных канальцах [1, 7]. За последние годы появилось работы зарубежных и некоторых отечественных исследователей, которые посвящены изучению адгезии микробов к композитным материалам, стеклоиономерным цементам и пластмассам, используемым для реставрации зубного ряда и последующей колонизации с развитием типичной микробной биопленки смешанного типа [1, 8, 9]. Однако, этапность процесса формирования биопленки, механизмы регуляции, кворум-сенсинга, и особенности участия в этих процессах микроорганизмов разных типов остаются недостаточно изученными.
Цель исследования — изучить этапы формирования микробной биопленки на некоторых полимерных материалах медицинского назначения и продемонстрировать особенности персистенции в зависимости от участвующих этиологических агентов.
Материал и методы. Для проведения данного исследования были выбраны широко распространенные в медицинской практике полимерные пластмассы для производства съемных зубных протезов на основе полиуретана (Россия) и полиметилакрила (Украина). В исследованиях in vitro были выбраны клинические изоляты грамотрицательных и грамположительных бактерий Pseudomonas aeruginosa и Staphylococcus aureus для изучения процессов их взаимодействия с образцами полимеров.
Динамика процесса взаимодействия микроорганизмов с полимерными материалами была изучена с помощью метода сканирующей электронной микроскопии (СЭМ). Образцы полимеров (пластины размером 1×1 см) помещались в питательный LB бульон (Luria-Bertani broth), в который предварительно засевали культуру бактерий в концентрации 106/мл. Инкубация образцов проводилась в термостате в течение 24, 48 ч и 7, 14 сут и в течение 1,5 и 3 мес при температуре 37 °C. При инкубации образцов дополнительного внесения питательной среды не производилось, и таким образом, стимулировался процесс образования биопленки в прогрессивно истощающейся среде [10].
Поверхности образцов полимерных пластмасс были изучены с помощью двулучевого сканирующего электронного микроскопа Quanta 200 3D (США) в режимах высокого вакуума, при ускоряющих напряжениях 5 и 10 кV, с предварительным напылением золотом (999) в установке SPI-Module Sputter/Carbon Coater System (США).
Для оценки морфофункционального состояния бактерий, длительно находившихся на поверхности искусственных материалов, было проведено ультраструктурное исследование соскобов биопленки. Образцы были приготовлены по общепринятой методике для исследования методом ультратонких срезов и проанализированы в просвечивающем электронном микроскопе JEM 100B (Япония).
Оценка жизнеспособности бактерий, сформировавших биопленку на сроках 1,5 и 3 мес, была произведена посредством посева бактериального налета с поверхности пластмасс в питательный бульон и на агаризированную 1% среду LB.
В клинической части исследования проводили сканирующую микроскопию образцов биопленки из корневых каналов, полученной путем соскоба у пациентов с хроническим апикальным периодонтитом.
Результаты. В результате проведенного исследования для всех изученных образцов были установлены общие закономерности взаимодействия микроорганизмов с поверхностью пластмасс, и процессы, связанные с формированием очагов бактериальной персистенции на искусственных полимерных материалах. Поэтапно процесс взаимодействия микроорганизмов с поверхностью пластмасс может быть представлен следующим образом.
Первый этап — образование безмикробной пленки. На сканограммах образование безмикробной пленки соответствует появлению участков более высокой электронной плотности. Данный этап является чрезвычайно важным для последующей успешной адгезии бактерий к пластмассам. Безмикробная пленка, состоящая из продуктов жизнедеятельности микроорганизмов и компонентов питательной среды, меняет заряд поверхности с отрицательного на положительный, тем самым обеспечивая отрицательно заряженным бактериям прикрепление к поверхности за счет сил электростатического взаимодействия [7].
Второй этап — адгезия одиночных бактерий к поверхности. Наиболее интенсивно бактерии адгезировались в области дефектов, образовавшихся при механической обработке материала. На ранних сроках инкубации 24 ч синегнойная палочка, у которой хорошо развит жгутиковый аппарат, адгезируется лучше, чем безжгутиковый стафилококк. У безжгутиковых бактерий реализация адгезии происходит посредством увеличения экспрессии поверхностных адгезинов (белок Bap и экзополисахариды (PIA или PNAG), которые способствуют прикреплению к субстрату и обеспечивают межклеточные взаимодействия) [7, 10].
На третьем этапе происходило образование микроколоний (деление и объединение бактериальных клеток в единую структуру). На этом этапе можно было видеть начало синтеза экзоклеточного матрикса, который объединяет бактерии и является облигатным признаком формирования биопленки.
Четвертый этап — формирование зрелых биопленок с массивным экзоклеточным матриксом. Экзоклеточный матрикс, в состав которого входят гомо- и гетерополисахариды, уроновые кислоты, аминосахара и их сополимеры, белки, нуклеиновые кислоты, липополисахариды, различные минералы (кальций, фосфор и в небольших количествах магний, калий, натрий) выполняет защитную функцию, препятствуя диффузии бактерицидных агентов и действию физических факторов, таких как ультрафиолетовое облучение, изменений рН, осмотического шока, высыхания, участвует в образовании полимикробных биопленок [1, 3, 6].
Далее от зрелых биопленок отшнуровывались особые структуры — номады, состоящие из бактерий, окруженных матриксом. Кроме номад на поверхности биопленок были видны бактерии с четкими контурами без покрытия массивным экзоклеточным матриксом. Очевидно, что номады и поверхностно локализованные бактерии обеспечивают популяции распространение в окружающей среде. При длительной инкубации (1, 5 и 3 мес) синегнойная палочка и золотистый стафилококк находились на поверхности полимерных пластмасс в составе массивных биопленок. Биопленки могли фрагментарно отслаиваться от поверхности и растрескиваться, при этом внутри биопленки визуализировались морфологически сохранные бактерии. Возможно, растрескивание биопленки, так же как и номады, обеспечивает выход из нее жизнеспособных бактерий.
При длительной колонизации бактериями поверхности изученных полимеров происходит формирование дополнительных дефектов поверхности и увеличение объема ранее существовавших. Биодеструктивные изменения в пластмассах возникают в результате действия бактериальных эстераз (ферментов, расщепляющих эфирные связи полимеров) и продуктов их жизнедеятельности, в частности, органических кислот [5, 6].
В дефектах пластмасс бактериальные биопленки способны к длительному сохранению, поскольку надежно защищены от агрессивного воздействия внешней среды (механического удаления, воздействия антибактериальных препаратов). В связи с этим, можно обоснованно утверждать, что образованные на полимерных материалах биопленки обеспечивают длительную персистенцию патогенных для человека возбудителей, потенциально являясь очагами хронической инфекции.
Следует отметить, что в реальной клинической ситуации наличие биопленок в полости рта, в состав которых может входить патогенная микрофлора, создает угрозу развития воспалительных процессов не только локального порядка, но и для всего организма в целом. Это связано с возможной миграцией защищенных экзополиматриксом жизнеспособных бактерий в желудочно-кишечный и дыхательный тракт при глотании и вдыхании, а также диссеминации гематогенным и лимфогенным путем.
Анализ ультратонких срезов соскобов с поверхности пластмасс показал, что на ранних сроках инкубации до 14 сут в препарате были представлены в основном бактерии с сохранной структурой, типичной для вегетативных форм бактерий, и незначительное количество форм бактерий с дефектной клеточной стенкой (ДКС). С увеличением сроков инкубации в препаратах соотношение форм бактерий смещалось в сторону увеличения форм с ДКС, но сохранялись и бактерии в типичной вегетативной форме с признаками деления. На основе этих данных можно заключить, что бактерии в формирующихся биопленках сохраняют жизнеспособные клетки как в вегетативной форме, так и в формах с ДКС, способных к реверсии в типичные вегетативные формы.
Данные микроскопического исследования, свидетельствующие о морфофункциональной сохранности и соответственно жизнеспособности бактерий при длительном их нахождении на поверхности пластмасс в составе биопленок, были подтверждены бактериологически. Посев соскоба с поверхности биопленок пластмасс спустя 1,5 и 3 мес инкубации показал наличие жизнеспособных бактерий в биопленках, образовывавших колонии.
При исследовании типичной зрелой биопленки, полученной при соскобе из корневого канала «периодонтитного» зуба, мы обнаружили много общих элементов c морфологической картиной зрелой биопленки. В частности, выявлены элементы матрикса биопленки, а также кокковидные и палочковидные бактерии, собранные в скопления, сходные с теми, которые наблюдались в эксперименте in vitro на заключительном этапе сформировавшейся биопленки. Основным отличием, которое наблюдалось при исследовании зрелой биопленки из инфицированных корневых каналов, является ее смешанный полимикробный характер.
При развитии патологии пародонта (гингивит, пародонтит) существенную роль играют дрожжевые грибы рода Candida. В ряде случаев они доминируют в составе биопленки, что позволило некоторым авторам ввести в употребление термин кандида-ассоциированный пародонтит. Исследованные нами с помощью СЭМ этапы формирования биопленки дрожжевыми грибами Candida albicans отражают общие закономерности, ранее выявленные у бактерий. Так, в эксперименте со штаммами дрожжевых грибов Candida albicans, после адгезии на субстрате, происходило образование ростовой трубки, затем появлялись дочерние дрожжевые клетки — бластоспоры и нитевидные элементы, окруженные экзополимерным матриксом, хорошо различимым при большом увеличении. Особенностью этого процесса у дрожжевых грибов (эукариотов) в отличие от бактерий (прокариотов) является активное формирование псевдомицелия, который достаточно прочно связан с продуцируемыми полисахаридными компонентами матрикса.
Ведущее значение в процессе микробной адгезии и последующей колонизации с формированием биопленки, по-видимому, играет способность ряда бактерий (стрептококков, актиномицетов) к биосинтезу собственных экзополимеров, что хорошо видно при увеличении СЭМ от 3000 до 10 000. Считается, что развившийся на сахарозе внешний полисахаридный слой стрептококковой биопленки уменьшает активность нейтрофилов по уничтожению микробов. Совокупность полисахаридов и бактерий биопленки может индуцировать «стимул неподконтрольности фагоцитозу» и таким образом индуцировать разнообразные «нарушения фагоцитоза» [1, 2, 9]. Полисахариды могут быть не единственными компонентами среды в ротовой полости, которые индуцируют образование биопленки микроорганизмов. Мочевина, минералы, углекислый газ наряду с белками и глюкопротеинами служат источниками энергии и питания для бактерий, вызывающих кариес зубов и пародонтит. Влияние этих дополнительных факторов на фагоцитоз организма хозяина, процессы биосинтеза цитокинов, хемокинов, дефензинов (эндогенных антимикробных пептидов) и экспрессии TLR рецепторов требует дальнейших исследований [2, 5, 9].
Таким образом, проведенное исследование показало принципиальную возможность исследовать процессы взаимодействия микроорганизмов с искусственными материалами медицинского назначения в экспериментальных условиях.
Вывод. Разработанная экспериментальная модель образования биопленок на абиотических поверхностях может служить основой для проведения исследований с помощью СЭМ, которые позволят вести успешную борьбу с биопленками, формирующимися в естественных условиях при патологии зубов и пародонта. Применение микроскопических методов высокого разрешения (СЭМ) позволяет дать оценку и документировать особенности морфофункционального состояния, как самих бактерий, так и экзополиматрикса биопленок при использовании тех или иных антибактериальных средств. Сочетание микроскопических методов с традиционными бактериологическими методами исследования, посредством которых можно оценить состояние жизнеспособных бактерий, объективизирует оценку эффективности средств борьбы с биопленками.
-
27 июня 2010 4141
Памелла Р. Оверман
В течение последних 120 лет исследователи-стоматологи пытались понять микробную природу болезней ротовой полости. Их взгляды на зубную бляшку и составляющие ее микроорганизмы менялись от гипотез о специфичности бляшки к предположениям об ее неспецифичности и снова возвращались к теории о наличии специфических пародонтальных патогенов в бляшке. Изменения во взглядах на бляшку и образующие ее микроорганизмы влияют на стратегию профилактики заболеваний пародонта и контроля за ними. В последние годы некоторые исследователи-стоматологи стали рассматривать бляшку как биопленку. Такое изменение взгляда на бляшку является важной основой будущих усилий по профилактике и лечению. Данная статья освещает различные, менявшиеся с годами представления специалистов-стоматологов о бляшке, выдвигая на первый план современный взгляд на бляшку как на биопленку, и описывает разновидности терапии болезней пародонта.
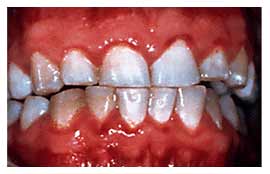
Несмотря на усилия специалистов-стоматологов, инфекции ротовой полости по-прежнему широко распространены. Среднестатистический взрослый американец имеет от 10 до 17 разрушенных, удаленных или запломбированных постоянных зубов. Большинство жителей США болели гингивитом, меньшая часть страдает умеренно выраженными или тяжелыми формами заболеваний пародонта (рис. 1).
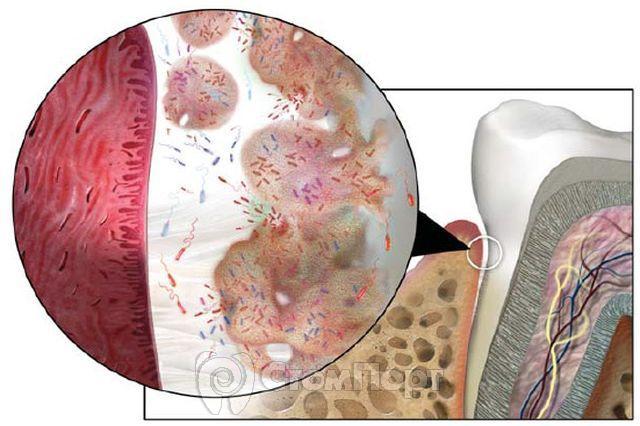
Общепризнанно, что микрофлора ротовой полости является многообразной и наличие специфических бактерий во внутриротовой бляшке рассматривается как необходимая, но недостаточная причина возникновения заболевания. До конца не ясно, как именно микроорганизмы бляшки (рис. 2) вызывают заболевания ротовой полости.

Компоненты зубной бляшки и входящие в нее микроорганизмы изучаются с помощью аналитического оборудования, и полученные результаты влияют на стратегию контроля и профилактику заболеваний зубов. За последние два десятилетия современные научные методы изменили взгляд на зубную бляшку, и сейчас многие ученые-стоматологи рассматривают ее как биопленку.
Биопленка
Биопленка — это хорошо организованное, взаимодействующее сообщество микроорганизмов. Классическим примером биопленки может служить тонкое наслоение на скалах, находящихся посреди течения. Подобные бляшки образуются и в ротовой полости. В природе биопленки распространены повсеместно. Они формируются в условиях текучести. Установлено, что свыше 95% существующих в природе бактерий находятся в биопленках. Иногда биопленки могут быть полезными, например, их применяют для обеззараживания отработанных и сточных вод.
Тонкое наслоение, формирующееся на зубах,— пример, знакомый большинству специалистов-стоматологов. Биопленки выстилают нефтепроводы, аквариумы, постоянные катетеры, внутренние имплантаты, контактные линзы и протезы (рис. 3).

Биопленки могут оказаться смертоносными. Болезнь легионеров, унесшая жизни 29 человек в Филадельфии в 1976 г., в конечном счете оказалась связанной с бактериями биопленки в системе кондиционирования воздуха. Миллионы долларов ежегодно расходуются на работы по контролю за этими биопленками.
Изменение взглядов на бляшку
Национальный институт стоматологических и черепнолицевых исследований недавно проводил международную конференцию по микробной экологии. Эта встреча сосредоточила внимание на новом взгляде на бляшку как на биопленку. Конференция подчеркнула важность изменения мнения о зубной бляшке и ее роли в развитии заболеваний ротовой полости. Такая смена взглядов стоматологов на бляшки происходит не впервые, за последние 120 лет эти воззрения претерпели различные изменения.
Период с 1880 по 1930 получил название золотого века микробиологии. За это время были дифференцированы возбудители многих важнейших системных инфекций. Исследователи также искали единственную специфическую причину заболеваний ротовой полости. Предполагая, что бляшка содержит специфический микроорганизм, вызывающий заболевания пародонта, ученые-стоматологи исследовали бляшки в поисках этого возбудителя. Используя доступные в то время методики (микроскопию влажных и окрашенных мазков), ученые идентифицировали различные группы потенциальных возбудителей заболеваний пародонта.
У пациентов с заболеваниями пародонта были выделены амебы, спирохеты, веретенообразные бактерии и стрептококки, считавшиеся, таким образом, потенциальными возбудителями. Лечение болезней пародонта в то время различалось в зависимости от предполагаемых причин заболевания и включало красители, систематическое применение мышьяксодержащих антимикробных препаратов, внутримышечные инъекции препаратов ртути, а также вакцины.
1930-е годы возвестили о новом взгляде на роль бляшки и ее микроорганизмов в этиологии заболеваний пародонта. Ученые-стоматологи предположили, что заболевания пародонта связаны с неким конституциональным дефектом индивидуума. Считалось, что механические раздражители, такие как камни и нависающие края реставраций, также играют важную роль в патогенезе заболеваний пародонта.
На смену уверенности в наличии единственного микробного возбудителя заболеваний пародонта пришли теории неспецифичности бляшек. Гипотеза о неспецифичности бляшки предполагала, что в деструкции пародонта играет роль скорее вся бактериальная флора бляшки, чем специфические бактерии одного вида. Вся бляшка рассматривалась как патогенная. Кроме того, наличие бляшки означает отягощенное течение заболевания. Контроль за бляшками считался необходимым для ограничения производства веществ, раздражающих десны и приводящих к воспалению и разрушению пародонта. Идентификация специфических микроорганизмов была не важна, важен был строгий контроль за бляшками, и это стало центральным моментом в терапии болезней пародонта.
1960-е отмечены возвращением к гипотезе о специфичности бляшки. Исследователи успешно показали возможность передачи заболеваний пародонта между хомяками. Электронная микроскопия подтвердила наличие спирохет в соединительной и эпителиальной тканях пациентов с острым язвенно-некротическим гингивитом в противоположность здоровым лицам контрольной группы. Допустив, что вызванные разными видами микробов бляшки отличаются друг от друга, ученые снова вернулись к поиску специфического микробного пародонтального возбудителя и лечения, нацеленного на причинный фактор.
Новейшие методы микробиологических исследований, такие как микроскопия в затемненном поле, трансмиссионная электронная микроскопия, сканирующая электронная микроскопия, исследования ДНК и иммунологический анализ помогли в исследованиях.
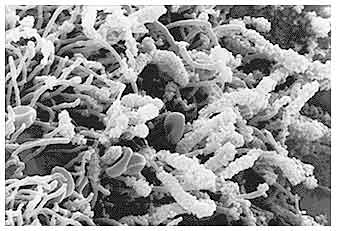
С тех пор ученые продолжают поиски специфического этиологического агента с переменным успехом. Haffajee и Socransky подробно описали причины, затрудняющие точное указание специфических патологических агентов. Некоторые из этих трудностей относятся к процессу отбора микробиологических проб и их культивированию. Эти проблемы включают: получение образца из пародонтального кармана, трудности культивирования некоторых микроорганизмов и большое количество пародонтальных патогенных микроорганизмов, которые могут быть обнаружены в пародонтальном кармане и затем выращены. Забор проб еще более усложняется тем фактом, что в пародонтальном кармане содержатся не только патогенные, но и сапрофитные виды микрофлоры.
Другая группа проблем в точном определении возбудителей болезней пародонта относится к самой природе этих заболеваний. Во-первых, патология пародонтита — не одно, а группа различных заболеваний. Во-вторых, эти заболевания имеют периоды активности и «затишья», и активность заболевания варьирует в пределах организма. И, наконец, трудность в идентификации специфических возбудителей пародонтита связана с колебаниями индивидуальной реакции организма хозяина.
Несмотря на эти трудности, нынешние исследователи по-прежнему согласны с тем, что заболевания пародонта являются инфекциями, вызванными специфическими патогенными микроорганизмами. Недавно было обращено внимание на Bacteroides forsythus, а также на P. gingivalis и A. actinomycetemcomitans как на первичных важнейших возбудителей большинства инфекций пародонта, явно связанных с другой подгруппой микроорганизмов (C. rectus, E. nodatum, F. nucleatum, P. intermedia/nigrescens, P. micros, S. intermedium и T. denticola) как с возможными болезнетворными микробами. Исследователи заняты разработкой и совершенствованием диагностических тестов для обнаружения возбудителя пародонтита и его лечения.
Были предложены антибиотики общего действия, такие как амоксициллин, метронидазол, тетрациклин, доксициклин и аугментин.Было также представлено местное применение антимикробных средств: тетрациклиновых волокон, гелей метронидазола и миноциклина, тонких пластинок хлоргексидина и полимера доксициклина. Хотя эти подходы увеличили наши возможности справиться с заболеваниями пародонта, они все же не смогли обеспечить стабильный успех. Рассмотрение бляшки как биопленки обещает помочь в попытках эффективно лечить пародонтит.
Бляшка как биопленка
Раньше изучались бактерии, выращенные в колониях на чашках Петри в лабораториях. Более усложненная микроскопия, такая как однофокусный сканирующий лазер, позволила исследовать биопленки в их естественных состояниях. Микроорганизмы в биопленке ведут себя не так, как бактерии в культурной среде.
Основные свойства биопленки:
- Взаимодействующая общность разных типов микроорганизмов
- Микроорганизмы собраны в микроколонии
- Микроколонии окружены защитным матриксом
- Внутри микроколоний — различная среда
- Микроорганизмы имеют примитивную систему связи
- Микроорганизмы в биопленке устойчивы к антибиотикам, антимикробным средствам и реакции организма хозяина
Наблюдаемые в микроскоп бактерии в биопленке распределены неравномерно. Они сгруппированы в микроколонии, окруженные обволакивающим межмикробным матриксом (рис. 5).
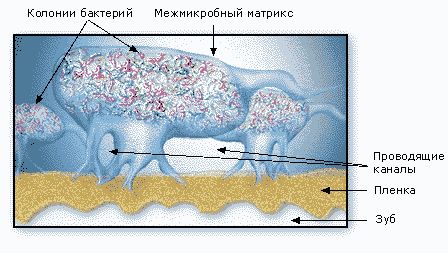
Матрикс пронизан каналами, по которым циркулируют питательные вещества, продукты жизнедеятельности, ферменты, метаболиты и кислород. Эти микроколонии имеют свои микросреды, отличающиеся уровнями рН, усваиваемостью питательных веществ, концентрациями кислорода (рис. 6).
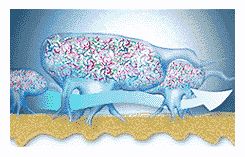
Бактерии в биопленке общаются между собой посредством химических раздражений (сигналов) (рис. 7). Эти химические раздражители вызывают выработку бактериями потенциально вредных белков и ферментов.
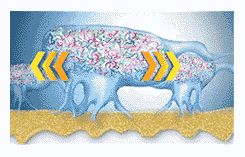
Наши предшествующие попытки предвидеть и контролировать заболевания пародонта были основаны на свойствах бактерий, выращенных в лабораторных условиях. С пониманием сути биопленки было показано, что существуют большие различия в поведении бактерий в лабораторной культуре и в их естественных экосистемах. К примеру, бактерия в биопленке вырабатывает такие вещества, которые она не продуцирует, будучи в культуре. Кроме того, матрикс, окружающий микроколонии, служит защитным барьером. Это помогает понять, почему антимикробные средства как общего действия, так и применяемые местно, не всегда дают успешные результаты, даже тогда, когда они нацелены на конкретный вид микроорганизмов. Это также помогает объяснить, почему механическое удаление бляшек и личная гигиена ротовой полости продолжают оставаться неотъемлемой составной частью лечения заболеваний пародонта. Биопленки могут быть удалены механическими средствами, однако они немедленно начинают восстанавливаться, поэтому поиск путей борьбы с биопленками продолжается.
Новые рубежи
Промышленные исследователи внедряют новые технологии борьбы с биопленками. Один из подходов предполагает вмешательство в обмен сигналами между бактериями таким образом, чтобы они не могли общаться между собой. Другой путь — подражание природной защите, выработанной обитателям океана, например, китами и дельфинами, не накапливающими бактериальные биопленки. Исследователи-стоматологи также продолжают следовать по пути новых стратегий для препятствия развития биопленок в ротовой полости.
Возможные стратегические направления для предотвращения развития биопленок в ротовой полости
- примесь питательных веществ, образующих основания (аргинин)
- уменьшение циркуляции в зубодесневом желобке благодаря противовоспалительным средствам
- ингибирование ключевых микробных ферментов
Регулирование рН биопленки
- сахарозаменители
- антимикробные средства
- фтористые соединения
- стимуляция выработки оснований
Регулирование окислительно-восстановительного потенциала
- вещества-восстановители
- вещества-окислители
Изменение концентрации кислорода, рН, усваиваемости питательных веществ в бляшке показало возможность моделирования микрофлоры биопленки и может оказаться полезным. Например, пародонтальным патогенным микроорганизмам для роста необходим низкий окислительно-восстановительный потенциал. Показано, что добавление окислителя, такого как метиленовый синий, в пародонтальные карманы подавляет рост P. gingivalis.
Поскольку увеличение циркуляции в зубодесневом желобке улучшает обеспечение питанием поддесневой биопленки, регулирование этой циркуляции может в будущем использоваться для контроля за поддесневой биопленкой. Использование противовоспалительных средств может не только помочь подавить разрушительные тенденции в организме хозяина, но и уменьшить поступление питательных веществ в биопленку в процессе циркуляции в зубодесневом желобке.
Читайте также:


