Противоэпилептический препарат при длительном приеме вызывающий гиперплазию десен
Опубликовано: 24.07.2024
ПРОТИВОЭПИЛЕПТИЧЕСКИЕ СРЕДСТВА (antiepileptica) — лекарственные средства, применяемые для лечения эпилепсии, а также других заболеваний, протекающих с эпилептическими припадками.
По фармакотерапевтическому принципу среди П. с. выделяют препараты, эффективные преимущественно при судорожных и бессудорожных приступах. Выраженным противосудорожным действием обладают фенобарбитал (см.), гексамидин (см.), бензонал (см.), дифенин (см.), клоназепам. Умеренное противосудорожное действие оказывают хлоракон и метиндион (см.). Среди препаратов, купирующих бессудорожные пароксизмы, наиболее эффективны для лечения больных с малыми припадками этосуксимид, пуфемид и морфолеп. При психомоторных приступах применяют карбамазепин и депакин.
При генерализованных проявлениях эпилепсии (см.) эффективны барбитураты и клоназепам. Для купирования эпилептического статуса парентерально вводят диазепам (см.).
П. с. хорошо всасываются в жел.-киш. тракте и оказывают достаточно продолжительное действие, за исключением метиндиона, который быстро выводится из организма.
Клинико-фармакологическая характеристика основных П. с. приведена в таблице.
Механизм действия П. с., эффективных при судорожных приступах, сводится к предупреждению избыточной деполяризации нейрональных мембран, что обусловлено затруднением поступления ионов натрия в клетку или ускорением их оборота между клеткой и внеклеточной средой. В результате не наступает активация нейронов судорожного фокуса. Ограничение деполяризаци онных процессов в ц. н. с. особенно резко сказывается на функции вставочных нейронов проекционных путей, что затрудняет распространение судорожных разрядов. Ослабление нейрональной деполяризации отчасти зависит от способности П. с. снижать в клетках уровень циклического АМФ. Противосудорожный эффект вальпроата натрия обусловлен возрастанием тормозных процессов в связи с торможением распада гамма-аминомасляной к-ты (ГАМК) и усилением ГАМК-эргической передачи. Для большинства П. с. не удалось установить связь между их антиконвульсивными свойствами и влиянием на обмен моноаминов мозга.
Механизм действия П. с., эффективных при бессудорожных пароксизмах, мало изучен. По ряду критериев они существенно отличаются от первой группы препаратов и, в частности, не ослабляют максимальные электрошоковые судороги и процессы постстимуляционного облегчения. Возможной причиной предупреждения малых эпилептических припадков под влиянием этосуксимида и морфолепа является прямое или косвенное нарушение этими препаратами функции синхронизирующих структур ростральных отделов головного мозга, прежде всего интраламинарных ядер таламуса.
Для рациональной терапии с помощью П. с. нужно соблюдать ряд условий. Прежде всего необходим правильный подбор препарата в зависимости от формы эпилепсии. При больших припадках эпилепсии вначале чаще используют фенобарбитал, гексамидин или дифенин. Дозы этих препаратов постепенно повышают до прекращения приступов либо максимально возможного управления ими. Необходим контроль за содержанием П. с. в сыворотке крови. Это позволяет подбирать минимальную эффективную дозу препаратов. Тем самым удается снизить суточную дозу и за счет этого уменьшить частоту появления побочных реакций и их тяжесть. В случае резистентности к какому-либо препарату целесообразно комбинированное лечение с одновременным или последовательным использованием двух или более П. с. Замена одного препарата другим должна проводиться путем постепенного уменьшения дозы ранее вводимого препарата и перехода к новому П. с. в возрастающих дозах. При этом следует учитывать фармакокинетическое взаимодействие разных П. с.
У большинства больных эпилепсией лекарственная терапия применяется на протяжении многих лет, а иногда в течение всей жизни. При доброкачественном течении заболевания, рано начатом лечении и правильном подборе П. с. возможно наступление стойкой ремиссии. В ряде случаев возможно даже практическое выздоровление. Отмену П. с. следует производить постепенно, т к. внезапное прекращение лечения может вызвать учащение припадков вплоть до развития эпилептического статуса.
Противопоказанием к применению большинства П. с. служат заболевания печени, почек и кроветворных органов.
Название препарата (русское и латинское) и основные синонимы (набранное курсивом публикуется самостоятельными статьями)
Показания к применению при эпилепсии
Терапевтические дозы и способ применения
Побочные эффекты и осложнения
Противопоказания к применению, предосторожности
Форма выпуска и хранение
Преимущественно фокальные и абортивные судорожные припадки. Противосудорожное действие при генерализованных тонико-клонических припадках слабое
Назначают внутрь, взрослым по 0,1—0,2 г, детям в зависимости от возраста по 0,025—0,075 г на прием. Высшие дозы для взрослых внутрь: разовая 0,3 г, суточная 0,9 г
В отдельных случаях возможны сонливость, вялость, головная боль, атаксия, нистагм, аллергические реакции
Тяжелые поражения почек и печени с нарушениями их функции, декомпенсация сердечной деятельности
Порошок, таблетки по 0,1 и 0,05 г. Хранение: в; хорошо укупоренной таре, предохраняющей от действия света (сп. Б)
Тонико-клонические, миоклонические и другие судорожные припадки
Назначают внутрь взрослым начиная с 0,125 или 0,25 г в сутки. В дальнейшем дозу увеличивают, назначая по 0,25 г 2—3 раза в день. Высшие дозы для взрослых: разовая 0,5 г, суточная 1 г. Суточные дозы для детей: 3—6 лет — 0,25 г, 7—10 лет — 0,6 в, 11 — 16 лет — 0,5«— 0,75 г
В начале лечения могут возникать головокружение, сонливость, головная боль, атаксия, тошнота. Эти явления обычно проходят самостоятельно, в редких случаях требуется уменьшение дозы. Иногда на фоне применения препарата развивается анемия. При этом одновременно с приемом препарата следует назначать фолиевую к-ту и цианокобаламин
Заболевания почек, печени, кроветворных органов
Таблетки по 0,125 и 0,25 г. Хранение: в хорошо укупоренной таре (сп. Б)
Назначают внутрь во время или после еды взрослым по 0,5—1 таблетке 2—3 раза в день. При необходимости дозу увеличивают до 4 таблеток в день. Однако при длительном применении во избежание развития побочных эффектов не следует назначать более 3 таблеток в день. Высшие дозы для взрослых внутрь: разовая 1,5таблетки, суточная 4 таблетки. Детям до 5 лет назначают по 1/4 таблетки 2 раза в день, 5—8 лет — по 1/4 таблетки 3 раза в день, старше 8 лет — по 1/2 таблетки 3 раза в день
Гиперплазия десен, глоссит, стоматит, головокружение, возбуждение, тремор, атаксия, кожные сыпи, тошнота, рвота, лихорадка, лимфаденопатия, лейкопения, мегалобластическая анемия, запоры
Заболевания почек, печени, выраженная сердечная недостаточность, кахексия. Дифенин не следует назначать одновременно с изониазидом и другими препаратами группы гидразида изоникотиновой к-ты, которые подавляют метаболизм дифенина и за счет этого повышают
Таблетки по 0,117 г, содержащие смесь дифенина с натрия гидрокарбонатом в отношении 85 : 15. Каждая таблетка соответствует 0,1 г дифенина.
Хранение: в хорошо укупоренной таре в защищенном от света месте (сп. Б)
Карбамазепин (Carbamazepinum; син.: финлепсин, стазепин, тегретол, Carbamazepin и др.)
Назначают внутрь взрослым, начиная с 0,2 г на прием 1—2 раза в день и постепенно увеличивая дозу до 0,3 г на прием 2—3 раза в день. Суточная доза для детей до 1 года — от 0,1 до 0,15 г, от 1 года до 5 лет — 0,1 — 0,3 г, от 6 до 10 лет — от 0,2 до 0,4 г, от 11 до 15 лет — 0,2 — 0,6 г
Потеря аппетита, тошнота, головная боль, сонливость, атаксия, нарушения аккомодации. В редких случаях возможны аллергические реакции, гепатит, агранулоцитоз, тромбоцитопения
его токсичность Препарат нельзя назначать женщинам в первые 3 мес. беременности. Не следует комбинировать препарат с ингибиторами МАО, которые повышают его токсичность. В процессе лечения необходимо систематически следить за картиной крови
Таблетки по 0,2 г, хранение — сп. Б
Абортивные судорожные припадки, повышенная раздражительность, колебания настроения
Назначают внутрь взрослым по 0,25—0,5 г 3—4 раза в день
Головокружение, тошнота, тремор пальцев рук. При снижении дозы препарата указанные побочные эффекты проходят
Противопоказания не установлены
Таблетки по 0,25 г. Хранение — сп. Б
Абсансы, малые и психомоторные припадки
Назначают внутрь взрослым по 0,25—0,5 г 2—3 раза в день. Суточная доза не должна превышать 1,5 г
Диплопия, аллергические реакции
Заболевания почек, печени, кроветворных органов
Таблетки по 0,25 г. Хранение: в хорошо укупоренной таре (сп.
Генерализованные тонико-клонические припадки, фокальные и другие судорожные формы
Назначают внутрь взрослым по 0,05—0,1 г 1—3 раза в сутки. Высшие дозы для взрослых внутрь: разовая 0,2 г, суточная 0,5 г. При длительном применении нецелесообразно назначать более 0,3 г в сутки
Сонливость, вялость, атаксия, нистагм
Порошок, таблетки по 0,05 и 0,1 г. Хранение: в хорошо укупоренных банках оранжевого стекла (сп. Б)
Психомоторные припадки, расстройства настроения, судорожные формы приступов — в случае противопоказаний к назначению более сильных антиконвульсантов
Назначают внутрь взрослым по 0,5—1 г 3 раза в сутки. Суточная доза не должна превышать 3 г. Детям назначают по 0,25—0,5 г на прием по 2—4 раза в сутки
Иногда вызывает диспептические расстройства, головокружение
В малых дозах не имеет противопоказаний, в больших дозах противопоказан в тех же случаях, что и гексамидин (см. выше). Лечение проводят под контролем функций печени и почек
Порошок, таблетки по 0,25 и 0,5 г. Хранение: в хорошо укупоренной таре (сп. Б)
Этосуксимид (Ethosuximidum; син.: суксилеп, пикнолепсин, Succimal и др.)
Малые припадки, абсансы
Назначают внутрь взрослым по 0,25—0,5 г 3 раза в день. Суточная доза для взрослых не должна превышать 2 г. Детям назначают начиная с суточной дозы 0,25 г с постепенным повышением дозы до 0,5—1 г в день
Диспептические расстройства, кожные сыпи, головокружение
Болезни почек, нарушения кроветворения
Капсулы по 0,25 г; раствор, содержащий в 100 мл 50 г препарата, 25 г глицерина, 25 мл водно - спиртовой смеси (15 капель этого раствора содержат 0,25 г этосуксимида). Раствор выпускается во флаконах по 50 г. Хранение — сп. Б
Библиография: Арушанян Э. Б. Клеточные механизмы действия противоэпилептических веществ, Журн. невропат, и психиат., т. 69, № 11, с. 1731, 1969; Машковский М. Д. Лекарственные средства, ч. 1, М., 1977; Antiepileptic drugs, Quantitative analysis and Interpretation, ed. by C. E. Pippenger а. o., N. Y., 1978; Buchthal A. Zur Pharmakotherapie der Epilepsien, Med. Welt, S. 919, 1978; Richens A. Antiepileptic drugs, . в кн.: Recent Advanc. Clin. Pharm., ed. by P. Turner a. D. G. Shand, № 1, p. 147, Edinburgh а. o., 1978, bibliogr.
Описание
Противоэпилептические средства — лекарственные препараты, обладающие способностью предупреждать развитие припадков у больных эпилепсией.
Исторически первыми для лечения эпилепсии были использованы бромиды (1853 г.). В течение XIX века, несмотря на малую эффективность даже в больших дозах, бромиды являлись основными средствами терапии этого заболевания. В 1912 г. был синтезирован фенобарбитал и появилось первое высокоэффективное противоэпилептическое средство. Однако такие побочные эффекты фенобарбитала как седативное и снотворное действие побуждали исследователей продолжать поиск. Синтез и изучение аналогов фенобарбитала, обладающих противосудорожной активностью, но лишенных его нежелательных свойств, привели к появлению фенитоина (1938 г.), бензобарбитала, примидона и триметадиона. Затем для лечения эпилепсии были предложены этосуксимид, карбамазепин, ламотриджин, габапентин и др.
По мере расширения арсенала и опыта использования противоэпилептических средств сформировались требования, которым они должны отвечать. К их числу относятся высокая активность и большая продолжительность действия, хорошая абсорбция из ЖКТ , достаточная широта действия и незначительная токсичность. Кроме того, препараты не должны обладать способностью накапливаться в организме, вызывать привыкание, лекарственную зависимость и развитие тяжелых нежелательных эффектов при длительном (многолетнем) приеме.
Эпилепсия — хроническое заболевание, характеризующееся повторяющимися время от времени эпизодами неконтролируемого возбуждения нейронов мозга. В зависимости от причины, вызвавшей патологическое возбуждение нейронов и локализации очага возбуждения в мозге, эпилептические припадки могут иметь множество форм, проявляясь в виде двигательных, психических и вегетативных (висцеральных) феноменов. Инициируют эпилептический припадок клетки-«пейсмеккеры», отличающиеся от остальных нейронов нестабильностью мембранного потенциала покоя. Целью фармакологического воздействия является стабилизиция потенциала покоя и, как следствие, снижение возбудимости нейронов эпилептогенного очага.
Точный механизм действия противоэпилептических средств пока остается неизвестным и продолжает интенсивно изучаться. Очевидно, однако, что к снижению возбудимости нейронов эпилептогенного очага могут приводить разные механизмы. Принципиально они заключаются либо в торможении активирующих нейронов, либо в активации ингибирующих нервных клеток. В последние годы установлено, что большинство возбуждающих нейронов утилизируют глутамат, т.е. являются глутаматергическими. Существует три вида глутаматных рецепторов, наибольшее значение из которых имеет подтип NMDA (селективный синтетический агонист — N-метил-D-аспартат). NMDA рецепторы являются рецепторами ионных каналов и при возбуждении глутаматом увеличивают вход ионов Na + и Ca 2+ в клетку, вызывая повышение активности нейрона. Фенитоин, ламотриджин и фенобарбитал ингибируют высвобождение глутамата из окончаний возбуждающих нейронов, предупреждая тем самым активацию нейронов эпилептического очага.
Вальпроевая кислота и некоторые другие противоэпилептические средства, по современным представлениям, являются антагонистами NMDA-рецепторов нейронов и препятствуют взаимодействию глутамата с NMDA-рецепторами.
Трансмиттером ингибирующих нейронов является ГАМК . Поэтому усиление ГАМКергической передачи (повышение активности ингибирующих нейронов) представляет собой еще один путь стабилизации потенциала покоя нейронов эпилептогенного очага. Бензодиазепины и фенобарбитал взаимодействуют с ГАМК А -рецепторным комплексом. Возникающие при этом аллостерические изменения ГАМК А -рецептора способствуют повышению его чувствительности к ГАМК и еще большему входу ионов хлора в нейрон, что, в результате, противодействует развитию деполяризации. Прогабид (не зарегистрирован в РФ) является прямым ГАМК-миметиком и вызывает аналогичный описанному выше эффект, непосредственно возбуждая ГАМК А -рецепторы. Противоэпилептическое действие тиагабина является следствием блокады обратного захвата ГАМК из синаптической щели. Стабилизация этого тормозного медиатора в синаптической щели сопровождается потенцированием его взаимодействия с ГАМК А -рецепторами нейронов эпилептического очага и усилением ингибирующего влияния на их возбудимость.
В последнее время появилась возможность повышать уровень ГАМК в ГАМКергическом нейроне не за счет торможения ее метаболизма, а вследствие повышения утилизации предшественника ГАМК — глутамата. Способностью усиливать образование ГАМК обладает габапентин. Механизм его противоэпилептического действия обусловлен также способностью непосредственно открывать каналы для ионов калия.
Помимо модуляции тормозных и активирующих медиаторных систем, противоэпилептический эффект может быть следствием прямого воздействия на ионные каналы нейронов. Карбамазепин, вальпроаты и фенитоин изменяют инактивацию потенциалзависимых натриевых и кальциевых каналов, ограничивая, тем самым, распространение электрического потенциала. Этосуксимид блокирует кальциевые каналы Т-типа.
Таким образом, современный арсенал противоэпилептических средств, обладающих различными механизмами действия, предоставляет врачу возможность проведения адекватной фармакотерапии эпилепсии. Выбор противоэпилептического средства определяется главным образом характером припадков (генерализованные или парциальные, с потерей или без потери сознания и т.д.). Кроме этого, учитывается возраст дебюта, частота приступов, наличие неврологических симптомов, состояние интеллекта и др. факторы. Особое внимание, учитывая долговременность терапии, уделяется токсичности препаратов и оценке вероятности появления побочных эффектов.
Общие принципы фармакотерапии эпилепсии предполагают:
1. Выбор адекватного для данного вида припадков и синдромов эпилепсии препарата.
2. Монотерапию в качестве начального лечения. Преимуществами монотерапии являются высокая клиническая эффективность (адекватный контроль припадков достигается у 70–80% больных), возможность оценить пригодность выбранного препарата для лечения конкретного больного и подобрать максимально эффективную дозу и соответствующий режим назначения. Кроме того, монотерапия сопровождается меньшим числом побочных реакций, причем прямая связь возникающих нежелательных эффектов с назначением конкретного препарата означает возможность их устранения путем уменьшения дозы или отмены лекарства. Очевидно, что монотерапия исключает возможность нежелательного взаимодействия противоэпилептических средств. Так, карбамазепин, фенитоин, фенобарбитал и др. индуцируют микросомальные ферменты печени и интенсифицируют биотрансформацию, в т.ч. и собственную.
Некоторые противоэпилептические средства (фенитоин, вальпроаты, карбамазепин) практически полностью связываются с белками плазмы крови. Вещества, обладающие более высокой степенью связывания с белками, в т.ч. и другие противоэпилептические средства, могут вытеснять их из связи с белками крови и повышать свободную концентрацию в крови. Поэтому комбинации противоэпилептических средств между собой и с препаратами из других фармакологических групп могут сопровождаться возникновением клинически значимых взаимодействий.
3. Определение эффективной дозы. Лечение начинают со стандартной средней возрастной дозы (она назначается не сразу в полном объеме, а достигается в течение нескольких дней). После достижения равновесной концентрации в плазме (до этого препарат назначают в 3–4 приема) и при отсутствии побочных эффектов дозу постепенно повышают до появления симптомов интоксикации (седация, сонливость, атаксия, нистагм, диплопия, рвота и др.). Затем дозу несколько уменьшают с целью устранения симптомов интоксикации и определяют уровень препарата в крови, соответствующий индивидуальной терапевтической дозе.
Важными преимуществами перед обычными препаратами обладают лекарственные формы с медленным высвобождением активного вещества (ретардные, «хроно» формы). Использование пролонгированных препаратов, их назначают 1 раз в сутки в той же дозе, что и обычный препарат, позволяет сгладить пики концентраций в крови, уменьшить риск побочных эффектов и стабилизировать эффективность.
4. Назначение политерапии при неэффективности последовательной монотерапии различными противоэпилептическими препаратами. Комбинируют противоэпилептические препараты с разным механизмом действия (фармакодинамикой) и в соответствии со спектром действия. В состав комбинированной терапии включают препараты, проявившие наибольшую эффективность при назначении в режиме монотерапии. Избегают включения в комбинации средств, имеющих седативный эффект и угнетающих когнитивные функции. Следует обязательно учитывать возможность взаимодействия между препаратами, входящими в состав комбинированной терапии.
5. Постепенную отмену противоэпилептической терапии (обычно в течение 3–6 мес) путем уменьшения доз препаратов. Резкая отмена терапии может сопровождаться развитием припадков, вплоть до эпилептического статуса. При решении вопроса об отмене лечения основным критерием является отсутствие припадков. В зависимости от формы заболевания бесприступный период заболевания для отмены препарата должен составлять 2 и более лет. Во многих случаях больные получают противоэпилептические препараты пожизненно.
Практически все противоэпилептические средства вызывают седативный эффект, нарушают способность к концентрации внимания и замедляют скорость психомоторных реакций. Вместе с этим каждый из препаратов, относящихся к этой группе, обладает собственным спектром побочных эффектов. Назначение фенобарбитала и фенитоина может сопровождаться остеомаляцией и мегалобластической анемией, фенитоина — гиперплазией десен (возникает у 20% пациентов). Вальпроевая кислота способна вызвать тремор, нарушения со стороны ЖКТ , увеличение массы тела, обратимое облысение и др. Побочными эффектами карбамазепина являются нистагм, атаксия, диплопия, нарушения со стороны ЖКТ и кожная сыпь, антидиуретическое действие.
Вальпроаты, карбамазепин и другие противоэпилептические препараты характеризуются риском тератогенности (об этом будущая мать должна быть проинформирована). Однако в случае наличия значительного риска негативного влияния припадков на плод, лечение может быть продолжено по возможности в наименьших для обеспечения безопасной и эффективной профилактики припадков дозах.
Противоэпилептическими свойствами обладают некоторые средства из других фармакологических групп, в т.ч. ацетазоламид и др.
Общая информация
Гиперплазия десен – это патологическое разрастание тканей десен вплоть до закрытия ими значительной поверхности коронок зубов.
Как правило, гипертрофическое разрастание десен не связано с воспалительными процессами и не затрагивает других тканей полости рта (щек, языка и т.д.).
Данная аномалия нередко сопровождается гиперемией – повышенным кровенаполнением тканей десен, что влечет за собой их болезненность и высокий риск кровотечения при чистке зубов или приеме грубой пищи.
Кроме того, гиперплазия десен существенно затрудняет гигиену полости рта и косвенно провоцирует развитие разного рода заболеваний полости рта.
Причины гиперплазии десен
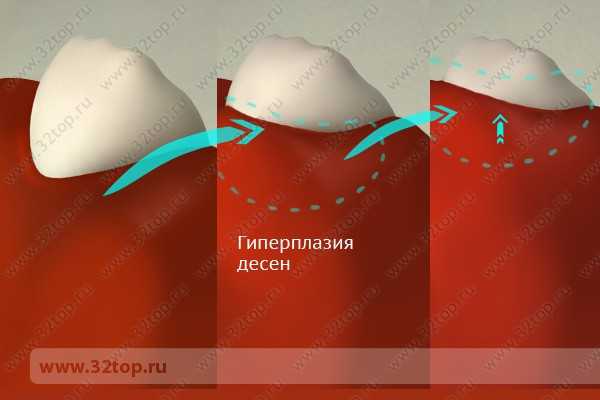
Несмотря на то, что гиперплазия десен встречается относительно часто, причины, вызывающие ее развитие, с однозначной определенностью пока еще не установлены.
Очень часто (в 25-40% случаев заболеваний) гиперплазия десен развивается при активном приеме таких препаратов, как фенитоин (предотвращает эпилептические припадки), циклоспорин (принимается после трансплантации органов, предотвращая их отторжение).
К числу других предрасполагающих к данному заболеванию факторов относятся:
- Беременность
- Некоторые заболевания крови (например, лейкемия)
- Период полового созревания
- Генетическая предрасположенность
- Некоторые аномалии прикуса
- Обилие зубного камня
Лекарственная гиперплазия возможна в любом возрасте.
Виды гиперплазии десен
Специалисты выделяют две разновидности гиперплазии:
- Генерализированая гиперплазия – встречается наиболее часто и представляет собой несколько очагов зернистых разрастаний десны сливаются в один, закрывая довольно обширную поверхность зубов
- Ограниченная (очаговая) гиперплазия – встречается относительно редко и представляет собой одиночные разрастания десны в области бугра верхней челюсти либо в области язычной поверхности десны на нижней челюсти. Одиночные разрастания могут локализоваться как на одной стороне десны, так и иметь двустороннюю локализацию.
Симптомы гиперплазии десен
Основные проявления гиперплазии десен:
- Набухание десен (десневого края и межзубных сосочков)и увеличение их массы
- Заполнение тканями десен межзубных промежутков
- Покрытие тканями десен значительной части поверхности коронковой части зубов
- Уплотнение гипертрофированных тканей десен
- Гомогенный розовый цвет десен
Развитие гиперплазии десен
Несмотря на то, что механизм развития гиперплазии десен окончательно не изучен, установлено, что чаще всего это заболевание обусловлено нарушением движением кальция через мембраны фибробластов десен, что влечет за собой нарушение гомеостаза в клетках десневой ткани и активной выработке коллагеназы, способствующей разрастанию десен.
Гиперплазия десен развивается довольно медленно.
Сначала на деснах (как правило, в области передних зубов) появляются небольшие плотные образования в виде валика, не отличающиеся по цвету от остальной поверхности десен и не вызывающие болевых ощущений при надавливании. Коронки зубов при этом покрываются десневой тканью примерно на 1/3.
Далее гипертрофия десневого края и десневых сосочков начинает прогрессировать, форма десневых сосочков деформируется, разрастающаяся десна покрывает до половины высоты коронки зубов.
Крайняя степень гиперплазии десен характеризуется максимальным разрастанием десневого края, покрывающего более 2/3 высоты коронок и достигающего порой режущего края или жевательной поверхности зубов. Разбухшие десневые сосочки покрываются кровоточащими гранулами разнообразного размера.
Диагностика и лечение гиперплазии десен
Лечение гиперплазии десен на данный момент возможно лишь хирургическим путем посредством иссечения излишков гипертрофических тканей десны. Попутно производится полная санация полости рта.
В случае, если гиперплазия десен вызвана приемом определенных лекарств, следует заменить их на другие препараты. В данном случае отмена препарата может способствовать естественному возвращению десны в нормальное состояние. Если этого не происходит, излишки десневой ткани иссекаются хирургическим путем.
Если пациент вновь начнет принимать препараты, вызвавшие гиперплазию десен, то высока вероятность рецидива заболевания.
Р. Ю. Ильина
к. м. н., ассистент кафедры челюстно-лицевой хирургии и хирургической стоматологии ГБОУ ДПО «Казанская государственная медицинская академия» Минздравсоцразвития РФ
Л. Е. Зиганшина
д. м. н., профессор, заведующий кафедрой фундаментальной и клинической фармакологии Казанского (Приволжского) федерального университета
Л. Р. Мухамеджанова
д. м. н., профессор кафедры пропедевтики стоматологических заболеваний и новых технологий ФГБОУ ВПО «Чувашский государственный университет им. И. Н. Ульянова» (Чебоксары), научный консультант учебно-методического центра «Эксклюзив-Дент» (Казань)
Распространенность эпилепсии сравнительно высока и составляет в общей популяции от 0,3 до 2 %, а в детской — около 1 %. Точные статистические данные об эпидемиологии эпилепсии во многом зависят от учета таких состояний, как фебрильные судороги, единичные (изолированные) судороги и бессудорожные приступы; в любом случае она остается самым частым из серьезных пароксизмальных расстройств функций головного мозга.
Эта группа заболеваний затрагивает функции ЦНС, имеет хроническое, проградиентное течение и высокий уровень инвалидизации. Заболеваемость эпилепсией составляет 50—70 человек на 100 000; распространенность — 5—10 человек на 1000 [3, 6]. Бурное развитие нейрофармакологии, синтез новых антиконвульсантов, кардинальный пересмотр многих принципов лечения эпилепсии позволили отнести их в настоящее время к курабельным заболеваниям [4].
Поскольку применение антиконвульсантов при эпилепсии длительное (часто в течение нескольких лет) или пожизненное, врачи должны знать о метаболических изменениях в организме пациентов, которые могут быть связаны с использованием антиконвульсантов и потенциальными эффектами этих изменений во время долгосрочной терапии. Изменения метаболизма органов и тканей слизистой оболочки полости рта, ведущие к аномальному разрастанию десневого края, особенно на фоне приема энзиминдуцирующих антиконвульсантов (фенитоин, карбамазепин, вальпроаты и барбитураты), способны инициировать развитие генерализованного пародонтита и декомпенсированной формы кариеса зубов [7].
Гипертрофия десневого края, ассоциированная с применением фенитоина, чаще встречается у детей и молодых людей. Изменение формы десневого края начинается через 3—6 месяцев после начала терапии антиконвульсантами и чаще связано с низким уровнем индивидуальной гигиены полости рта. Вестибулярная часть десны вовлекается в патологический процесс чаще, чем оральная (язычная или небная).
Фенитоин оказывает прямое воздействие на субпопуляцию десневых фибробластов, стимулируя их к синтезу коллагена. При этом во внеклеточном пространстве соединительной ткани десны аккумулируются коллагеновые волокна с различной степенью воспаления. Механизм этого нарушения полностью не изучен, но есть исследования о двух основных факторах патогенеза гипертрофического гингивита: синтезе дефектного коллагена и торможении его фагоцитоза десневыми фибробластами [8].
У различных индивидуумов наблюдается генетический полиморфизм фибробластных популяций. Этим объясняется тот факт, что только у 50 % пациентов, принимающих фенитоин, наблюдается разрастание десневого края.
Фенитоин оказывает влияние на процессы пролиферации и дифференциации остеобластов — клеток, образующих органическую матрицу костной ткани альвеолярного отростка; стимулирует зрелые остеобласты к формированию новой костной ткани. Это согласуется с данными клинических наблюдений, согласно которым, у пациентов с гипертрофией десны, индуцируемой фенитоином, отмечали незначительное уменьшение высоты альвеолярного отростка. Информация о нарушении состояния слизистой оболочки полости рта при приеме антиконвульсантов встречается в работах многих авторов [1; 5]. Отмечается ксероз, снижение тургора, нарушение процессов кератинизации, смазанность феномена стиплинга, изменение конфигурации десневых сосочков [9].
По данным А. П. Чечеля, патология пародонта воспалительного характера встречается у 90 % больных эпилепсией, а гипертрофия десневого края возникает у 50 % пациентов [6].
Целью настоящего исследования явилась оценка пародонтального статуса больных эпилепсией в зависимости от длительности приема противоэпилептических средств.
В РКПБ им. акад. В. И. Бехтерева (Казань) было обследовано 54 пациента с эпилепсией в возрасте от 17 до 64 лет. Контрольную группу составили пациенты с впервые поставленным диагнозом заболевания и не получавшие антиконвульсанты (30 чел.) и группа добровольцев (30 чел.). Все пациенты были ранжированы на две группы: 1-я — принимавшие антиконвульсанты менее 5 лет (23 чел.); 2-я — более 5 лет (31 чел.).
Клиническое исследование включало осмотр, зондирование, определение глубины пародонтальных карманов (пародонтометрию), радиовизиографическую панорамную рентгенографию.
Для определения стадии заболевания применялся пародонтальный индекс Рассела (ПИ), учитывающий тяжесть поражения пародонта (деструкцию костной ткани). Исследование глубины пародонтальных карманов определялось при помощи индекса Рамфьёрда. Полученные результаты подвергнуты статистической обработке с использованием критерия Стьюдента.
Оценка пародонтальным индексом Рассела выявила в контрольной группе признаки гингивита и начальную степень пародонтита (0,90±0,17 сегмента). У первичных пациентов чаще встречался гингивит тяжелого течения с апикальным смещением эпителиального прикрепления (1,5±0,21 сегмента).
У пациентов 1-й группы выявлялась легкая и средняя степень хронического генерализованного пародонтита (1,9±0,16 сегмента). В 2-й группе — чаще тяжелые формы пародонтита с потерей устойчивости зубов, их смещением, гнойным отделяемым из пародонтальных карманов (3,6±0,18 сегмента; р 1297

К сожалению, абсолютно безопасных лекарственных средств не существует. Противоэпилептические препараты, как и все лекарственные средства, могут вызывать те или иные побочные действия – от минимального дискомфорта до серьёзных побочных явлений, угрожающих жизни пациента. Назначая медикаментозное лечение, опытный врач всегда следит за тем, чтобы побочные эффекты не вызывали больше дезадаптации у пациента, чем само заболевание.
Цель приёма противоэпилептических препаратов – максимально возможное снижение частоты приступов при отсутствии или минимальной выраженности побочных эффектов. Существуют способы если не избежать побочных действий, то, по-крайней мере, минимизировать риск их возникновения в каждом конкретном случае.
Некоторые побочные действия возникают сразу после начала лечения, другие проявляются через несколько недель или даже месяцев от начала регулярного приёма противоэпилептического препарата.
В каких-то случаях побочные эффекты могут потребовать снижения дозы противоэпилептического препарата. В других случаях требуется специальное лечение, направленное на уменьшение степени выраженности побочных эффектов, которое позволит продолжить противоэпилептическую терапию, не меняя противоэпилептический препарат и не снижая его дозу.
Часты ситуации, когда нежелательные побочные эффекты проходят самостоятельно, не требуют специального лечения и изменения схемы противоэпилептической терапии.
И, наконец, возможны ситуации, при которых появление побочных эффектов требует немедленной отмены противоэпилептического препарата, предположительно вызвавшего данное побочное действие. Опасные нарушения, требующие немедленной отмены противоэпилептической терапии, такие как аллергические реакции, лекарственный гепатит, агранулоцитоз чаще возникают в первые недели от начала лечения. Большинство из них – это реакции идиосинкразии (индивидуальной непереносимости препарата), которые врач не может предсказать заранее.
Способы минимизировать риск побочных действий от противоэпилептической терапии
Для уменьшения вероятности возникновения побочных эффектов необходимо подробное обследование до начала лечения, позволяющее выявить предрасположенность к побочным эффектам, точное соблюдение рекомендаций врача, медленное повышение дозы препарата и регулярное обследование в процессе проведения терапии.
Перед началом лечения врач рекомендует больному обследование, которое включает ряд лабораторных показателей (общие анализы крови и мочи, биохимическое исследование крови, коагулограмма и др.), УЗИ органов брюшной полости, электрокардиограмму и др. Выбор дополнительных исследований зависит от того, назначение какого противоэпилептического препарата планируется. Такое обследование требуется для своевременного выявления заболеваний, которые могли быть ранее не диагностированы у больного, но которые могут усугубиться на фоне приёма определённого противоэпилептического препарата. Далее лечащий врач оценивает выявленные нарушения и решает, являются ли они противопоказанием к приёму выбранного противоэпилептического препарата, либо лишь указывают на то, что лечение следует проводить с осторожностью, под контролем определённых показателей. Данная тактика позволяет врачу выбрать наиболее безопасный для больного препарат.
Когда препарат уже выбран, пациент может сам изучить информацию о нём в инструкции вкладыше и в интернете. К сожалению, многие пациенты, не имея специальных знаний, неправильно интерпретируют прочитанное. Самая большая ошибка – переносить на себя все описанные в инструкции побочные действия, а также побочные действия, которые возникли у других пациентов, принимающих данный препарат и отразивших свой негативный опыт в интернете. Прежде чем делать ложные выводы и отказываться от необходимого лечения, обязательно обсудите Ваши сомнения с лечащим врачом!
Пациент, начинающий противоэпилептическую терапию, требует особо тщательного наблюдения.
Врач может рекомендовать пациенту регулярно проводить исследования (например, общие анализы крови и мочи, ферменты печени, УЗИ печени, определение концентрации антиэпилептических препаратов в крови) на фоне приёма противоэпилептического препарата. Это требуется для своевременного выявления побочных действий, которые не всегда проявляются клинически (то есть не приводят к возникновению каких-либо жалоб у пациента), но могут быть значимыми и потребовать коррекции схемы противоэпилептической терапии.
Пациенту и его близким также рекомендуется отмечать любые изменения в состоянии здоровья, а при появлении настораживающих симптомов (тошноты, рвоты, сыпи, сонливости, снижения зрения, изменения поведения, настроения и т.д.), немедленно сообщать о происходящем лечащему врачу. Врач пригласит пациента на приём, чтобы разобраться в ситуации и принять адекватные меры.
Для полноты информации пациенту, принимающему противоэпилептические препараты, рекомендуется вести дневник, в котором следует отмечать частоту, характер приступов, торговые названия и дозы принимаемых препаратов, а также все нежелательные явления, возникающие на фоне лечения. Данная информация, накопленная за весь период лечения эпилепсии, потребуется эпилептологу при необходимости коррекции лечения в будущем.
Эпилептологи Клиники Неврологии и Эпилептологии ТОНУС ЛАЙФ имеют многолетний собственный опыт изучения побочных эффектов противоэпилептических препаратов, хорошо знакомы с инструкциями ко всем противоэпилептическим препаратам и современными публикациями на эту тему.
Читайте также:

