Роль минеральных веществ и кальций связывающих белков в минерализации зуба и костной ткани
Опубликовано: 27.04.2024
В кости содержится большое количество цитрата. В скелете сосредоточено примерно 90% все лимонной кислоты организма. Накапливается за счет цитратсинтазы одонтобластов. Важное свойство цитрата - вывсокая комплекеообразующая активность с ионами Са. Цитрат активирует кислые лизосомальные гидролазы Участвуют в процессах отложения солей Са и Р).
Минерализации кости предшествует синтез белков, гпикозаминогликанов, различных ферментов, макроэргов и др. Кости в отличии от твердых тканей зуба обладают способностью к минерализации. Полагали что кальцификация - простой процесс осаждения минеральных солей подчиняющихся законам
классической физической химии, при этом считали, что основным условием являются соответствущие концентрации
ионов Са и Р. Но кальцификация является сложным процессом в который вовлекается целый ряд соединений в том
числе белки и ферменты. В дальнейшем появились ферментативные теории осеофикиции.
1923 г.. Ведущую роль в процессе осеофикации принадлежит щелочной фосфотазе, т.е. под действием щелочной
фосфотазы происходит разрушение органических фосфосодержащих субстратов(глицерофосфат) и в результате
создается высокая концентрация ионов явление перенасыщения и последующее образование костной соли. Слабость теории: костная ткань содержит мало органических фосфатов, многие ткани содержат щелочную фосфатазу, но однако не все минерализуются.
Угнетение ферментов гликолиза и щикогенолиза сопровождается угнетением кальцнфнкации. была доказана необходимость АТФ для минерализации, поэтому появились другие теории сотяасно которым кристаллизацию инициируют компоненты органического матрикса обызвествляемых тканях. 1 Изучение функции коллагена в процессах минерализации позволило показать, что коллаген может инициировать нуклеацию апатитовых кристаллов на макромолекулах коллагеновых фибрилл, т.е. способен вызывать образование центров кристаллизации апатитов из
растворов фосфатов Са.
2 Свободный или связанный с белками хондроитинсульфат. Они интенсивно секретируются наряду с гликозаминогликанами, а затем подвергаются расщеплению лизосомальными гидролазами в образованием высокоактивных анионов. Предполагают, что биохимич., основу образования зародышевых кристаллов гидроксиапатита составляет реакция образования комплекса между коллагеном, АТФ, Са и хондроитинсульфатов Начало процесса минерализации объясняют в настоящее время усилением в остеобластах процессов распада гликогена и поступлением ацетилКоА в цикл Кребса, что приводит к выделению в окружающую среду цитрата и малата. Они способствуют растворению аморфоного фосфата Са. Во-вторых они создают оптимальную среду для деятельности кислых гидролаз выделяемых из лизосом остеобластов. Лизосомальные ферменты перестраивают органический матрикс кости.
80. Органические и минеральные компоненты эмали зуба. Особенности обменных процессов органического и минерального компонентов эмали зуба.
Органические вещества эмали (1,6%) представлены в основном белками, кроме них в эмали содержаться лилиды, углеводы, лактат, цитрат и свободные аминокислоты. Белки органического матрикса эмали по аминокислотному составу преимущественно относятся к кератиноподобным белкам, но в отличие от кератина они богаты серином в основном в виде серин-фосфата и имеют небольшой молекулярный вес. Коллаген в эмали обнаружен в виде следов.
Сравнительно недавно в структуре эмали доказано наличие гликопротеидов, а так же небольшое количество Са-связывающего белка эмали (гаммокарбоксиглутоматный белок), этот белок с достаточно высокой емкостью и склонностью агрегации до тетрамеров в нейтральной среде. Содержание белков в эмали составляет 1,3%.
Углеводный состав эмали и дентина представлен в основном гликогеном. Из углеводных компонентов в эмали обнаружили глюкозу, маннозу, фруктозу, ксилозу и рамнозу. Обычно они связаны с белками, т.е. входят в состав гликопротеидов эмали, частично в свободном виде. В поверхности эмали содержится в 10 раз больше углеводов чем в глубоких слоях это говорит о том, что приток идет за счет ротовой жидкости. Гликопротенды играют существенную роль и особенно в дентине, где их больше в динамической устойчивости твердых тканей зуба, поскольку именно гликопротеиды осуществляют химическую связь с белками, углеводами, и минеральными компонентами твердых тканей зуба, все это имеет значение в реминерализации.
Липиды эмали. 0,2% так же участвуют в процессах минерализации и ременирализации. Считают, что реминералгоация эмали в том числе при кариесе возможна только при сохранившейся структуре органического матрикса. Среди химических компонентов эмали и дентина в сравнительно большом количестве обнаружен цитрат. В эмали его примерно 0,1% в дентине 0,9%. Обнаружен лактат. Оба принимают участие в процессах минерализации.
Прочность и высокая плотность эмали объясняется высоким содержанием в ней минеральных компонентов примерно 95% на сухой вес. Минеральный компонент эмали представлен кристаллами гидроксиапатитов, карбонатапатитов, хлорапатитов, фторапатитов, цитратапатитов - кристаллиты. Из них превалируют более 70% гидроксиапатитов. Каждая кристаллическая решетка состоит из 18 ионов. Кристаллы гидрогсиапатита в эмали
В эмали так же содержится около 2% неапатнтных кристаллов - октокльцийфосфат, дикальнийфосфат, фосфат кальция Белки эмали
О наличии белков в составе эмали и дентина было известно уже более 100 лет назад, однако аминокислотный состав белков расшифрован лишь в последние два десятилетия с появлением соответствующих методов исследования. Важнейшей составной частью белка является коллаген. Благодаря проведению тончайшего аминокислотного анализа стало возможным определить структуру коллагена зубов. Гидролизат коллагена содержит 18 аминокислот, в том числе 26% глицина, 15% пролина и 14% гидроксипролина. Различия в структуре коллагена определенных тканей заключаются в пропорциональном соотношении лизина и гидроксилизина, хотя количество этих аминокислот остается постоянным (3 4%). Коллаген принадлежит к группе волокнистых белков, его молекула построена из цепочек аминокислот (две цепочки одинаковые, а третья отличается по составу аминокислот).
Тем не менее основной состав органического вещества эмали изучен. М. Stack (1954), работы которого стали классическими, показал, что в эмали существует кислоторастворимая фаза органических веществ (белки и пептиды) и кислотонерастворимая. Обе фазы содержат углеводные группы (галактоза, глюкоза, манноза, глюкуроновая кислота со следами фукозы и ксилозы), которые выявляют методом хроматографни.
" data-shape="round" data-use-links data-color-scheme="normal" data-direction="horizontal" data-services="messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger">
Биохимия соединительных тканей и органов полости рта
(костная, хрящевая ткани; зубы)
Главный минеральный (неорганический) компонент костной ткани и твердых тканей зуба — кристаллы апатитов (апатит в переводе — неизвестный). В их основе — фосфат кальция. Любой минеральный компонент формируется следующим образом:
брушит октакальцийфосфат гидроксиапатит (ГА)
Общая формула апатитов — А10(ВО4)6Х2, где А — Са, Ва, Sr, Cr, Pb, Cd; B — P, As, Si; X — F, Cl, OH‾, CO3 2– . Самый распространенный в минерализованных тканях — ГА, самый устойчивый к действию кислот — фторапатит Са10(РО4)6(F)2 . При концентрация F в средствах по уходу за зубами и полостью рта до 500мг/л образуется гидроксифторапатит — Са10(РО4)6(ОН)F; 500–2000 мг/л — фторапатит; более 2000 мг/л — СаF2, а это уже не кристаллы апатитов.
В «идеальном» апатите соотношение Са/Р = 1, 67. Уменьшение этого соотношения приводит к неблагоприятным последствиям, в частности к снижению резистентности эмали. При замещении в ГА Са на Sr , особенно на Sr 90 , который является β-излучателем, развивается стронциевый рахит, для которого характерны хрупкость и ломкость костей и зубов, переломы, деформации скелета.
Обмен ионов кристаллов апатита на ионы, находящиеся в растворе, называется изоморфное замещение. Преимущественным фактором возможности замены является сходство размера атома, а сходство заряда имеет второстепенное значение. Кроме изоморфного замещения, состав кристалла апатита можно изменить путем заполнения другими ионами вакантных мест в кристаллической решетке апатита.
Этапы проникновения различных элементов в кристаллы ГА:
- проникновение элементов в воду гидратной оболочки кристалла (длится несколько минут);
- обмен между ионами гидратной оболочки и поверхностью кристалла (длится несколько часов);
- проникновение ионов в кристалл (длится месяцами и годами).
Минерализация костной ткани и твердых тканей зуба
В основе этого процесса — образование кристаллов апатита с участием фосфата кальция. В организме внеклеточная жидкость перенасыщена фосфатом кальция и он начинает осаждаться. Выделяют 2 стадии осаждения фосфата кальция:
- нуклеация — образование плотного осадка (ядра);
- рост кристаллов из ядра — эпитаксис.
Нуклеация бывает гомогенная (кристаллы образуются без участия другой фазы) и гетерогенная (образование кристаллов инициирует другая фаза, играющая роль матрицы-затравки). Матрица может и направлять рост кристаллов. Роль матрицы выполняют протеогликаны, гликозаминогликаны, Са-связывающие белки: фосфопротеины и белки, содержащие γ-карбоксиглутаминовую кислоту (γ-КГК), для синтеза которой нужен витамин К.
Теории минерализации костной ткани и твердых тканей зуба:
- физико-химическая, в основе которой лежат названные выше 2 стадии;
- ферментная: щелочная фосфатаза костной ткани гидролизует фосфорорганические эфиры, в результате этого освобождается фосфат-ион, что при наличии кальция и матрицы вызывает рост кристаллов ГА;
- смешанная: сначала синтезируется внеклеточный матрикс, а затем наступает этап минерализации из-за перенасыщенного состояния раствора фосфата кальция и наличия матрицы.
Неколлагеновые белки костной ткани и их роль
в процессах минерализации
Остеокальцин: 1) содержит 3 остатка γ-КГК → связывает Са 2+ ; 2) прочно связан с апатитом; 3) участвует в росте кристаллов.
Костный сиалопротеин: 1) содержит трипептид АРГ-ГЛИ-АСП (R-G-D) → способен связываться с другими клетками, макромолекулами и рецепторами клеточных мембран; 2) через специальный рецептор (10 остатков ГЛУ) связывается с Са 2+ ; 3) относится к фосфопротеинам, тесно связан с клетками и апатитом; 4) присоединяет остеобласты к кости в период ее синтеза.
Остеопонтин: 1) содержит трипептид R-G-D; 2) связывается с Са 2+ ; 3) прочно связан с апатитом.
Остеонектин: 1) имеет Са-связывающий домен, хотя в нем и нет γ-КГК; 2) связывается с коллагеном и апатитом.
Тромбоспондин: 1) содержит трипептид R-G-D; 2) связывается с поверхностями клеток и другими белками костной ткани.
Костный кислый гликопротеин: участвует в минерализации костной ткани.
Химический состав тканей зуба и кости (весовые %)
| Ткани | Минеральные (неорганические) вещества | Органические вещества | Вода |
| Эмаль | 95 | 1 — 1,5 | 4 |
| Дентин | 70 | 20 | 10 |
| Цемент | 60 | 25 | 15 |
| Кость | 55 | 30 | 15 |
| Пульпа | 5 | 40 | 55 |
Эмаль. Вода находится здесь в двух видах: свободная и связанная (гидратная оболочка кристаллов апатитов).
Минеральная основа — кристаллы апатитов: ГА — 75 %; остальное — фторапатит, карбонатный апатит, хлорапатит. В наружном слое много Са, Р и F (в 10 раз больше, чем в подлежащих слоях), поэтому он более устойчив к действию кислот. Кроме F, есть Zn, Pb, Sb, Fe. В глубоком слое много Na, Mg, карбонат-иона. По всей толщине эмали равномерно распределены Sr, Cu, Al, K.
Органический компонент — неколлагеновые белки, пептиды, липиды, моносахариды.
ГА — кристаллы гидроксиапатита:

Неколлагеновые белки — амелогенины, энамелины, Са-связывающий белок эмали. В процессе созревания эмали количество амелогенинов уменьшается, а энамелинов — увеличивается. Энамелины прочно присоединяются к кристаллам апатитов.
Са-связывающий белок играет главную роль в формировании белковой матрицы — основы эмали. Трехмерная сеть эмали образуется путем объединения в пространстве молекул Са-связывающего белка с ионами Са. Эта сеть (матрица) — зона нуклеации для роста кристаллов ГА. Она фиксируется на волокнах амелогенинов.
Дентин. Первичный дентин образуется в период прорезывания и формирования зубов, составляет основную часть дентина; вторичный (физиологический вторичный) образуется в сформированном зубе после прорезывания и является продолжением первичного; третичный (репаративный вторичный) образуется в ответ на действие раздражающих факторов напротив пораженного участка эмали. Отростки одонтобластов проходят через дентин до эмали и формируют каналы для трофики (питания) зуба. Они заполнены дентиновой жидкостью, которая выполняет минерализующую и сенсорную функции.
Минеральный компонент — ГА, но соотношение Са/Р не 1,67, а 1,5–1,67. F в 2 раза больше, чем в эмали, а Mg в 3 раза больше, чем в костях.
Органический компонент — коллаген I типа и неколлагеновые белки (протеогликаны и фосфопротеины). Они способны связывать кальций и соединяться с коллагеном.
В дентине есть и аморфная (некристаллическая) фаза, в которой имеются фосфат и карбонат кальция.
Цемент. Похож на костную ткань, поэтому называется «костаген», но в отличие от нее не имеет сосудов и не подвергается постоянной перестройке.
Минеральный компонент — в основном ГА.
Органический компонент — коллаген I типа, протеогликаны, липиды.
Пульпа. Содержит сосуды и нервы и выполняет трофическую, защитную, репаративную функции.
а) Минеральный обмен в зубах. Минеральный состав зубов, как и кости, представлен гидроксиапатитом с абсорбированными в нем карбонатами и различными катионами, связанными друг с другом в плотную кристаллическую массу. В зубах постоянно идет процесс смены старых минеральных компонентов, постепенно вымываемых из зубов, на новые, поступающие им на смену. Процесс поступления и рассасывания наблюдается главным образом в дентине и цементе и очень ограниченно представлен в эмали. В эмали процессы обмена осуществляются в основном за счет диффузионного обмена с компонентами слюны, и практически не представлен процесс обмена с растворами, присутствующими в пульпе зуба.
Скорость вымывания и позиционирования минералов в цементе почти равна скорости этих процессов в окружающей кости челюсти, в то время как скорости абсорбции и поступления минералов в дентин составляют только 1/3 таковых в кости. У цемента функциональные характеристики — почти такие же, как у обычной кости, включая присутствие остеобластов и остеокластов, в то время как дентину эти характеристики не свойственны, как говорилось ранее. Эта разница, несомненно, объясняет различия скоростей минерального обмена.
В итоге постоянный обмен минеральных веществ наблюдается в дентине и цементе зуба, хотя механизм этого обмена в дентине не ясен. Эмаль обнаруживает чрезвычайно медленный обмен минеральных составляющих, поэтому в ней сохраняется по большей части неизменным один и тот же состав минеральных солей в течение всей жизни.
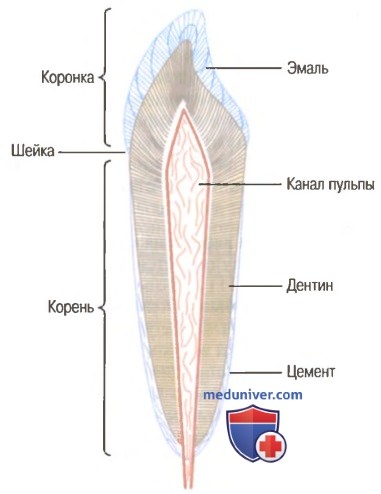
Функциональные отделы зуба
б) Патология зубов. Двумя наиболее распространенными видами патологии зубов являются кариес и нарушения прикуса. Кариес проявляется разрушением зубов, а нарушение прикуса заключаются в нарушении проекции верхних и нижних зубов по отношению друг к другу и отсутствии правильного смыкания зубов.
в) Кариес, роль бактерий и потребляемых углеводов. Не вызывает возражений мнение о том, что кариес является результатом воздействия на зубы бактерий, наиболее распространенной из которых является Streptococcus mutatis. Первым признаком развивающегося кариеса служит появление пигментации — налета, образованного выпавшими в осадок веществами, присутствовавшими в слюне и пище. Эти пятна заселяет большое количество бактерий — такой комбинации вполне достаточно для развития кариеса. Бактерии нуждаются в углеводах в качестве источника питания. Если углеводов достаточно, метаболические системы микроорганизмов мощно активируются, и бактерии начинают размножаться. Кроме того, они выделяют кислоты, особенно молочную кислоту, и протеолитические ферменты. Кислоты являются основной причиной развития кариеса, потому что соли кальция зубов при повышении кислотности среды медленно растворяются. Если минеральные вещества начали растворяться, то остающийся органический матрикс гидролизуется протеолитическими ферментами.
Эмаль зуба является первым барьером на пути развивающегося кариеса. Эмаль гораздо более устойчива к деминерализации кислотами, чем дентин, в первую очередь потому, что кристаллы эмали плотнее и почти в 200 раз больше по объему, чем кристаллы дентина. Если кариес проникает через эмаль к дентину, то он ускоряется во много раз, т.к. растворимость минеральных веществ дентина существенно выше, чем солей эмали.
В связи с тем, что бактерии, вызывающие кариес, нуждаются в углеводах как источнике питания, часто утверждают, что использование в рационе больших количеств углеводов ведет к быстрому развитию кариеса, однако в этом случае важно не количество углеводов, а частота их употребления. Если углеводы съедать многократно маленькими порциями в течение дня, то бактерии в итоге постоянно получают свой излюбленный метаболический субстрат, что и ускоряет развитие кариеса.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Комплексный анализ основных витаминов и микроэлементов, необходимых для поддержания здоровья костной ткани.
Микронутриенты для здоровья костной ткани.
Синонимы английские
Vitamins and trace elements for bone health.
Высокоэффективная жидкостная хроматография.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 8 часов до исследования, можно пить чистую негазированную воду.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Костная ткань состоит из кристаллов гидроксиапатита ((Ca)10(PO4)6(OH)2), других ионов и коллагеновых волокон, заключенных в основное вещество из гликопротеинов и протеогликанов. Для нормального формирования кости требуется энергия, аминокислоты, микроэлементы и витамины. Дефицит этих компонентов приводит к замедлению роста кости, деформациям, остеопорозу и переломам.
Основная роль в поддержании здоровья костной системы принадлежит кальцию, фосфору и витамину D. Кальций Ca – это основной минерал кости. Скелет взрослого человека включает около 1 кг кальция. Во многих исследованиях было доказано, что именно кальций определяет, каким будет пик костной массы в молодости и как быстро будет происходить резорбция костной ткани в процессе старения. Также известно, что назначение препаратов кальция в постменопаузе улучшает состояние костей и позволяет снизить риск патологических переломов.
Фосфор P в виде фосфата необходим для формирования гидроксиапатита, а его дефицит может приводить к торможению роста и минерализации кости. С другой стороны, избыток фосфора, особенно в сочетании с дефицитом кальция, может вызывать вторичный гиперпаратиреоз и таким образом усиливать резорбцию кости.
Главная роль в регуляции уровня кальция и фосфора принадлежит витамину D. Этот жирорастворимый витамин усиливает всасывание кальция и фосфата в кишечнике и реабсорбцию этих ионов в почечных канальцах. Дефицит витамина Dв детстве приводит к развитию рахита, а во взрослом состоянии – остеомаляции. Назначение витамина Dвместе с кальцием является стандартной мерой профилактики остеопороза.
Кроме кальция, фосфора и витамина D, в поддержании здоровья костной системы также участвуют:
Калий. Калий регулирует реабсорбцию кальция в почечных канальцах. Диета с низким содержанием калия увеличивает потерю кальция с мочой, и наоборот. Потребление калия в высокой дозе связано с повышенной минеральной плотностью костной ткани (МПКТ).
Магний. В нескольких исследованиях показано, что потребление магния в высокой дозе связано с повышенной МПКТ у пожилых женщин и мужчин.
Кремний. Кремний участвует в регуляции синтеза и/или стабилизации коллагена. Было показано, что назначение препаратов кремния связано с повышенной МПКТ.
Цинк. Дефицит цинка сопровождается задержкой роста скелета. Характерным симптомом редкого наследственного нарушения метаболизма цинка – энтеропатического акродерматита – является остановка роста.
Медь – это кофактор лизилоксидазы, участвующей в синтезе коллагена. Тяжелый дефицит меди оказывает отрицательный эффект на процесс формирования кости.
Железо. В нескольких исследованиях было показано, что назначение препаратов железа в повышенной дозе связано с повышенной МПКТ.
Витамин К – это жирорастворимый витамин, выступающий в роли кофактора ферментов, обеспечивающих синтез факторов свертывания крови, и, по-видимому, также необходимый для синтеза некоторых белков скелета. Считается, что витамин К способствует γ-карбоксилированию остеокальцина и препятствует экскреции кальция с мочой. В некоторых исследованиях показано, что уровень витамина К в крови коррелирует с МПКТ.
Несмотря на то что диетологами разработаны оптимальные значения витаминов и микроэлементов для разных возрастных групп и полов, следует помнить, что индивидуальные потребности организма могут несколько отклоняться от общепринятых норм. В связи с этим результат этого комплексного анализа, а также последующие диетологические рекомендации следует оценивать комплексе с анамнестическими, клиническими и другими лабораторными данными.
Полный состав исследования:
Для чего используется исследование?
- Для оценки баланса витаминов и микроэлементов, необходимых для здоровья костной системы.
Когда назначается исследование?
- При профилактическом осмотре пациентов, особенно в возрасте 65 лет и старше.
- При наличии патологических переломов и/или существенного уменьшения роста.
- При обследовании пациентов с факторами риска дефицита витаминов и микроэлементов, необходимых для здоровья костной системы: заболевания пищеварительного тракта (хронический панкреатит, воспалительные заболевания кишечника), прием некоторых лекарственных средств (холестирамин, варфарин), особенности диеты, заболевания почек.
Что означают результаты?
Витамин D, 25-гидрокси (кальциферол): 3 - 49,6 нг/мл.
Витамин К (филлохинон): 0,1 - 2,2 нг/мл.
Витамин B9 (фолиевая кислота): 2,5 - 15 нг/мл.
Витамин В12 (цианокобаламин): 189 - 833 пг/мл.
Магний в сыворотке: 12,15 - 31,59 мг/л.
Железо в сыворотке: 270 - 2930 мкг/л.
Кальций в сыворотке: 86 - 102 мг/л.
Кремний в сыворотке: 0 - 500 мкг/л.
Калий в сыворотке: 132,6 - 195 мг/л.
Сера в крови: 100 - 500 мкг/мл.
Фосфор в сыворотке: 22 - 517,1 мг/л.
Медь в сыворотке: 575 - 1725 мкг/л.
Цинк в сыворотке: 650 - 2910 мкг/л.
- алиментарный дефицит (вегетарианские и веганские диеты, голодание);
- период активного роста (подростки), беременность, лактация;
- заболевания кишечника, препятствующие нормальному всасыванию витаминов/микроэлементов (целиакия, болезнь Крона);
- хронический алкоголизм;
- аутоиммунный гастрит;
- прием некоторых лекарственных препаратов (фенитоин, пероральные контрацептивы, метотрексат, варфарин и другие);
- наследственные нарушения метаболизма (например, энтеропатический акродерматит).
Причины повышения клинического значения не имеют, за исключением:
- гемохроматоз (избыток железа);
- гепатолентикулярная дегенерация (болезнь Вильсона – Коновалова – избыток меди);
- гипервитаминоз витаминов D и K;
- хроническая почечная недостаточность (гиперфосфатемия);
- первичный гиперпаратиреоз, саркоидоз, злокачественные опухоли, метастазы в кость (гиперкальциемия).
Что может влиять на результат?
- Возраст;
- пол;
- характер питания;
- физиологическое состояние организма (беременность, лактация, реконвалесценция, интенсивные физические нагрузки);
- прием лекарственных препаратов;
- наличие сопутствующих заболеваний, в том числе заболеваний почек.
- Результат комплексного исследования следует интерпретировать с учетом всех необходимых анамнестических, клинических и дополнительных лабораторных данных;
- для получения точного результата необходимо следовать рекомендациям по подготовке к тесту.
Кто назначает исследование?
Терапевт, врач общей практики, педиатр, гинеколог-эндокринолог, травматолог.
Литература
- Nieves JW. Osteoporosis: the role of micronutrients. Am J Clin Nutr. 2005 May;81(5):1232S-1239S. Review.
- Cashman KD. Diet, nutrition, and bone health. J Nutr. 2007 Nov;137(11 Suppl):2507S-2512S.
- Jugdaohsingh R. Silicon and bone health. J Nutr Health Aging. 2007 Mar-Apr;11(2):99-110.
Рассмотрены результаты экспериментальных и клинических исследований, указывающие на важность компенсации дефицитов микроэлементов в профилактике и терапии остеопороза, остеопении и рахита.
Results of experimental and clinical tests are reviewed that point out importance of compensation of microelements’ deficit in prophylaxis and therapy of osteoporosis, osteopenia and rachitis.
Питание является важным модифицируемым фактором, определяющим развитие и поддержание костной массы. Диета, сбалансированная по калорийности, белку (1 г/кг/сут), жирам и углеводам (не более 60% от общей калорийности пищи) способствует нормальному метаболизму кальция (Ca) в костной ткани. В настоящее время кальций в сочетании с витамином D является основой нутрициальной коррекции для профилактики и лечения остеопороза, остеопении и рахита [1]. Тем не менее, сочетанный прием кальция и витамина D не всегда успешно профилактирует остеопороз, так как не компенсирует всех нутрициальных потребностей костной ткани.
Важность таких факторов питания, как кальций, фосфор (P) и витамин D, для целостности костей неоспорима. Рецептор витамина D, подобно эстрогеновым рецепторам, является фактором транскрипции, который, в частности, регулирует экспрессию белков, вовлеченных в гомеостаз кальция и фосфора. Экспериментальные данные показывают, что физиологические эффекты витамина D включают торможение секреции провоспалительных цитокинов, молекул адгезии и пролиферацию сосудистых гладкомышечных клеток — процессов, которые имеют важное значение для кальцификации артерий [2].
В то же время проводимые в течение последнего десятилетия исследования показали, что для поддержания структуры костной ткани также необходимы витамины A, C, E, K и микроэлементы медь (Cu), марганец (Mn), цинк, стронций, магний (Mg), железо и бор. Дефицит этих микронутриентов замедляет набор костной массы в детстве и в подростковом возрасте и способствует ускоренной потере костной массы в пожилом возрасте [3, 4]. В настоящей работе рассмотрены результаты экспериментальных и клинических исследований, указывающие на важность компенсации дефицитов этих микроэлементов в профилактике и терапии остеопороза, остеопении и рахита. Особое внимание уделяется бору — микроэлементу, оказывающему значительное влияние на структуру костной ткани и, тем не менее, пренебрегаемому в подавляющем большинстве витаминно-минеральных комплексов.
Магний и поддержка соединительной и костной ткани
Одной из принципиально важных нутрициальных потребностей кости является обеспеченность костей магнием — элементом, регулирующим минерализацию, равномерный рост, гибкость и прочность костной ткани и увеличивающим репаративный потенциал костей. И наоборот, дефицит магния в организме препятствует успешной терапии и профилактике нарушений структуры кости (остеопороз и др.). Среди различных тканей организма основным депо магния являются именно костная ткань. Помимо того, что кость является депо магния, магний также оказывает существенное влияние на минерализацию и структуру костной ткани — низкие уровни магния связаны с низкой костной массой и остеопорозом [5].
Магний является одним из принципиально важных нутриентных факторов, воздействующих на соединительную ткань. Недостаточная обеспеченность магнием является одной из важнейших причин нарушений структуры (дисплазии) соединительной ткани. Систематический анализ взаимосвязей между обеспеченностью клеток магнием и молекулярной структурой соединительной ткани указал на такие молекулярные механизмы воздействия дефицита магния, как ослабление синтеза белков вследствие дестабилизации тРНК, снижение активности гиалуронансинтетаз, повышение активности металлопротеиназ, повышенные активности гиалуронидаз и лизиноксидазы [6]. Следует напомнить, что костная ткань состоит только на 70% из кальциевых соединений, а на 22% — из коллагена, 8% составляет водная фракция.
Важность роли магния в поддержании структуры кости связана и с тем, что при хроническом дефиците магния нарушается важнейший аспект минерального обмена костной ткани — отношение Mg:Ca. При снижении соотношения Mg:Ca в сторону дефицита магния обменные процессы в кости замедлены, быстрее депонируются токсичные металлы (прежде всего, кадмий и свинец). Вследствие накопления токсичных элементов в суставе из-за нарушения пропорции Mg:Ca функция суставов постепенно ухудшается: уменьшается объем движений, происходит деформация суставов конечностей и позвоночника. Эпидемиологические исследования частоты остеопороза в различных странах показали, что более высокое значение отношения Mg:Ca в питании соответствует более низкой встречаемости остеопороза [7].
В эксперименте диета с очень низким содержанием магния (7% от нормального уровня потребления) приводила к значительной гипомагниемии, гипокальциемии, характерным для остеопороза изменениям костной ткани у цыплят. Дефицит магния приводит к разрежению костной ткани, вплоть до образования полостей; компенсация дефицита магния — к восстановлению структуры костной ткани [8].
Более высокое диетарное потребление магния соответствует повышенной минеральной плотности кости (МПК) у мужчин и женщин. В исследовании когорты из 2038 человек оценка диетарного потребления магния по опроснику коррелировала с МПК после поправок на возраст, калорийность диеты, потребление кальция и витамина D, индекс массы тела, курение, алкоголь, физическую активность, использование тиазидных диуретиков и эстроген-содержащих препаратов (р = 0,05, мужчины; p = 0,005, женщины) [9].
Материнское питание во время беременности значительно влияет на минеральную плотность костной ткани у детей. Наблюдения за 173 парами мать–ребенок в течение 8 лет после родов показали, что МПК шейки бедра у детей повышалась с повышением диетарной обеспеченности беременной магнием. МПК поясничного отдела позвоночника зависела от обеспеченности беременной магнием, калием, фосфором и калием. Дети, матери которых были адекватно обеспечены указанными минеральными веществами во время беременности, характеризовались значимо бо?льшими значениями МПК (шейка бедра +5,5%, поясничного отдела позвоночника +12%, всего тела +7%) [10].
Железо
Помимо того, что железо необходимо для поддержания достаточной обеспеченности тканей кислородом, этот микроэлемент также участвует в метаболизме коллагена — основного структурного белка всех видов соединительной ткани, в т. ч. костной. Хронический дефицит железа в эксперименте приводит к задержке созревания коллагена в бедренной кости и также к нарушениям фосфорно-кальциевого метаболизма [11]. В эксперименте железодефицитная анемия (ЖДА) приводит к нарушению минерализации и увеличению резорбции кости [12].
По данным крупных клинико-эпидемиологических исследований, ЖДА способствует значительному повышению риска остеопороза и переломов. Например, в лонгитудинальном исследовании 5286 человек (2511 мужчин и 2775 женщин, 55–74 лет) наблюдались в течение 8 лет. Низкие уровни гемоглобина были связаны с когнитивными нарушениями и более низкой костной массой. За время наблюдения у 235 мужчин и 641 женщины был установлен хотя бы один перелом (исключая переломы позвоночника). Уменьшение содержания гемоглобина в крови на одно стандартное отклонение соответствовало повышению риска переломов на 30% у мужчин (р зубной эмали > почках = легких = лимфатических узлах > печени > мышцах = семенниках > мозге [28].
С фармакологической точки зрения препараты бора характеризуются гиполипидемическим, противовоспалительным, антионкологическим эффектами. Дефицит бора стимулирует развитие таких состояний, как анемия, остео-, ревматоидный артрит, когнитивная дисфункция, остеопороз, мочекаменная болезнь и нарушение обмена половых гормонов.
Результаты экспериментальных и клинических исследований, проводимых с начала 1960-х гг., показали, что препараты бора являются безопасным и эффективным средством для лечения некоторых форм артрита. Дальнейшие исследования подтвердили важность обеспеченности бором для поддержания структуры кости. Так, костная ткань пациентов с более высоким потреблением бора характеризовалась более высокой механической прочностью. В тех географических регионах, где потребление бора составляет менее 1 мг/сут, заболеваемость артритом колеблется от 20% до 70%, в то время как в регионах с потреблением 3–10 мг/сут — не более 10%. Эксперименты с моделями артрита показали эффективность перорального или внутрибрюшинного введения препаратов бора [29].
О молекулярно-физиологических механизмах воздействия бора
Бор влияет на активность ряда ферментных каскадов, включая метаболизм стероидных гормонов и гомеостаз кальция, магния и витамина D, также способствуя снижению воспаления, улучшению профиля липидов плазмы и функционирования нейронов [30] (дефицит бора снижает электрическую активность мозга, результаты тестов на двигательную ловкость, внимание и кратковременную память [31]). Бораты могут образовывать сложные эфиры с гидроксильными группами различных соединений, что может являться одним из возможных механизмов осуществления их биологической активности [32]. Повышенное содержание бора в пище повышает экспрессию борат-транспортера (NaBCl) в тощей кишке и понижает — в ткани почек [33].
Хотя детали молекулярных механизмов воздействия бора на физиологические процессы остаются неизвестными, бор оказывает существенное воздействие на процессы роста клеток костной ткани и хряща. Так, бор повышает одонтогенную и остеогенную дифференцировку клеток ростка стволовых клеток зубов. Прием пентабората натрия оказывал дозозависимый эффект на активность щелочной фосфатазы и экспрессию генов, связанных с одонтогенезом [34]. Поэтому дефицит бора во время беременности, наряду с дефицитами кальция и других микронутриентов, также будет способствовать нарушениям развития зубов и у беременной, и у ребенка.
Бор дозозависимо влияет на процессы дифференцировки стромальных клеток костного мозга. Концентрации бора в 1, 10 и 100 нг/мл повышали, а уровни более 1000 нг/мл ингибировали дифференцировку клеток (р
О. А. Громова* , 1 , доктор медицинских наук, профессор
И. Ю. Торшин*, кандидат физико-математических наук
О. А. Лиманова**, кандидат медицинских наук
* РСЦ Международного института микроэлементов ЮНЕСКО, Москва
** ГБОУ ВПО ИвГМА МЗ РФ, Иваново
Читайте также:

