Стволовые клетки пульпы зуба
Опубликовано: 24.04.2024
Велиханова Л.К.,Фирсова И.В.
Резюме
Стволовые клетки пульпы зуба - новое направление в клеточной заместительной терапии.
Ключевые слова
Статья
Медицина XXI века характеризуется созданием новой парадигмы в терапевтических подходах: на смену традиционным методам лечения приходит более эффективное использование внутренних возможностей самого организма. Появилось новое направление в медицине – клеточная заместительная терапия, основанная на способности стволовых клеток к восстановлению поврежденных в результате болезни или травмы тканей и органов человека. Клеточную терапию изучают сегодня по всему миру по различным направлениям, в том числе и лечения наследственных и приобретенных заболеваний, до последнего времени считавшихся неизлечимыми с помощью традиционных подходов. Стволовые клетки успешно применяют в лечении более 100 видов тяжелых болезней, среди которых инфаркт миокарда, хроническая сердечная недостаточность, инсульт, нейродегенеративные заболевания, ювенильный диабет, травмы головного и спинного мозга, а также в ряде онкологических и наследственных заболеваний.
Массовое применение стволовых технологий ограничено законодательной базой. Но в России в решении этого вопроса имеются явные положительные тенденции. 18 января 2013 года Министерством Здравоохранения РФ был рассмотрен очередной вариант проекта Федерального Закона «об обращении биомедицинских клеточных технологий», регулирующий отношения, возникающие в связи с разработкой, доклиническими исследованиями, экспертизой, государственной регистрацией, клиническими исследованиями, производством, хранением, утилизацией, применением, мониторингом применения, ввозом в Российскую Федерацию, вывозом из Российской Федерации биомедицинских клеточных продуктов [2].
Стволовые клетки – это недифференцированные (незрелые) клетки, имеющиеся во всех многоклеточных организмах, они способны самообновляться, образуя новые стволовые клетки, делиться посредством митоза и дифференцироваться в специализированные клетки, то есть превращаться в клетки различных органов и тканей. Развитие многоклеточных организмов начинается с одной стволовой клетки - зиготы. В результате многочисленных циклов деления и процесса дифференцировки образуются все виды клеток, характерные для данного биологического вида. В человеческом организме таких видов клеток более 220. Стволовые клетки сохраняются и функционируют и во взрослом организме, благодаря им может осуществляться обновление и восстановление тканей и органов. Тем не менее, в процессе старения организма их количество уменьшается [1].
Все стволовые клетки обладают двумя свойствами: самообновлением, то есть способностью сохранять неизменный фенотип после деления (без дифференцировки) и потентностью (дифференцирующим потенциалом), или способностью давать потомство в виде специализированных типов клеток.
Существуют два механизма, поддерживающих популяцию стволовых клеток в организме: асимметричное деление, при котором продуцируется одна и та же пара клеток (одна стволовая клетка и одна дифференцированная клетка) и стохастическое деление: одна стволовая клетка делится на две более специализированных.
Выделяют четыре основных типа стволовых клеток: эмбриональные, фетальные, соматические и мезенхимальные.
Эмбриональные стволовые клетки обнаруживаются на самой ранней стадии развития зародыша. Оплодотворенная яйцеклетка (зигота) начинает делиться через 30 часов с момента оплодотворения, и к третьему-четвертому дню эмбрион представляет собой компактный шар, состоящий из 12 или более клеток. Еще через пять-шесть дней эмбриональные клетки формируют полую клеточную сферу диаметром 150 микрон - бластоцисту. Клетки внутренней клеточной массы - бластоцисты (около 30 клеток) и есть эмбриональные стволовые клетки. Их отличительная особенность - способность к образованию из одной первоначальной клетки целой линии генетически идентичных клеток.
Фетальные стволовые клетки, в конце концов, развиваются в различные органы. Пока хорошо изучены три разновидности фетальных клеток: нейральные стволовые клетки (включая клетки нервного гребня), гематопоэтические стволовые клетки и клетки - предшественники b-клеток поджелудочной железы, вырабатывающих инсулин.
Нейральные стволовые клетки способны трансформироваться в клетки головного мозга. Клетки нервного гребня дифференцируются в клетки, иннервирующие сердце и стенку кишечника, пигментные клетки кожи (меланоциты), хрящ и кости лица, соединительную ткань и другие. Гематопоэтические стволовые клетки превращаются в разнообразные элементы крови. Большое число таких клеток содержат пуповина и плацента.
Соматические стволовые клетки способны превращаться не во все, а только в клетки определенных типов, образующие ткани взрослого организма. Возможность их использования для регенерации тканей была открыта несколько десятилетий тому назад. Источниками соматических стволовых клеток в организме взрослого человека являются костный мозг, периферическая кровь, жировая ткань, головной мозг, скелетная мускулатура, пульпа зуба, печень, кожа, слизистые оболочки желудочно-кишечного тракта, поджелудочная железа. Клетки данного вида поддерживают обновление тканей на протяжении всей жизни человека.
Соматические стволовые клетки, выделенные из костного мозга, могут превращаться в клетки головного мозга. А аналогичные клетки, полученные из ткани головного мозга, способны трансформироваться в клетки крови и мышечной ткани. В некоторых органах соматические стволовые клетки генерируют клетки нескольких типов. К примеру, стволовая клетка нервной ткани может дифференцироваться в нейроны головного мозга, глиальные клетки и астроциты. Подобная способность клеток к трансформации называется пластичностью.
Особый интерес представляют собой стволовые клетки взрослого организма, получение которых не связано с разрушением эмбриона человека, как в случае с эмбриональными стволовыми клетками. Наиболее распространенный тип мультипотентных стволовых клеток, способных к дифференцировке в остеогенном, хондрогенном и адипогенном направлении и который в настоящее время широко используется для разработки новых клеточных биомедицинских технологий, это мезенхимные стволовые клетки. Их возможно выделять из костного мозга, из жировой ткани, хрящей, пуповины и пуповинной крови, плаценты, пульпы зубов и других тканей человека [1,4,6,9].
Одним из перспективных источников стволовых клеток являются зачатки и пульпа третьих моляров человека. Главным преимуществом этого источника является доступность биологического материала. По своим морфологическим и фенотипическим свойствам эти клеточные популяции аналогичны мезенхимным стволовым клеткам человека, поскольку они обладают свойством клоногенности, способны пролиферировать как в условиях in vitro, так и in vivo, характеризуются мультипотентностью направлений дифференцировки. По результатам исследований по выделению, фенотипическому и генетическому анализу стволовых клеток, полученных из зачатков третьих моляров человека, показано, что полученные клетки обладают фенотипом, аналогичным мезенхимных стволовым клеткам, экспрессируют высокий уровень мРНК генов факторов транскрипции, характерных для плюрипотентных стволовых клеток, и способны к дифференцировке в адипогенном, хондрогенном, остеогенном и нейрональном направлении. Что немало важно, эксперименты по криоконсервации стволовых клеток из зачатков третьих моляров человека показали, что заморозка и хранение клеток не оказали существенного влияния на способность к пролиферации, дифференцировке и нейропротекции на модели in vitro [4].
Стволовые клетки возможно также получать из пульпы молочных зубов.
Изучением стволовых клеток пульпы молочных зубов впервые занялся детский стоматолог сотрудник Национального института стоматологических и черепно-лицевых исследований США доктор С. Ши (Songao Shi) в 2002 году. Пульпа зуба содержит 4 типа стволовых клеток – хондроциты, остеобласты, адипоциты и мезенхимальные стволовые клетки, которые можно успешно и быстро вырастить, значительно увеличив их количество и сохранив потенциал к преобразованию в другие типы клеток.
Из хондроцитов формируется хрящевая ткань, которую сегодня уже применяют в лечении артритов, артрозов, коллагенозов и других различных заболеваний, вызывающих повреждение суставов. Остеобласты можно использовать в качестве «строительного материала» костной ткани.
Адипоциты восстанавливают поврежденную сердечную мышцу, преобразуясь (дифференцируясь) в кардиомиоциты и миобласты, которые сегодня используются в кардиомиопластике при лечении заболеваний сердца и сердечно-сосудистой системы. Мезенхимальные стволовые клетки способны дифференцироваться в широкий спектр клеточных типов организма и давно используются в терапии.
Дальнейшие эксперименты с выпавшими у детей молочными зубами, показали, что стволовые клетки из пульпы, растут гораздо быстрее и они намного пластичнее в своем преобразовании в другие типы клеток, формирующие ткани и органы, при сравнении с таковыми, выделенными из периферической крови или костного мозга взрослого человека[3,4].
В 2012 году ученые из университета стоматологии Японии (Nippon Dental University) под руководством профессора Кена Яэгаки (Ken Yaegaki) в Journal of Breath Research опубликовали данные своего исследования, посвященного дифференцировке стволовых клеток пульпы зуба в клетки печени [12]. В качестве индуктора был изпользован сероводород. Выделенные из удаленных зубов стволовые клетки культивировали в специальной среде с добавлением индуктора и без него. В результате, через несколько дней, обработанные клетки дифференцировались в клетки печени и обладали способностью накапливать гликоген, проведенные тесты доказали, что полученные клетки действительно обладают всеми свойствами гепатоцитов. С помощью нового метода образовалось большое число клеток печени, с высокой степенью чистоты популяции. Это значит, что после нескольких дней культивирования, все обработанные клетки дифференцировались в гепатоциты, что является важным условием для пересадки.
В настоящее время в России услуги по организации выделения, размножения и персонального долгосрочного хранения стволовых клеток, полученных из молочных и постоянных зубов, предоставляют Банки стволовых клеток.
Из пульпы здорового зуба можно выделить всего несколько клеток, их количество от 12 до 20 клеток. Для того чтобы клетки можно было использовать в будущем, в Банке их культивируют и доводят количество до терапевтической дозы, которая составляет более 1 миллиона клеток. При этом клетки обязательно проходят контроль на бактериальную стерильность и жизнеспособность. Длительное хранение проводится в парах жидкого азота в сосудах Дьюара. Температура в них составляет ниже -150 С о . Перед замораживанием клетки обрабатываются криопротектором. Он делает мембраны клеток эластичнее и не позволяет образовываться остроконечным кристаллам, которые могут повредить при замерзании целостность клетки. В таких условиях клетки, выделенные из зубов, могут храниться очень долго. Первые исследования по криохранению были начаты более 20 лет назад. Регулярно ученые проверяют состояние клеток, замороженных в те времена, в течение всего это срока, клетки не меняют свои свойства к делению, преобразованию (дифференцировке), способности приживления и замещения поврежденных при травме или болезни участков организма, которые так помогают в регенерации, восстановлении и выздоровлении[7].
Сегодня стволовые клетки пульпы зубов можно применять в реконструкции тканей и органов (восстановлении костной и хрящевой тканей, формировании зачатка зуба и восстановлении его тканей, реконструкции печении и почек, мочевого пузыря, реконструкции роговицы, маммопластике). Стволовые клетки активно используются в черепно-лицевой хирургии при врожденных патологиях - расщелинах губы и неба, при восстановлении нарушений формирования и деформации костей челюстно-лицевой области, вызванных опухолью, инфекционными заболеваниями или травмой. В кардиопластике при лечении заболеваний сердечно-сосудистой системы: ишемии, инфаркте миокарда; при системных прогрессирующих заболеваниях: коллагенозах, артрозах, артритах; гломерулонефрите; при неврологических заболеваниях (боковом амиотрофическом склерозе, рассеянном склерозе), в ожоговой терапии. При некоторых видах онкологических заболеваний, вызывающих поражение соединительной, костной и хрящевой тканей,при диабете 1-го типа, при омоложении кожи6.
Таким образом, список заболеваний, которые лечат стволовыми клетками, увеличивается с каждым днем. Разрабатываются новые протоколы терапевтического применения стволовых клеток в лечении патологий и травм. Необходима планомерная научно-исследовательская работа по основным направлениям современных биомедицинских технологий с целью решения актуальных проблем клинической медицины, а также разработка адекватной правовой базы для повышения доступности применения стволовых клеток, источником, которых могут быть дентальные ткани в практическом здравоохранении, в частности в стоматологии.

Сегодня около 150 миллионов взрослых в мире страдают от потери зубов, и, по прогнозам, в течение текущего десятилетия будет зарегистрировано более 10 миллионов новых случаев эдентулизма [1; 2]. В течение жизни большинство взрослых сталкивается с проблемами потери зуба(ов) вследствие генетических нарушений или заболеваний бактериального происхождения, воздействия ятрогенных, травматических или терапевтических факторов, а также недостаточной гигиены полости рта 1. В настоящее время в качестве методов лечения / замены зубов активно используются такие стоматологические клинические процедуры, как лечение корневых каналов и имплантация зубов, однако это со временем ведет к снижению чувствительности зубов и потере жизнеспособности, а также нарушениям распределения механической нагрузки при жевании и движению альвеолярных костей 7. Несомненно, эти недостатки обусловливают постоянный поиск альтернативных методов лечения и восстановления утраченных зубов. В последнее время все более активно обсуждаются возможности создания биоинженерных конструктов – зубов с применением биоинженерных скэффолдов, стимуляции формирования третичного дентина, клеточной терапии, гибридных тканеинженерных систем, генноопосредованной регенерации зуба [2; 7-9].
Несомненно, подходы тканевой инженерии и клеточных методов лечения способствуют регенерации более предсказуемым образом и позволяют расширить терапевтические границы регенеративной терапии. В последние годы получено достаточное количество данных о возможности выделения стволовых клеток из пульпы зубов как детей (молочные зубы), так и взрослых 12. Эти данные имеют существенное значение, поскольку возможность получения стволовых клеток из зубов не несет никаких этических противоречий в отличие от эмбриональных стволовых клеток, является неинвазивной и гораздо более экономически выгодной процедурой, возможной к выполнению в течение всей жизни человека [13; 14]. Также, по данным последних проведенных исследований, выживать и сохранять свой регенеративный потенциал могут даже стволовые клетки, выделенные из зубов с пульпитом [15]. Основная популяция клеток, которые могут быть получены из пульпы зуба, - мезенхимальные стволовые клетки (МСК). В качестве возможных источников взрослых МСК для регенерации зубов сегодня рассматриваются несколько типов клеток - это МСК зуба [10], а также МСК из незубных интраоральных источников, прежде всего – слизистой оболочки щеки, десны, надкостницы, и МСК из других источников: костного мозга, жировой ткани, пупочного канатика [11; 12]. Эти клетки способны к самообновлению и мультилинейной дифференцировке, характеризуются высокой способностью к пролиферации и сегодня рассматриваются как перспективные возможные источники для применения в регенеративной стоматологии.
Цель исследования: разработка протокола выделения МСК из пульпы удаленных по ортодонтическим показаниям третьих моляров, сравнение дифференцировочного потенциала и фенотипа поверхностных антигенов с характеристиками МСК, полученных из других источников и охарактеризованных согласно существующим паспортам клеточных линий (данные Российской коллекции клеточных культур (РККК)).
Материалы и методы
В исследовании были использованы удаленные по ортодонтическим показаниям третьи моляры (n=20) пациентов обоего пола в возрасте 16-35 лет, без видимых кариозных поражений и признаков воспаления. Получено информированное согласие пациентов в письменной форме на удаление зубов и последующее выделение из них МСК для исследовательских целей.
Удаленный хирургическим путем зуб помещался в стерильный пластиковый контейнер, содержащий 5 мл стерильного физиологического раствора с 0,02% антибиотика (пенициллин-стрептомицин). Контейнер осторожно запечатывался и помещался в транспортный сосуд с заданной температурой +2+4 °С. Время от забора до поступления образца в лабораторию не превышало 2 часов.
В лаборатории поверхность зуба трижды очищалась и промывалась стерильным физиологическим раствором комнатной температуры. Выделение клеток из пульпы зуба проводилось ферментативным способом. Для этого зуб помещался в чашку Петри диаметром 60 мм, где проводилось предварительное промывание пульпарной камеры зуба 2 мл 0,5%-ного раствора коллагеназы II типа, после чего зуб находился в 2 мл 0,5%-ного раствора коллагеназы II типа в течение 1 часа при 37 °C. Затем выделенные клетки в 2 мл раствора коллагеназы II типа были собраны в пробирку объемом 15 мл, куда для остановки процесса ферментации было добавлено 3 мл рабочей питательной среды - DMEM/F12 в соотношении 1:1 (ПанЭко). Полученная клеточная суспензия центрифугировалась в течение 5 мин на 1000 об/мин при комнатной температуре. Супернатант тщательно отбирался, после чего клеточный осадок был ресуспендирован в 1 мл полной питательной среды, содержащей DMEM/F12 в соотношении 1:1, 10% FBS, 100 мкМ L-аскорбиновой кислоты,2 mM L-глутамина, 100 U/мл пенициллина, 100 мг/мл стрептомицина и 0,25 мг/мл амфотерицина B 18. Полученная суспензия клеток пульпы зуба помещалась на культуральные планшеты 25 см 2 , содержащие полную питательную среду, и в дальнейшем инкубировалась при 37 °C и 5% CO2.
Замена культуральной среды проводилась 1 раз в 2-3 дня до достижения конфлюентности 80%. Пересев культур проводился согласно стандартному протоколу пересева монослойных культур в соотношении 1:3 1 раз в 7-8 дней. Для дальнейшего анализа использованы клетки на 2-3 пассажах.
Анализ характеристик клеточной популяции
Для определения соответствия выделенных клеток фенотипическим маркерам МСК оценивали ряд критериев: морфологический критерий, экспрессия типичных поверхностно-клеточных маркеров, способность к дифференцировке в определенные типы клеток. Оценка формы клеток выполнялась методом световой микроскопии. Анализ характерных для МСК маркеров (наличие CD73, CD90, CD105, отсутствие CD14, CD20, CD34, CD45) выполнен методом проточной цитофлуориметрии (проточный цитофлуориметр Beckman Coulter, FC500; набор для анализа MSC phenotyping kit, human, #130-095-198, Miltenyi Biotec) согласно инструкции производителя.
Проанализирована способность выделенных клеток дифференцироваться в остео- и хондрогенном направлении, а также способность дифференцироваться в специфические клетки – одонтобласты. С целью определения свойственной МСК способности дифференцироваться в остео- и хондрогенном направлении выделенные клетки в концентрации 1 × 10 4 клеток/см 2 внесены в два культуральных флакона 25 см 2 (Corning-Costar, #430372) с добавлением стандартных дифференцирующих сред (StemPrо, Chondrogenesis Differentiation Kit, #A1007101, Gibco; StemPro, Osteogenesis Differentiation Kit, #A1007201, Gibco) и помещены в СО2-инкубатор (37 °С, 5%СО2) в соответствии с инструкцией производителя и с заменой дифференцирующей среды каждые 3 дня, пересевом культуры 1 раз в 7-8 дней. Продолжительность культивирования клеток в данных условиях составляла 30 дней. По завершении периода дифференцировки анализировалась морфология дифференцированных клеток (световая микроскопия), проведена гистохимическая окраска (по Фон Коссу, с использованием железного гематоксилина и метахроматического красителя). Анализ экспрессии маркеров одонтобластов выполнен иммуноцитохимическим методом (стандартный протокол) с оценкой экспрессии характерного маркера – дентального сиалофосфопротеина (DSPP) [17; 20] в популяции МСК, дифференцированных используемой при остеогенной дифференцировке стандартной дифференцирующей средой (флуоресцентный имэджер ZOE, BioRad; первичные антитела anti-DSPP, Abcam, ab216892; вторичные антитела – антитела козы к IgG, IgA, IgM кролика с ФИТЦ (f-GAR Iss), Имтек).
Непрерывные переменные представлены в виде средних значений стандартного отклонения для числа наблюдений (среднее ± стандартное отклонение). Все данные проверены на нормальность распределения и равенства стандартного отклонения перед анализом. Сравнение непрерывных переменных выполнялось с использованием теста Стьюдента. Критерием достоверности является 95%-ный доверительный интервал (ДИ). Статистический анализ проводился с использованием программы Statistica, ver 11.0.
Результаты
Протокол выделения клеток составлен на основе собственного опыта работы с культурой МСК и разработан для источника – зуб человека с учетом современных данных [16-19; 21; 22]. Все процедуры выделения (n=20) клеток из удаленных зубов выполнены успешно. При динамическом наблюдении за культурами клеток к концу 1-х суток культивирования отмечено формирование колоний клеток. Большая часть клеток приобретала характерную для МСК [18; 22] фибробластоподобную форму (рис. 1А). При последующих заменах питательной среды все клетки имели характерную фибробластоподобную форму (рис. 1Б).
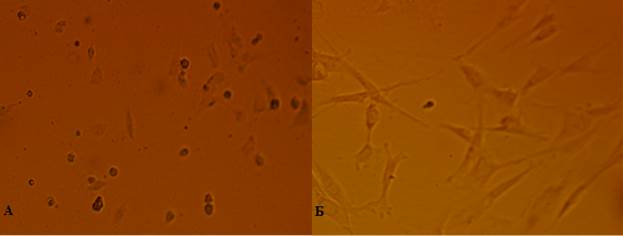
Рис. 1. А – клетки, выделенные из пульпы зуба через 24 часа культивирования. Б - клетки, выделенные из пульпы зуба, 10-е сутки культивирования
Анализ характеристик клеточной популяции
При определении принадлежности выделенных клеток к МСК проанализирована экспрессия характерных для МСК маркеров методом проточной цитофлуориметрии. Установлено, что выделенные из пульпы удаленных зубов культуры характеризуются высоким уровнем экспрессии характерных для МСК маркеров – CD90 и CD105, что составило 98,5 ± 3,8% и 96,8 ± 2,9% соответственно, и отсутствием экспрессии маркеров CD14, CD20, CD34 и CD45. Полученные результаты в сравнении с имеющимися паспортами клеток МСК из различных незубных источников (данные РККК, Российская коллекция клеточных культур позвоночных, Санкт-Петербург, ИНЦ РАН, 2016, составители Полянская Г.Г., Сакута Г.А., Еропкин М.Ю., Смирнова Т.Д., Подчерняева Р.Я., Михайлова Г.Р., Дьяконов Л.П., Гальнбек Т.В., Глинских Н.П., Бахарев А.А.) – костный мозг эмбриона, эмбриональные стволовые клетки, мышца конечности эмбриона, кожа век взрослого донора, позволяют достоверно отнести выделенные из пульпы зуба клетки к пулу МСК (таблица, рис. 2).

Рис. 2. Экспрессия маркеров CD90, CD105 МСК, выделенными из пульпы удаленных третьих моляров
Сравнительные характеристики МСК из различных источников (на основании данных паспортов клеточных линий РККК)
Новосибирский государственный медицинский университет Минздравсоцразвития РФ
Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии, Москва, Россия
Регенерация пульпы зуба с использованием аутологичных мезенхимальных стволовых клеток пульпы и обогащенной тромбоцитами плазмы
Журнал: Стоматология. 2017;96(6): 12-16
Кулаков А. А., Гольдштейн Д. В., Кречина Е. К., Волков А. В., Гаджиев А. К., Регенерация пульпы зуба с использованием аутологичных мезенхимальных стволовых клеток пульпы и обогащенной тромбоцитами плазмы. Стоматология. 2017;96(6):12-16. https://doi.org/10.17116/stomat201796612-16
Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии Минздравсоцразвития, Москва





Регенерация пульпы и дентина может иметь важное значение в терапевтической стоматологии в качестве метода, направленного на сохранение зубов. В настоящее время выделены и охарактеризованы клеточные популяции, содержащиеся в пульпе молочных и взрослых зубов человека и лабораторных животных. В настоящей работе показано, что трансплантация аутологичных мультипотентных стромальных клеток пульпы зуба миниатюрных свиней в сочетании с аутологичной обогащенной тромбоцитами плазмой приводит к восстановлению пульпы зуба, репаративному дентиногенезу с образованием дентиновых мостиков уже к 30-м суткам наблюдения. Однако завершение регенерации приводит не только к восстановлению основных структур, но и к уменьшению объема пульпарной камеры вследствие напластования неодентина. Восстановление тканей пульпы зуба при нарушении целостности пульпарной камеры в отсутствие воспалительных процессов является перспективным направлением использования клеточных технологий.
Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии Минздравсоцразвития, Москва
ФГБУН «Институт проблем лазерных и информационных технологий» РАН
отделение функциональной диагностики ФГБУ «Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии» Минздрава России, Москва, Россия
Новосибирский государственный медицинский университет Минздравсоцразвития РФ
Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии, Москва, Россия
Введение
Традиционно в качестве лечения пульпита у взрослых пациентов применяется экстирпация — полное удаление пульпы с последующей обработкой и пломбировкой пульпарной камеры и корневых каналов. Подобным образом поступают и при случайном вскрытии пульпы или сколе зуба, нарушающем целостность пульпарной камеры. При пульпотомии происходит удаление всех клеток пульпы, включая одонтобласты, участвующие в формировании дентина, что приводит к повышению хрупкости зуба, нарушению его интеграции с окружающими тканями и в результате — к его полной утрате [14]. Восстановление жизнеспособной ткани пульпы зуба при нарушении целостности пульпарной камеры в отсутствие воспалительных процессов является важной клинической задачей, позволяющей сохранить зуб и избежать затратной и не всегда эффективной установки имплантатов. Для регенерации соединительной ткани пульпы могут быть использованы стволовые клетки, извлеченные из пульпы выпавших или удаленных зубов самого пациента или доноров (аллогенные).
В настоящее время выделены и подробно охарактеризованы культуры стромальных мезенхимальных клеток (МСК) из пульпы молочных и коренных зубов — описан их иммунофенотип, исследованы пролиферативная активность и дифференцировочный потенциал [6, 13]. Показано, что, как и МСК из других источников, клетки пульпы способны к дифференцировкам в остеогенном, хондрогенном и адипогенном направлении. Но помимо этих потенций, МСК пульпы способны также к нейрональной дифференцировке, что определяется происхождением данных клеток из эктомезенхимы — производной нейрального гребня [6, 8]. Трансплантация данных клеток позволит обеспечить надлежащую иннервацию и создаст условия для формирования жизнеспособной рыхлой волокнистой соединительной ткани пульпы.
Показано, что клеточные культуры МСК, полученные из пульпы, могут быть криоконсервированы и храниться в течение длительного периода без снижения пролиферативного и дифференцировочного потенциала с целью отдаленного применения для регенерации [1, 4, 10]. Подход, основанный на использовании заранее банкированных клеток самого пациента или донорского материала, позволяет в кратчайшие сроки произвести трансплантацию, что существенно повышает эффективность лечения.
В ряде работ было показано, что подкожная трансплантация клеток пульпы, иммобилизованных на скаффолдах и помещенных во фрагмент депульпированного зуба, приводит к формированию внутри такой конструкции ткани, схожей по строению с соединительной тканью пульпы [3, 5, 12]. Кроме того, участие стволовых клеток в регенерации пульпы было показано непосредственно на модели пульпоэктомии у лабораторных животных [16, 17].
В настоящей работе проведено исследование регенерации ткани пульпы при трансплантации аутологичных мезенхимальных стромальных клеток пульпы коренных зубов в составе фибринового сгустка в пульпарную камеру после пульпоэктомии у миниатюрных домашних свиней. Восстановление тканей пульпы зуба при нарушении целостности пульпарной камеры в отсутствие воспалительных процессов является перспективным направлением использования клеточных технологий.
Материал и методы
Получение культуры клеток пульпы зуба миниатюрных свиней
Для получения культуры мультипотентных стромальных клеток (МСК) пульпы зуба у карликовых домашних свиней удаляли зуб под общей анестезией (золетил 15 мг/кг/рометар 2 мг/кг), исключали очаги воспаления и доставляли в лабораторию во флаконе с транспортной средой: F-12 («ПанЭко», РФ), 500 мкг/л амикацина (ОАО «Синтез», РФ), 10 Ед/мл гепарина натрия («Braun», Германия) при температуре 2—8 °С. Зуб обрабатывали 0,05% раствором хлоргексидина биглюконата (ООО «Росбио», РФ), раскалывали и извлекали пульпу. Ткани промывали раствором Хэнкса с добавлением 0,5 г/л цефазолина (ОАО «Синтез», РФ) (рис. 1), 
Рис. 1. Извлечение пульпы из зуба миниатюрной свиньи. механически измельчали и инкубировали в растворе коллагеназы I типа (2 мг/мл; «ПанЭко», РФ) 60 мин при 37 °C. Полученную клеточную суспензию помещали в чашки Петри и культивировали в ростовой среде: ДМЕМ, 10% ЭТС, 2 mM L-глутамина, 100 мг/л амикацина при стандартных культуральных условиях (37 °С, 5% СО2), производя замену среды на свежую каждые 3 сут. Для экспериментального исследования использовали культуры на 3 пассаже, 60—80% конфлуентности.

Рис. 2. Культура МСК пульпы зуба миниатюрной свиньи, 3 пассаж, ув. 200. Фазовый контраст.

Рис. 3. Моляры и премоляры миниатюрной свиньи после трансплантации.

Рис. 4. а — шлиф резца миниатюрной свиньи через 14 сут после резекции пульпы. Коронка содержит пломбированный канал до пульпарной камеры. Пульпа отсутствует; б — шлиф резца миниатюрной свиньи через 30 дней после резекции пульпы. Коронка содержит пломбированный канал до пульпарной камеры. Пульпа отсутствует. Окраска толуидиновым синим и кислым фуксином. Микроскопия в отраженном свете. Ув. 5.

Рис. 5. а — шлиф моляра миниатюрной свиньи через 14 дней после трансплантации. В пульпарной камере обнаруживается клеточный трансплантат. В области устьев канала грануляционная ткань. Окраска толуидиновым синим и кислым фуксином. Ув. 5; б — шлиф премоляра миниатюрной свиньи через 30 дней после трансплантации. В пульпарной камере признаки регенерации пульпы с начальными признаками образования дентиновых мостиков. Окраска толуидиновым синим и кислым фуксином. Ув. 5; в — шлиф резца миниатюрной свиньи через 60 дней после трансплантации. В пульпарной камере признаки регенерации пульпы в области дна пульпарной камеры и со сформированным дентиновым мостиком. Окраска небесный трихром. Микроскопия в отраженном свете. Ув. 5; г — шлиф резца мини-атюрной свиньи через 60 дней после трансплантации. Отложение массива дентина в области дна пульпарной камеры. Окраска небесный трихром. Микроскопия в отраженном свете. Ув. 50.
Клетки имели характерный для мультипотентных стромальных клеток фенотип — вытянутую или полигональную форму, ядро с 2—3 ядрышками, небольшой размер (5—10 мкм) (см. рис. 1).
Получение обогащенной тромбоцитами плазмы
Для получения плазмы, обогащенной тромбоцитами (platelet-rich plasma, PRP), кровь миниатюрных свиней собирали в пробирки с ЭДТА, центрифугировали при 1100 об/мин в течение 10 мин. Тромбоциты, содержащиеся в супернатанте, осаждали центрифугированием при 3600 об/мин в течение 15 мин и ресуспензировали в половине объема супернатанта.
Получение тканеинженерной конструкции
МСК снимали с чашек Петри раствором Версена с добавлением 0,25% раствора трипсина и центрифугировали 10 мин при 1100 об/мин. Осадок ресуспензировали в обогащенной тромбоцитами плазме крови с получением клеточной суспензии с концентрацией клеток 4 млн в 1 мл плазмы. Для образования фибрина из содержащегося в PRP фибриногена в систему добавляли по каплям тромбин («Cormay»), растворенный в 10% растворе хлорида кальция («ДальХимФарм»). Полимеризация происходила в течение 3—5 мин.
Экспериментальная модель частичной резекции пульпы премоляров и моляров у миниатюрных свиней
Эксперимент проводился на 3 миниатюрных свиньях светлогорской популяции на базе Научного центра биомедицинских технологий РАМН. У животных экспериментальной группы (3 свиньи, 18 моляров) моделировали случайное вскрытие пульпы с пульпотомией. Под общей анестезией (золетил 15 мг/кг/рометар 2 мг/кг) алмазным шаровидным бором наносили повреждения на жевательной поверхности моляров. Повреждения были сделаны на глубину 5,5 мм и удаление коронковой пульпы — пульпотомия — осуществляли острым стерильным экскаватором. Орошение вскрытой корневой пульпы осуществляли антисептическим раствором хлоргексидином биглюконата 0,5%. Гемостаз после удаления пульпы из полости зуба и устьев каналов осуществляли на основе 20% сульфата железа. После полной остановки кровотечения проводили покрытие «культи» пульпы трансплантатом, полость закрывали пломбой FUJI IX (GC, Япония). Через 2 нед (1-е животное), 4 нед (2-е животное), 12 нед (3-е животное) свиньи подверглись эвтаназии путем передозировки внутривенно (раствором золетила 100 мг/кг) в соответствии с Приложением № 4 к Правилам проведения работ с использованием экспериментальных животных (Приказ № 755 от 12.08.77) и был проведен забор блоков челюстей.
Гистологическая проводка недекальцинированных шлифов
Образцы фиксировали в 70% этаноле в течение 15 дней. Затем обезвоживали и заливали в метилметакрилат (Osteo-Bead, Sigma-Oldrich) по стандартной методике, рекомендованной производителем с последующей полимеризацией. Из полученных блоков изготавливались первичные срезы 100 мкм (Isomet 100), из которых готовились шлифы толщиной 40—50 мкм, которые окрашивали кислым фуксином и толуидиновым синим, а также небесным трихромом.
Микроскопическое исследование и документирование
Окрашенные шлифы подвергали микроскопии и документировали с помощью микроскопа Axioplan («Carl Zeiss», Германия).
Результаты
Экспериментальная модель частичной резекции пульпы (группа сравнения)
Через 14 сут после частичной резекции пульпы выявлено, что коронковая часть зуба имеет дефект, заполненный пломбировочным материалом, который также наблюдался на всех последующих сроках. Стенки дефекта ровные, ход канала с жевательной или передней поверхности коронки перпендикулярно к пульпарной камере. Пульпарная камера содержит обрывки волокнистых структур. Волокнистые структуры не содержали клеточных элементов уже на 14-е сутки и в последующем на 30-е и 60-е сутки клеточная популяция не восстанавливалась. Коронка зуба сохраняет целостность своей структуры в течение 30 сут, в последующем к 60-м суткам после повреждения наблюдались трещины и сколы. Пародонтальная щель несколько расширена уже к 14-м суткам и имеет тенденцию к неуклонному расширению в последующие сроки. Собственно, пародонт с повышенной клеточностью: соединительная ткань с большим количеством фибробластоподобных клеток среди волокнистого матрикса. Корни зуба и шейка зуба с очаговыми признаками остеокластической резорбции, чаще в области межкорневой щели. В некоторых случаях было выявлено разобщение прикрепления слизистой оболочки к шейке зуба с формированием узкой, едва заметной щели.
Экспериментальное исследование трансплантации клеточной культуры пульпы зуба миниатюрных свиней (группа наблюдения)
Через 14 сут после частичной резекции пульпы и трансплантации тканеинженерной конструкции, содержащей аутологичные клетки пульпы зуба, выявлено, что коронковая часть зуба имеет дефект, заполненный аморфным белесоватым веществом (пломбировочный материал). Стенки дефекта ровные, ход канала с жевательной или передней поверхности коронки перпендикулярно к пульпарной камере. Пульпарная камера содержит базофильную клеточную структуру — клеточный трансплантат. Устья каналов корней со стороны пульпарной камеры по внутренней поверхности содержат участки с ячеистой структурой, часто богатой сосудами и высокой клеточностью. Указанные структуры напоминают по своему виду грануляционную ткань. Между сосудами нежный рыхлый волокнистый матрикс, который достигал 2/3 объема к 60-м суткам наблюдения. К этому времени на стенках пульпарной камеры заметны отложения дентина в области дна и боковых стенок. А также на поверхности под трансплантатом в виде дентинового мостика. Коронка зуба сохраняет целостность своей структуры на протяжении всех сроков наблюдения. Пародонтальная щель несколько расширена уже к 14-м суткам, однако без значимой прогрессии в течение остального времени наблюдения. Собственно, пародонт с повышенной клеточностью: соединительная ткань с большим количеством фибробластоподобных клеток среди волокнистого матрикса.
Обсуждение
В настоящем исследовании было показано, что при трансплантации МСК пульпы в составе фибринового геля в область дефекта пульпы у миниатюрных домашних свиней уже через 14 сут наблюдается формирование рыхлой волокнистой соединительной ткани, в которой формируются дентиновые мостики, что свидетельствует о созревании функционально активных одонтобластов в области регенерации. Эффективность регенерации пульпы при использовании клеточных технологий зависит от возможности скорейшей трансплантации клеток в область дефекта после нарушения целостности пульпарной камеры. Для обеспечения немедленного введения клетки должны быть заранее получены у пациента или донора и криоконсервированы. В целом ряде исследований было показано, что хранение в жидком азоте не влияет на иммунофенотип, пролиферативную активность и дифференцировочный потенциал клеточных культур из пульпы [1, 4, 10]. При этом могут быть заморожены не только культуры стволовых клеток, а также фрагменты интактной пульпы и целые зубы [7, 9, 10]. В настоящее время уже создано несколько банков для хранения биоматериала из пульпы и периодонтальных тканей. Перед трансплантацией клетки иммобилизовали в фибриновом геле, полученном из плазмы крови, обогащенной тромбоцитами (PRP, platelet-rich plasma). Действие факторов роста, высвобождающихся при активации тромбоцитов, таких как PDGF, TGF-β, IGF-I, EGF, VEGF и др. направлено на стимуляцию ан-гиогенеза, хемотаксиса, митотической и метаболической активности клеток, участвующих в регенерации [2, 15].
Регенерация дентина при трансплантации стволовых клеток из выпавших молочных зубов была ранее уже показана в работе на миниатюрных свиньях [16]. Но в данном исследовании наряду с клеточной культурой использовали дополнительные индукторы — щелочную фосфатазу и бета-трикальцийфосфат, которые, несомненно, внесли свой вклад в регенеративный процесс, тогда как в настоящем исследовании регенерация наблюдалась и без дополнительных стимулирующих агентов.
Эффективность применения дентальных клеток пульпы в сочетании с PRP для регенерации ткани пульпы была исследована также на модели дефектов незрелых зубов у собак [17]. В данной группе было показано формирование дентиновых мостиков, что не наблюдалось при трансплантации кровяного сгустка, клеточной культуры или PRP. Однако, по заявлению авторов, образованная ткань имела остеоподобную структуру и располагалась непосредственно в верхушке каналов, а не в пульпарной камере, как в настоящем исследовании, и восстановления именно тканей пульпы показано не было.
Однако накопленный опыт позволяет приступить к проведению ограниченных клинических испытаний метода. Так исследования по оценке эффективности применения клеток из пульпы выпавших молочных зубов для регенерации тканей пульпы пациентов детского и подросткового возраста уже перешли в клиническую стадию и в 2017 г. закончены испытания метода регенерации пульпы после некроза и инфекции пульпы, основанные на применении аутологичных клеток. https://clinicaltrials.gov/ct2/show/study/NCT01814436. К сожалению, результаты данного исследования к настоящему времени не опубликованы.
Таким образом, трансплантация аутологичных клеток пульпы в сочетании с обогащенной тромбоцитами плазмой может стать перспективным направлением в изучении регенерации ткани пульпы при ее частичной резекции, как модели случайного вскрытия пульпарной камеры в клинической практике.
Работа выполнена при поддержке гранта РНФ N16−15−00298.
Авторы заявляют об отсутствии конфликта интересов.
Доктор медицинских наук А. СМОЛЯНИНОВ, доктор медицинских наук А. ИОРДАНИШВИЛИ, кандидат медицинских наук Д. БУЛГИН.
МЕТАМОРФОЗЫ СТВОЛОВЫХ КЛЕТОК
Предшественники всех клеток, составляющих организм, называются стволовыми. Впервые существование стволовых клеток предположил и доказал в начале ХХ века профессор Императорской Военно-медицинской академии А. А. Максимов.
Абсолютно все клетки органов и тканей имеют одну-единственную "прародительницу" - так называемую мультипотентную стволовую клетку. В процессе деления из одной стволовой клетки образуются две дочерние, из которых одна идентична материнской, а другая может производить разнообразное клеточное потомство, отличное от клетки-предшественницы. Все стволовые клетки обладают способностью воспроизводить себе подобных и могут превращаться в клетки нескольких типов. Это свойство называется мультипотентностью. От поколения к поколению стволовые клетки теряют мультипотентные свойства, приобретая способность превращаться исключительно в клетки одного или нескольких тканевых типов, и в конце концов становятся "кирпичиками" тканей определенного типа.
У человека стволовые клетки обнаружены в эмбриональной ткани, в некоторых тканях плода, пуповине, плаценте, а также в тканях и органах взрослого человека, например в костном мозге. Эти клетки играют важную роль в восстановлении поврежденных тканей. Например, как показали недавние эксперименты на животных, всего лишь 10 стволовых клеток способны полностью восстановить кроветворение в течение нескольких недель после трансплантации клеточной культуры в костный мозг.
Выделяют четыре основных типа стволовых клеток: эмбриональные, фетальные, соматические и мезенхимальные.
Эмбриональные стволовые клетки обнаруживаются на самой ранней стадии развития зародыша. Оплодотворенная яйцеклетка (зигота) начинает делиться через 30 часов с момента оплодотворения, и к третьему-четвертому дню эмбрион представляет собой компактный шар, состоящий из 12 клеток или более. Еще через пять-шесть дней эмбриональные клетки формируют полую клеточную сферу диаметром 150 микрон - бластоцисту. Клетки внутренней клеточной массы - бластоцисты (около 30 клеток) и есть эмбриональные стволовые клетки. Их отличительная особенность - способность к образованию из одной первоначальной клетки целой линии генетически идентичных клеток.
В настоящее время появилась возможность выделять эмбриональные стволовые клетки из бластоцисты и культивировать их в лабораторных условиях. Таким образом, теоретически эмбриональные стволовые клетки могут использоваться как потенциальный источник клеток для выращивания практически любых органов и тканей организма.
Несмотря на то, что эмбриональные стволовые клетки наиболее перспективны для использования в медицинской практике, по этическим соображениям в большинстве стран проведение исследований, связанных с клиническим применением эмбриональных стволовых клеток человека, законодательно запрещено.
В процессе эмбрионального развития одинаковые стволовые клетки начинают видоизменяться и разделяются на определенные зародышевые листки, состоящие из так называемых фетальных стволовых клеток, которые также обладают значительным потенциалом к превращению в другие типы клеток.
Фетальные стволовые клетки в конце концов развиваются в различные органы. Пока хорошо изучены три разновидности фетальных клеток: нейральные стволовые клетки (включая клетки нервного гребня), гематопоэтические стволовые клетки и клетки - предшественники b-клеток поджелудочной железы, вырабатывающих инсулин.
Нейральные стволовые клетки способны трансформироваться в клетки головного мозга. Клетки нервного гребня дифференцируются в клетки, иннервирующие сердце и стенку кишечника, пигментные клетки кожи (меланоциты), хрящ и кости лица, соединительную ткань и другие. Гематопоэтические стволовые клетки превращаются в разнообразные элементы крови. Большое число таких клеток содержат пуповина и плацента.
Соматические стволовые клетки способны превращаться не во все, а только в клетки определенных типов, образующие ткани взрослого организма. Возможность их использования для регенерации тканей была открыта несколько десятилетий тому назад. Источниками соматических стволовых клеток в организме взрослого человека являются костный мозг, периферическая кровь, жировая ткань, головной мозг, скелетная мускулатура, пульпа зуба, печень, кожа, слизистые оболочки желудочно-кишечного тракта, поджелудочная железа. Клетки данного вида поддерживают обновление тканей на протяжении всей жизни человека.
Соматические стволовые клетки, выделенные из костного мозга, могут превращаться в клетки головного мозга. А аналогичные клетки, полученные из ткани головного мозга, способны трансформироваться в клетки крови и мышечной ткани. В некоторых органах соматические стволовые клетки генерируют клетки нескольких типов. К примеру, стволовая клетка нервной ткани может дифференцироваться в нейроны головного мозга, глиальные клетки и астроциты. Подобная способность клеток к трансформации называется пластичностью.
Сегодня во многих странах мира (Австралия, Западная Европа, США, Япония и др.) для лечения больных применяют мезенхимальные стволовые клетки, обнаруженные в тканях взрослого организма и обладающие способностью превращаться в клетки любого органа. Наибольший интерес для медиков представляют мезенхимальные клетки костного мозга, хорошо культивирующиеся в лабораторных условиях.
ЗУБЫ ИЗ СТВОЛОВЫХ КЛЕТОК
Мезенхимальные стволовые клетки способны трансформироваться в клетки костной ткани, что дает возможность использовать их для восстановления целостности костей черепа и лица и регенерации тканей зуба. Наиболее часто необходимость в восстановлении ткани возникает после хирургического удаления раковой опухоли, при различных инфекционных, травматических, врожденных заболеваниях, приводящих к нарушению формирования костей челюстно-лицевой области, а также при системных прогрессирующих заболеваниях костной ткани. До настоящего времени для восстановительной терапии использовались костная ткань пациента и материалы из металла и полимеров, однако у таких терапевтических подходов имеются существенные ограничения.
В процессе эмбрионального развития стволовые клетки трансформируются в клетки - предшественники матрицы зуба: амелобласт и одонтобласт, которые затем формируют соединительную ткань зуба, пульпу, и "обрастают" минерализованной оболочкой из эмали и дентина. Дентин защищает пульпу от нежелательных воздействий. В отличие от костной ткани матрица зуба, однажды сформировавшись, не меняется в течение всей жизни. Однако после химического или механического повреждения зуба дентин частично восстанавливается. Это навело ученых на мысль, что в пульпе зуба, как в костном мозге, могут содержаться стволовые клетки.
Действительно, недавно ученым удалось выделить стволовые клетки из пульпы зуба взрослого человека. Оказалось, что стволовые клетки пульпы зуба делятся еще быстрее стволовых клеток из костного мозга. При механических повреждениях зуба или кариесе стволовые клетки пульпы начинают активно делиться, превращаясь в другие клетки, в том числе и в клетки - предшественники зубной ткани, одонтобласты, которые обновляют популяцию поврежденных клеток зуба.
Ученые открыли вещество, управляющее процессом трансформации стволовых клеток пульпы в клетки зубной ткани. Эта белковая молекула, называемая BMP-2 (bone morphogenic protein-2), присутствует в костном мозге. Она вовлечена во многие процессы деления и дифференцировки клеток организма. После повреждения зуба включается генетический механизм, запускающий синтез BMP-2, после чего в зубной ткани активируются восстановительные процессы.
Эффективность регенеративной терапии зубов с применением стволовых клеток уже доказана в экспериментах на животных. А использование мезенхимальных стволовых клеток костного мозга для восстановления и регенерации костной ткани открывает широкие перспективы в челюстно-лицевой пластической хирургии.
Внедрение стволовых клеток в практику стоматологических клиник не за горами. Поэтому уже сегодня потенциальным пациентам зубоврачебных кабинетов предлагается сохранять популяцию стволовых клеток зуба в специальных банках. Такая услуга уже существует в США. Мама малыша может сдать в лабораторию банка стволовых клеток молочный зуб, из которого специалисты выделят стволовые клетки. Эти клетки будут культивироваться и храниться в банке для будущего лечения ребенка (или взрослого).
Стволовые клетки открывают новые подходы к терапии многих заболеваний. Их можно трансплантировать непосредственно или в комбинации с биоматериалами. Рассматривается возможность применения стволовых клеток как средства доставки генов или генетических продуктов к поврежденным тканям. Бурно развивающиеся научные исследования стимулируют биомедицинское сообщество быстро внедрять открытия в клиническую практику. Перспективы применения стволовых клеток сегодня огромны. Однако манипуляции со стволовыми клетками и их культурами сложны и требуют высокой квалификации специалистов.
Чтобы выйти на мировой уровень в этой важнейшей области медицины, необходимо создавать биотехнологические предприятия, центры клеточной и генной терапии, банки стволовых клеток, обучать молодых специалистов в ведущих мировых лабораториях за рубежом с последующим предоставлением им работы в России. Первые шаги на этом пути уже сделаны: успешно функционируют "КриоЦентр" и Банк стволовых клеток в Москве, строится Центр клеточной и генной терапии в Санкт-Петербурге, который должен стать крупнейшим аккумулятором современных клеточных, генных и нанотехнологий в России.
"Наука и жизнь" о стволовых клетках:
Белоконева О., канд. хим. наук. Праматерь всех клеток. - 2001, № 10.
Лозовская Е., канд. физ.-мат. наук. Стволовые клетки про запас. - 2005, № 2.
В теле человека насчитывается свыше 200 разных типов клеток, образующих ткани и органы, которые выполняют все задачи, связанные с поддержанием жизнеспособности системы, включая задачу воспроизводства. Размер популяций клеток в здоровых тканях взрослого человека – результат тонкого равновесия процессов пролиферации клеток, их дифференцировки и гибели. При повреждении ткани пролиферация клеток позволяет устранить нанесенный ущерб. Для этого покоящиеся (спящие) клетки ткани переходят в состояние пролиферативных, либо стволовые клетки активируются и дифференцируются в клетки такого типа, который необходим для восстановления поврежденной ткани. Исследования стволовых клеток направлены на выяснение механизмов поддержания и восстановления тканей, а также – на выделение значительного числа типов клеток из эмбрионов.
Давно замечено, что ткани могут формироваться за счет самых разных дифференцированных клеток и что элементы крови, кожи и выстилки желудка, дифференцированные клетки отличаются коротким временем полужизни и неспособностью к самостоятельному обновлению. Это наблюдение позволило предположить, что некоторые ткани могут существовать за счет стволовых клеток, т.е. клеток со способностью к саморепликации и генерации дочерних клеток, которые могут дифференцироваться. Такие стволовые клетки взрослых, или региональные стволовые клетки, производят только те клеточные линии, которые соответствуют конкретной ткани (рис. 1).
Рис. 1. Стволовая клетка подвергается саморепликации или дифференцировке.
Стволовые клетки можно не только выделить из взрослых и эмбриональных тканей; их также можно сохранять в культурах в качестве недифференцированных клеток. Эмбриональные стволовые клетки способны производить все дифференцированные клетки взрослого организма. Таким образом, их потенциал можно расширить за пределы обычной мезодермальной клеточной линии до дифференцировки в печеночные, почечные, мышечные, кожные, сердечные и нервные клетки (рис. 2).
Рис. 2. Источником разных тканей являются мезенхимальные стволовые клетки.
Понимание потенциала стволовых клеток ознаменовало новую эру – регенеративной медицины. Появилась возможность регенерации тканей и органов, которые в противном случае были бы утрачены. Поскольку использование эмбриональных стволовых клеток вызывает очевидные этические вопросы, большинство научных исследований посвящено применению региональных стволовых клеток. Стволовые клетки взрослых не отличаются такой универсальностью, как эмбриональные: считаются мультипотентными, т.е. способными дифференцироваться только в клетки/ткани определенных типов, тогда как эмбриональные стволовые клетки – в любые клетки и/или ткани. Научные исследования позволили установить, что некоторые ткани, например нервная, регенерируются с большим трудом, тогда как костная ткань и кровь лучше поддаются лечению стволовыми клетками.
Объектом пристального внимания исследователей стала пульпа временных зубов: ее тщательное изучение в качестве потенциального источника стволовых клеток дало многообещающие результаты. Однако регенерация зуба целиком представляет очень сложный процесс, который, несмотря на некоторые успехи, достигнутые с использованием животных моделей, пока еще невозможно воспроизвести и применять клинически. Совершенно иначе дело обстоит с регенерацией костной ткани челюсти; научно-доказательная база вполне достаточна для клинического применения этого метода. В настоящее время региональные стволовые клетки получают помимо других тканей из костного мозга и жира.
Костный мозг является кроветворной тканью, т.е. он способен производить все клетки крови. В 1950-х годах нобелевский лауреат доктор E.Donnall Thomas продемонстрировал жизнеспособность трансплантированного костного мозга у пациентов с лейкемией. Тогда этот метод позволил спасти множество людей, страдающих иммунологическими заболеваниями и болезнями кроветворной системы. Однако костный мозг содержит не только гематопоэтические стволовые клетки (дифференцируются в эритроциты, лейкоциты, тромбоциты и т.п.), но и мезенхимальные стволовые клетки (становятся, например, костной, мышечной и жировой тканью; рис. 3).
Рис. 3. Разнообразие типов клеток, присутствующих в костном мозге.
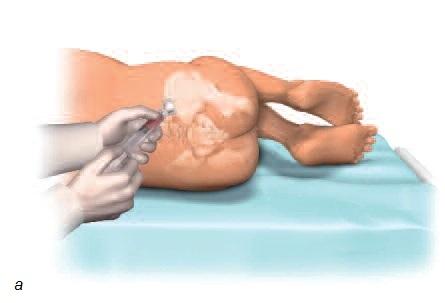
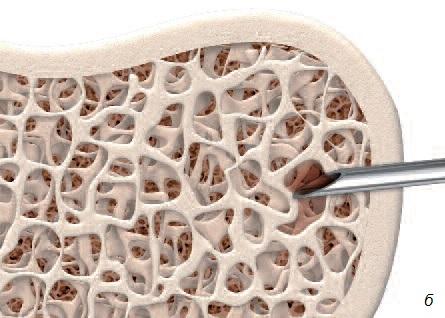
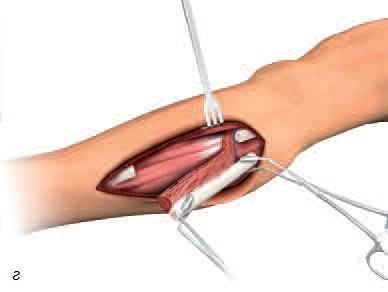
Взятие костного мозга проводят под местной анестезией с помощью иглы из подвздошной (тазовой) кости. Хотя для проведения процедуры необходима соответствующая квалификация, сама процедура не считается чрезмерно инвазивной или сложной. Процедура также не связана с существенным интра- или послеоперационным дискомфортом (рис. 4).
Рис. 4. а – область пункции для взятия костного мозга из подвздошной кости; б – игла внутри костного мозга.
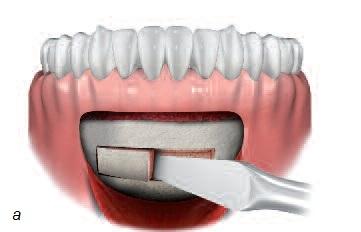
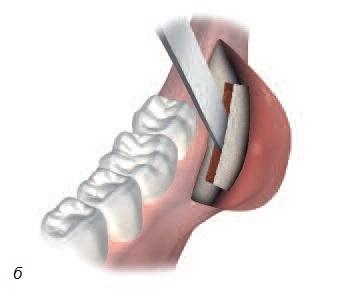
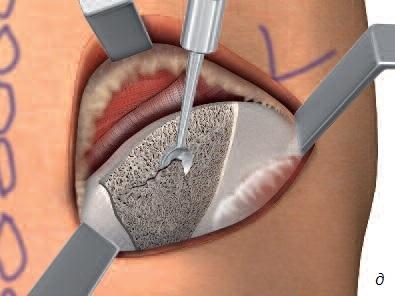
Реконструкция кости в стоматологии (равно как в ортопедии и онкологии) представляет сложную задачу, поскольку устранение костных дефектов, вызванных травмой, инфекциями, опухолями или удалением зубов, требует трансплантации кости. Недостаточный объем кости челюсти может стать препятствием для установки имплантатов, т.е. негативно отразится на качестве жизни пациентов. Для восполнения объема кости трансплантат обычно берут в области подбородка или угла нижней челюсти. Для исправления очень обширных дефектов может понадобиться костная ткань черепа, ноги или таза. В отличие от процедуры взятия костного мозга операции, связанные с получением костных трансплантатов, зачастую сопровождаются сильным дискомфортом, а иногда – неустранимыми послеоперационными остаточными явлениями (рис. 5).
Рис. 5. а – получение костного трансплантата из подбородка; б – получение костного трансплантата из области угла челюсти; в – получение костного трансплантата из свода черепа; г – получение костного трансплантата из ноги (большой или малой берцовой кости); д – костный трансплантат из подвздошной (тазовой) кости.

Проблемы, связанные с костной трансплантацией, подтолкнули к использованию заменителей (синтетические материалы и донорская костная ткань человеческого или животного происхождения). Тем не менее такие материалы демонстрируют худшие результаты по сравнению с аутотрансплантатами (кость самого пациента), поскольку не содержат аутологичных белков. Ввиду этого новая концепция, подразумевающая использование заменителя костного материала в сочетании со стволовыми клетками самого пациента при восполнении критичных костных дефектов, получила признание в качестве современного подхода к лечению. Приходя на смену костной трансплантации (со всеми присущими ей недостатками), этот новый метод позволяет использовать стволовые клетки самого пациента в сочетании с минерализованными материалами и исключает необходимость в хирургическом получении костной ткани.
До недавнего времени не было проведено ни одного исследования, посвященного сравнению разных методов применения стволовых клеток костного мозга для реконструкции кости. Ниже дано резюме исследования, проведенного нашей группой, в рамках которого критичные костные дефекты, искусственно созданные у кроликов, затем устранялись с помощью 4 основных методов лечения стволовыми клетками с целью сравнения их эффективности с точки зрения заживления кости.
Применяли:
- свежий костный мозг (без обработки);
- концентрат стволовых клеток костного мозга;
- культуру стволовых клеток костного мозга;
- культуру жировых стволовых клеток (рис. 6, 7).
Рис. 6. Искусственно вызванный критичный костный дефект свода черепа кролика.
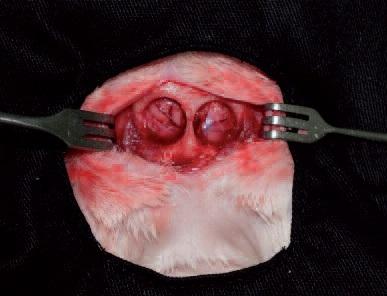
Рис. 7. Первичная культура мезенхимальных стволовых клеток костного мозга через 21 день культивирования.

Пятая группа животных была контрольной, ни один метод лечения стволовыми клетками в ней не применялся. Наилучшие результаты с точки зрения регенерации кости были получены при использовании концентрата и культуры стволовых клеток костного мозга. Контрольная группа продемонстрировала наихудшие результаты. Сделали вывод, что стволовые клетки костного мозга лучше подходят для реконструкции кости, чем стволовые клетки, выделенные из жировой ткани, и что простой концентрат стволовых клеток (его приготовление занимает несколько часов) позволяет получить результаты, сопоставимые с результатами применения сложной культуры стволовых клеток (ее выращивание занимает в среднем от 3 до 4 нед; рис. 8).
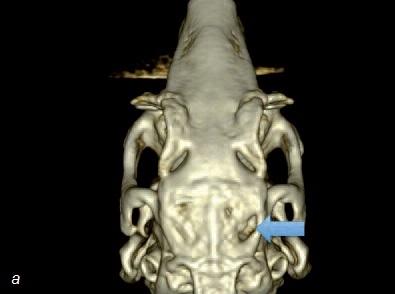
Рис. 8. а – компьютерная томограмма черепа кролика после трансплантации заменителя кости без стволовых клеток (область трансплантации отмечена голубой стрелкой). Обратите внимание на то, что костный дефект сохранился; б – компьютерная томограмма черепа кролика после трансплантации заменителя кости со стволовыми клетками. Обратите внимание на практически полное заживление костного дефекта.
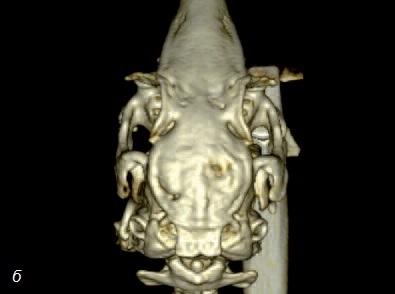
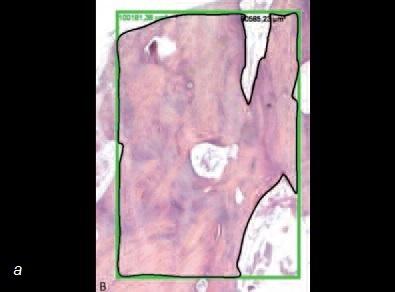
Сходные исследования, проведенные с привлечением пациентов, подтверждают, что стволовые клетки костного мозга улучшают заживление костных дефектов, вызванных травмой, удалением зубов или новообразований. Гистологические изображения демонстрируют возможности заменителей кости в сочетании со стволовыми клетками при реконструкции кости (рис. 9). Очевидно, что уровень минерализованной кости существенно выше там, где были применены стволовые клетки (рис. 10).
Рис. 9. Костный аллотрансплантат с концентратом костного мозга.

Рис. 10. а – гистологический срез участка после пересадки аллотрансплантата в сочетании с костным мозгом. Обратите внимание на наличие существенного объема минерализованной ткани; б – гистологический срез участка после пересадки аллотрансплантата без костного мозга. Обратите внимание на наличие значительно меньшего объема минерализованной ткани.
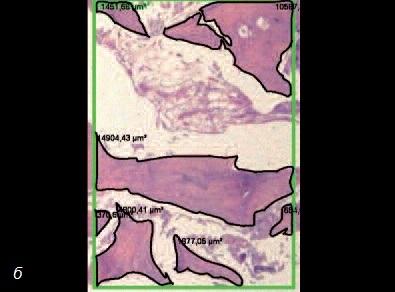
Хотя этот метод очень близок клиническому применению, назначать подобную процедуру следует с большой осторожностью. Для ее проведения нужна соответствующая квалификация хирурга и сотрудников лаборатории, а также доступность необходимых ресурсов (на рис. 11 фотографии, сделанные во время манипуляций со стволовыми клетками костного мозга в лаборатории Стоматологической школы им. св. Леопольда Мандича в Бразилии).
Рис. 11. а – костный мозг; б – костный мозг перемещают в пробирку в стерильных условиях (в ламинарном потоке); в – гомогенизация костного мозга в буферном растворе (в ламинарном потоке); г – костный мозг соединяют с фиколлом (для фракционирования клеток); д – с помощью пипетки отбирают промежуточный слой, содержащий мононуклеары (стволовые клетки); е – второй цикл центрифугирования.


Автор: Андрэ Антонио Пелегрине, Бразилия
Читайте также:

