В минерализации зубной ткани и снижение резорбции костной ткани принимает участие гормон
Опубликовано: 09.05.2024
Физиология паратгормона настолько сильно связана с витамином D и метаболизмом костной ткани, что рассматривать эти вопросы по отдельности, не потеряв их сути, невозможно. Графически взаимоотношения представлена на рисунке ниже. Паратгормон в первую очередь регулирует содержание ионов кальция в межклеточном пространстве. Витамин D контролирует всасывание кальция из пищи, а также косвенно отвечает за минерализацию костной ткани, которая содержит в себе 99% всего кальция организма.
«Можно ли считать кость органом?» Да! Поскольку костная ткань проявляется очень высокую метаболическую активность, а также содержит большие запасы кальция, она напрямую включена в процессы регуляции содержания кальция в межклеточном пространстве и плазме крови. Нормальная концентрация кальция в межклеточном пространстве необходима для выполнения множества клеточных функций, среди которых передача сигнала между клетками, секреция гормонов, нормальная работа мышц и нервов, поэтому необходимо строгое ее сохранение в определенных пределах.
Гипокальциемия ведет к нервно-мышечной гипервозбудимости; умеренное снижение уровня кальция проявляется гиперестезиями с положительными симптомами Хвостека и Труссо; тяжелая гипокальциемия ведет к развитию тетании, судорог и смерти. Гиперкальциемия проявляется летаргией, слабостью, комой и, наконец, смертью. Около 50% внеклеточного кальция находится в ионизированной форме, но точное соотношение зависит от pH. Содержание кальция внутри клеток на порядки меньше, чем вне ее, но некоторые органеллы, например, митохондрии, содержат в себе повышенные концентрации кальция. Колебания уровня внеклеточного ионизированного кальция обычно не превышают ± 10%.
а) Физиология обмена паратгормона. Паратгормон (паратиреоидный гормон, ПТГ, РТН) по химическому строению является 84-аминокислотным полипептидом; было выяснено, что за биологическую активность гормона ответственны первые 34 аминокислотных остатка паратгормона, именно они используются в клинической практике, например, в лечении остеопороза. Определение последовательности классического рецептора ПТГ показало его связь с G-белком и наличие семи трансмембранных сегментов, проявляющих одинаковое сродство как с паратгормоном, так и с ПТГ-родственным пептидом (ПТГ-рП).
Но ПТГ-рП не обладает таким же активирующим действием на 1-гидроксилазы почек, как сам ПТГ.
Наибольшее количество рецепторов к ПТГ находится в костной ткани и в почках, хотя в других органах они также присутствуют в меньших количествах. Недавно был обнаружен новый подвид ПТГ-рецептора, который связывается с карбоксильным остатком паратгормона. Ранее считалось, что данные рецепторы находятся в неактивном состоянии. Этот недавно обнаруженный рецептор не связывается с ПТГ-рП. Неизвестно, играет ли он какую-либо роль в метаболизме костной ткани или имеет какие-либо другие функции.
Клетки паращитовидных желез также экспрессируют рецепторы, чувствительные к кальцию. И они являются рецепторами, связанными с G-белками, и имеют в своем составе семь трансмембранных доменов. Данные рецепторы могут соединяться с различными катионами, но физиологически подходящими для них являются только двухвалентные катионы кальция и магния. Снижение уровня ионизированного кальция ведет к повышению секреции ПТГ, повышение уровня ионизированного кальция ведет к снижению секреции ПТГ.
Таким образом, и концентрация ионизированного кальция, и концентрация ПТГ в плазме крови колеблются лишь в узких пределах. Были описаны различные мутации данных рецепторов, некоторые из них приводят к повышению их активности, другие — к понижению. Данные мутации являются ключом к пониманию семейной гипокальциурической гиперкальциемии и некоторых гипокальциемических синдромов, например, семейного гипопаратиреоидизма.
Паратгормон (ПТГ) повышает резорбцию кальция в почках, усиливает резорбцию костной ткани, повышает активность D1-гидроксилазы почек. Эти механизмы помогают восстановить уровень кальция в плазме крови.
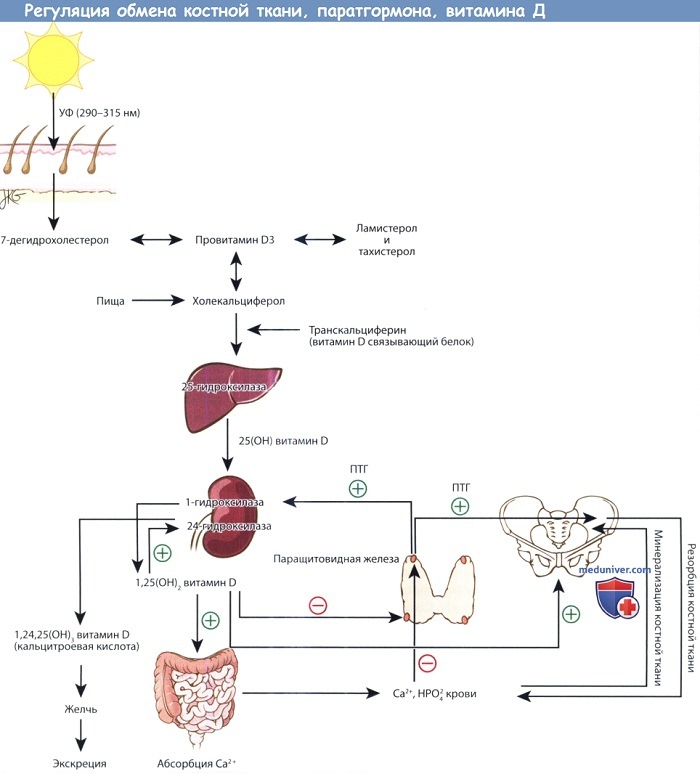
Пути метаболизма витамина D, паратгормона и костной ткани.
Предшественники витамина D синтезируются в коже под действием ультрафиолета. Превращение 25-ОН витамина D, депонированной формы витамина, в активную форму,
т.е. 1,25-(ОН)2 витамин D, регулируется паратгормоном. 1,25-(ОН)2 витамин D повышает всасывание кальция в желудочно-кишечном тракте.
Кальций и фосфор плазмы крови регулируют содержание паратгормона крови, а также участвуют в минерализации новообразованного костного матрикса.
При повышении уровня паратгормона усиливается резорбция костной ткани, поскольку это необходимо для поддержания необходимого уровня кальция в плазме,
а также стимулируется синтез 1,25-(ОН)2 витамина D почками.
б) Физиология обмена витамина Д. Синтез провитамина D (холекальциферола) происходит в коже из 7-дегидрохолестерола в результате фотокатализа под действием ультрафиолетовых лучей с длиной волны 290-315 нм. Ультрафиолетовые лучи именно с такой длиной волны могут преодолеть атмосферу, поэтому у жителей возвышенностей синтез провитамина D подвержен сезонным колебаниям. Синтез предшественников провитамина D тоже зависит от воздействия солнечных лучей, поэтому избыточное пребывание на солнце не приводит к гипервитаминозу.
Следовательно, скорость продукции провитамина D в долгосрочной перспективе не зависит от пигментации кожи; но она может снижаться у темнокожих лиц, которые мало подвергаются воздействию солнечных лучей. Провитамин D связывается с транскальциферином (витамин - D - связывающим белком) и транспортируется в печень, где в результате 25-гидроксилирования он превращается в кальцидиол.
Возможности получения витамина D с пищей очень ограничены, лишь крайне малое число продуктов содержит в себе витамин D. Молоко и молочные продукты, производимые в США и Европе, дополнительно обогащаются витамином D. Одна их порция содержит около 100 ME витамина. К сожалению, необогащенные молочные продукты и человеческое грудное молоко содержат крайне малое количество витамина. В желтке яйца содержится около 20 ME витамина D, в белке витамина D нет. Рыба является источником, богатым витамином D.
В порции консервированного тунца содержится 250 ME витамина, а в одной порции свежевыловленного лосося может содержаться до 1000 ME. В растительных продуктах витамина D нет, но он может содержаться в грибах в количестве до 1500 МЕ/100 г, если грибы росли в присутствии солнечного света.
Витамин D представляет из себя провитамин, активной формой которого является 1-25-(ОН)2 витамин D (кальцитриол). В норме кальцитриол продуцируется почками из витамина D, кальцидиола, в результате реакции 1-гидроксилирования. Активность 1-гидроксилазы почек контролируется ПТГ, поэтому уровень 1-25-(ОН)2 витамина D напрямую коррелирует с уровнем ПТГ. Высокий уровень ПТГ, как правило при гипокальциемии, стимулирует образование 1-25-(ОН)2 витамина D. В результате происходит повышение абсорбции кальция в кишечнике и нормализация его уровня в плазме крови.
При определенных патологических состояниях некоторые другие ткани также могут проявлять 1-гидроксилазную активность, иногда независимо от действия ПТГ.

в) Метаболизм минеральных веществ в костной ткани. Мы часто воспринимаем кости лишь как опорные структуры, но на самом деле костная ткань играет важную роль в метаболизме, выступая в качестве депо кальция, фосфатов и карбонатов, также она участвует в поддержании кислотно-щелочного равновесия. Матриксом кости является частично минерализованная ткань и специфические костные клетки. Костную систему человека разделяют на осевой скелет, к которому относят череп, позвоночный столб, грудину, ребра и таз, и на скелет конечностей, от их проксимальных отделов до кончиков пальцев.
Также костная ткань подразделяется на губчатую (трабекулярную), которая обладает высокой метаболической активностью, и кортикальную, которая имеет большую плотность и меньшую метаболическую активность. Изменения в кортикальной костной ткани наступают при тяжелых или длительно текущих заболеваниях. В осевом скелете преобладает содержание трабекулярной кости, в скелете конечностей — кортикальной.
К костным клеткам относят остеобласты, остеокласты и остеоциты. Остеобласты происходит из мезенхимальных стволовых клеток, они образуют соединительнотканный матрикс кости, который затем минерализуется, формируя новую костную ткань. Большинство остеобластов подвергаются апоптозу, но часть из них остается включенной в костный матрикс и превращается в остеоциты, а другая часть остается на поверхности кости, формируя надкостницу.
Трансформируясь в остеоциты, эти клетки образуют длинные отростки, которыми они создают щелевой контакт с соседними клетками и с клетками надкостницы. Остеоциты воспринимают механическое давление, оказываемое на кость, и играют важную роль в моделировании костной ткани. Остеокласты представляют собой крупные многоядерные клетки, происходящие из одноядерных макрофагов. Процесс дифференцировки клеток в остеокласты происходит под контролем ядер-ного фактора кВ (каппа-Б, RANKL), продуцирующего в ходе апоптоза остеобластов, и под контролем колониестимулирующего фактора макрофагов.
Остеокласты участвуют в резорбции костной ткани, разрушая минеральный компонент и коллагеновый матрикс костной ткани посредством протеолиза.
В норме костная ткань постоянно разрушается остеокластами и одновременно заново синтезируется остеобластами. Этот процесс получил название ремоделирования костной ткани. В здоровом организме процессы разрушения и синтеза костной ткани находятся в равновесии. Ремоделирование костной ткани крайне важно для поддержания структурной целостности (прочности) скелета, т. к. с ее помощью постоянно восстанавливаются микропереломы костей, возникающие от каждодневных физических нагрузок.
г) Кальций-чувствительные рецепторы. Как уже упоминалось выше, паращитовидные клетки экспрессируют кальций-чувствительные рецепторы. Первоначально данные рецепторы были выделены из паращитовидных клеток крупного рогатого скота, затем их наличие было подтверждено и у человека. Кроме паращитовидных желез, где они и были впервые обнаружены, данные рецепторы экспрессируются в почках, костях, желудке, легких, головном мозге и других тканях.
Как мутации, так и приобретенные дисфункции данных рецепторов могут стать причиной появления различных заболеваний, связанных как с повышением, так и с понижением кальция крови. Более подробно эти заболевания будут рассмотрены ниже.
Учебное видео расшифровки биохимического анализа крови
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Случается, что, потеряв зуб, человек задумывается о протезировании только спустя несколько лет. Выбирает надежную современную технологию — дентальную имплантацию. И обнаруживает, что за прошедшее время костная ткань «расслабилась» — ее объем и плотность стали недостаточны для полноценной установки имплантата. О том, почему возникает разрежение костной ткани челюсти и возможна ли имплантация без наращивания костной ткани — читайте в нашем обзоре.
Что такое атрофия костной ткани челюсти
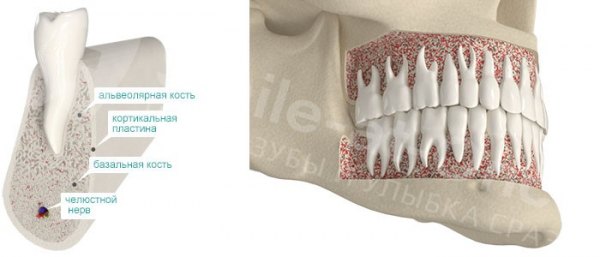
Костная ткань — сложная, живая, постоянно изменяющаяся структура. Как и в любой живой ткани, в ней есть вода — около 10% [1] . В среднем 25% состава кости — органическая, «живая» составляющая. Это белки, в основном коллаген, и клетки, регулирующие состав и структуру ткани. Оставшаяся доля — неорганические вещества (в основном гидроксиапатиты). Это именно те вещества, которые придают костной ткани прочность и жесткость. Процентное соотношение может меняться в зависимости от того, идет ли речь о губчатой или компактной костной ткани:
- Губчатая кость — пористая и легкая, в ней между костными структурами (трабекулами) много свободного пространства, где проходят кровеносные сосуды. В структуре преобладают органические компоненты.
- Компактная (кортикальная) кость — плотно скомпонованная и очень прочная. В ней преобладают неорганические субстанции.
Живая ткань кости формируется костными клетками: остеоцитами и остеокластами.
Остеоциты — это клетки костной ткани, которые ее формируют и регулируют процесс кальцификации. Они синтезируют белковые структуры кости, регулируют минерализацию — концентрацию солей кальция и фосфора, таким образом поддерживая баланс между органической и неорганической составляющей.
Остеокласты уничтожают «отслужившие свое» или поврежденные костные структуры.
В нормальном состоянии живого организма непрерывно поддерживается баланс между разрушением и созиданием — для того чтобы создать что-то новое нужно «расчистить площадку». Но когда по каким-то причинам процесс резорбции (рассасывания) костной ткани начинает преобладать, наступает атрофия костной ткани.
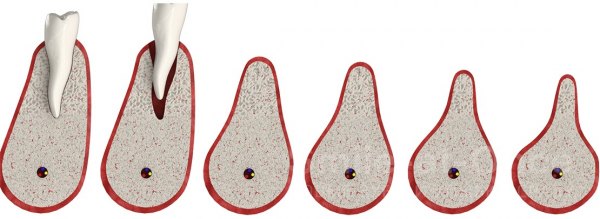
Чаще всего убыль костной ткани развивается после удаления зуба. Любой орган для того, чтобы сохранить нормальное состояние, должен работать, а нерабочие структуры атрофируются — у организма нет возможности тратить питательные вещества и энергию на подержание в работоспособном состоянии нефункционирующего органа. Костная ткань челюсти поддерживается в «рабочем» состоянии нагрузкой, которая передается при жевании через корни зубов. Как только зуб удаляется, нагрузка исчезает. Постепенно перестают функционировать сосуды, которые питали удаленный зуб, а значит, перестает поступать питание и в ткань челюсти. Ткань челюсти в области удаленного зуба начинает рассасываться — атрофироваться. Как показало исследование немецких ученых, после потери зубов такие изменения возникают в 95% случаев [2] . В течение 1 года после потери зуба объем костной ткани уменьшается на 25% [3] . Именно поэтому врачи-стоматологи рекомендуют как можно быстрее после потери зуба поставить на его место имплантат.
В клинической практике выделяют 4 степени атрофии [4] :
- незначительная;
- умеренная;
- выраженная;
- грубая.
При незначительном снижении плотности костной ткани возможна имплантация зубов с помощью дентальных имплантатов оптимального размера. При грубой атрофии имплантация возможна только после реконструкции челюсти.
Причины потери плотности и убыли костной ткани челюсти
Потеря зуба — не единственная причина изменения костной структуры. Такими причинами могут стать:
- воспаление десен и периодонта — структур, окружающих зубы и обеспечивающих их стабильность;
- кисты и воспаления в области корней зубов или верхнечелюстных пазух;
- травмы челюсти;
- остеопороз;
- врожденные анатомические особенности.
Тем не менее основные причины развития атрофии костной ткани челюсти — несвоевременное протезирование после удаления зуба.
Последствия «расслабления» костной ткани
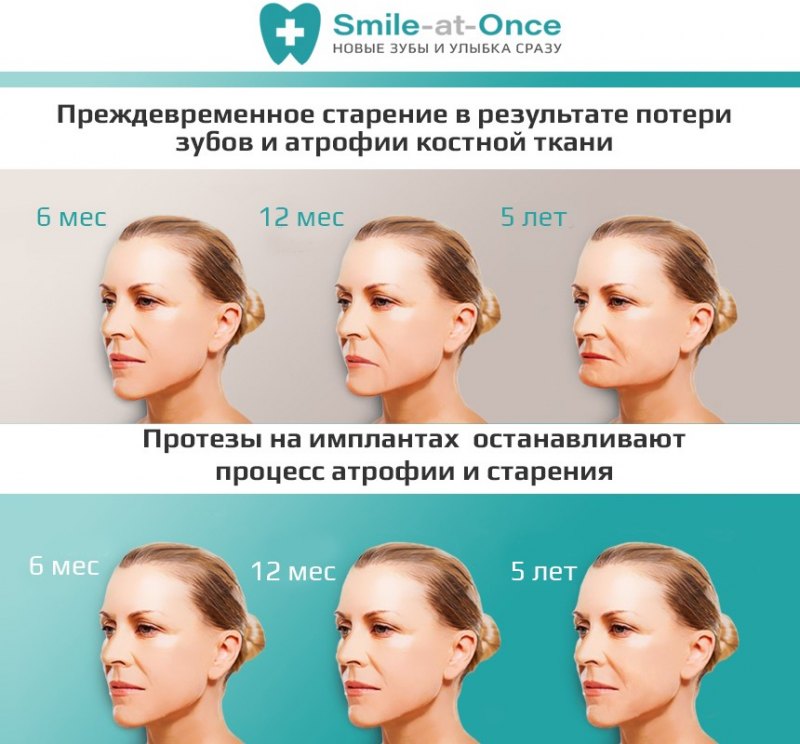
Атрофия альвеолярных отростков — проблема не только «местного» масштаба. Постепенно усиливаясь, процесс вызывает необратимые изменения:
- Меняется выражение лица. В зависимости от того, где расположен дефект, «укорачивается» верхняя или нижняя челюсть, западают губы, вокруг них формируются морщины. Лицо приобретает характерный «старческий» вид.
- Зубы начинают смещаться в сторону «пустого» пространства. Увеличивается вероятность потери и соседних зубов. Из-за того, что расположение зубов меняется, между ними задерживаются остатки пищи: ускоряется развитие кариеса. Да и само жевание становится менее эффективным, как результат — проблемы с ЖКТ.
И основная проблема, с которой сталкиваются пациенты стоматологических клиник, — невозможность имплантации зубов. По данным отечественных врачей, у 35% пациентов она невозможна без проведения реконструкции костной ткани челюсти [5] .
Как предотвратить процесс атрофии?
Поскольку атрофия костной ткани чаще всего развивается из-за удаления зуба (или нескольких зубов), очевидно, что для ее предотвращения следует как можно скорее восстановить зубы. Традиционно используются несколько методик:
- установка мостовидной конструкции;
- установка съемного протеза;
- имплантация.
Первые два метода относительно недороги. Но, к сожалению, они не восстанавливают нагрузку на кость в месте удаленных зубов. Нагрузка ложится на здоровые зубы, фиксирующие протез, в случае съемного моста — на десны. В результате атрофия продолжает развиваться. Часто она сводит на нет результаты протезирования — десна «проседает» вслед за костной тканью, под протезом появляется щель. Это не только неэстетично, но и опасно — в образовавшемся пространстве скапливаются остатки пищи, на которых активно размножаются микроорганизмы, провоцирующие воспаление.
Имплантация зубов, в отличие от других методик протезирования, позволяет сформировать нагрузку непосредственно на костную ткань в районе удаленного зуба. Таким образом, костная ткань продолжает работать в нормальном режиме, а значит, в ней сохраняются все необходимые обменные процессы. Это предупреждает истончение костной ткани челюсти.
Варианты восстановления зубного ряда при значительной атрофии
Но что же делать, если время упущено и степень атрофии костной ткани не позволяет имплантировать зубы? На сегодня есть две основные методики, позволяющие справиться с этой проблемой.
Восстановление костной ткани челюсти с последующей имплантацией с отложенной нагрузкой.
Это классическая методика, проверенная временем. Сначала проводится операция по увеличению объема костной ткани. Существуют разные методики: синус-лифтинг, расщепление альвеолярного отростка, подсадка костного трансплантата или искусственной ткани. Какая из них будет оптимальна в данном конкретном случае, может решить только лечащий врач. После операции потребуется от нескольких месяцев до полугода на восстановление костных структур, после чего в челюсть вживляются имплантаты, пока без коронок — и снова требуется около полугода для их приживления. Только после этого на титановое основание имплантатов устанавливаются коронки и челюсть, наконец, получает нагрузку.
Имплантация с немедленной нагрузкой
Это относительно новая методика стала возможной благодаря специальным имплантатам, которые фиксируются не в альвеолярной части челюсти, а глубже, в базальной ее части, которая состоит в основном из компактного вещества. Имплантаты подбирают исходя из индивидуальных особенностей челюсти пациента. Они требуют минимального времени для заживления — протез устанавливают уже на 3–5-й день после фиксации самого имплантата. Благодаря тому, что кость сразу же получает нагрузку, в ней сохраняется кровообращение, нормальный обмен веществ, что ускоряет регенерацию.
Для того чтобы орган сохранял свою структуру и функции, он должен работать. Это касается и костной ткани челюсти. Потеря зубов приводит к атрофии кости челюсти. Чтобы предупредить этот процесс, необходимо как можно быстрее после удаления зуба заменить его протезом. Имплантация зубов — самый приближенный к естественному способ их восстановления, позволяющий сохранить объем и плотность костной ткани.
Как выбрать стоматологическую клинику?
О том, на что обращать внимание, планируя имплантацию зубов, рассказывает Олег Владимирович Филимонов, врач-имплантолог центра дентальной имплантации SMILE-AT-ONCE:
«Как минимум поинтересуйтесь оборудованием, на котором работает клиника, материалы каких производителей она использует. Например, стоматология SMILE-AT-ONCE — официальный партнер известных производителей имплантатов: Nobel Biocare, Oneway Biomed, Straumann. На нашем сайте есть подробная информация об инструментах, оборудовании, программном обеспечении и технологиях, которые мы используем. Там же вы можете ознакомиться с нашими лицензиями, сертификатами и наградами.
Для успеха лечения важно, как долго клиника существует, каков опыт работы врачей, проходят ли они курсы повышения квалификации. Специалисты нашей клиники имеют более чем десятилетний стаж работы и регулярно участвуют в научно-практических конференциях, обучающих программах, других образовательных мероприятиях. Так, все имплантологи SMILE-AT-ONCE имеют действующие сертификаты Международного фонда имплантации (International Implant Foundation), что подтверждает их право работать в этой области. Клиника входит в международное сообщество имплантологов (International Team for Implantology. ITI), которое существует уже 30 лет. Мы осуществляем весь комплекс услуг по протезированию зубов с использованием имплантатов за семь дней и даем пожизненную гарантию на имплантаты, а также предлагаем удобную схему лечения как пациентам из Москвы, так и иногородним».
Лицензия № ЛО-77-01-013995 от 14 марта 2017г. выдана Департаментом здравоохранения города Москвы

Предотвратить атрофию костной ткани можно, прибегнув к протезированию зубов с использованием имплантатов.
Протезирование зубов с использованием имплантатов часто рекомендуется, если значительно сократился объем костной ткани и если нельзя осуществить костную пластику.

Протезирование зубов с использованием имплантатов позволяет:
- остановить атрофию костной ткани;
- восстановить костную ткань;
- частично разгладить морщины вокруг рта за счет исправления формы челюсти.
Протезирование зубов с использованием имплантатов возможно даже на последних стадиях развития пародонтита, а также при полной адентии и при значительном сокращении костной ткани.
Ношение съемных протезов может вызывать дискомфорт и приводить к атрофии костной ткани и к проседанию десны.
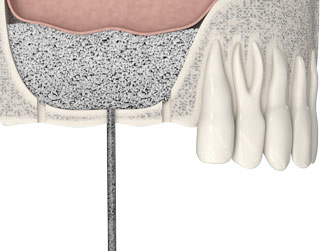
Протезирование зубов с использованием имплантатов не занимает много времени: обрести новую улыбку можно менее чем за одну неделю.
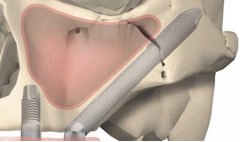
Протезирование зубов с использованием имплантатов может быть актуально для восстановления не только части жевательных зубов, но и всего зубного ряда верхней челюсти.
- 1 Биохимия соединительной ткани
- 2 Lars Schropp, A. Wenzel, L. Kostopoulos, et al. Bone Healing and Soft Tissue Contour Changes Following Single-Tooth Extraction:
A Clinical and Radiographic 12-Month Prospective Study. - 3 Соков, Л.П. Руководство по нейроортопедии. Л.П. Соков, Е.Л. Соков, С.Л. Соков. — М.: РУДН, 2002. — С. 74-75
- 4 Никольский В. Ю., Вельдяксова Л. В., Максютов А. Е. Оценка степени атрофии костной ткани челюстей после удаления зубов
в связи с дентальной имплантацией. Саратовский научно-медицинский журнал 2011. - 5 Клинические результаты использования различных костно- пластических материалов при синус-лифтинге /
С.Ю. Иванов, Э.А. Базикян, М.В. Ломакин [и др.] // Новое в стоматологии. — 1999. — № 5. — C. 75

Каадзе Анастасия Геннадьевна Ответственный редактор
Если вы решились на установку имплантатов или другой вид дентального протезирования, предварительно посетите пародонтолога. При выявлении патологий потребуется их устранение. Кроме того, необходима гигиеническая чистка зубодесневых карманов и зубов для устранения налета и зубного камня.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Костная ткань образует динамическое «депо» кальция, фосфора, магния и других соединений, необходимых для поддержания гомеостаза в минеральном обмене. Кость состоит из трёх компонентов: клеток, органического матрикса и минеральных веществ. На долю клеток приходится всего 3% объёма костной ткани.
Костную ткань формируют остеобластами. Основная функция остеобластов - синтез остеоида (протеинового матрикса), который состоит на 90-95% из коллагена, небольших количеств мукополисахаридов и неколлагеновых белков (остеокальцин, остеопонтин), и впоследствии минерализуется кальцием и фосфатом из внеклеточной жидкости. Остеобласты располагаются на костной поверхности и тесно контактируют с остеоидом. Они содержат щелочную фосфатазу, несут рецепторы паратиреоидного гормона и кальцитриола и способны к пролиферации. Остеобласты, окружённые минерализованным органическим матриксом, превращаются в остеоциты (зрелые, непролиферирующие клетки, которые располагаются в полостях между слоями новообразованной кости).
Резорбцию костной ткани осуществляют остеокласты. Выделяя протеолитические ферменты и кислую фосфатазу, остеокласты вызывают деградацию коллагена, разрушение гидроксиапатита и выведение минералов из матрикса. Вновь формирующаяся слабо минерализованная костная ткань (остеоид) резистентна к остеокластической резорбции.
Коллаген I типа - основной белок, составляющий 90% органического матрикса кости. Он синтезируется остеобластами в виде предшественника - проколлагена I типа, который представляет собой большую молекулу, содержащую карбокси- и аминотерминальные пропептиды (N- и С-концевые пропептиды коллагена I типа). Эти пропептиды отделяются от основной молекулы с помощью специфических пептидаз после выделения проколлагена из клетки.
На долю неколлагеновых белков приходится приблизительно 10% органического матрикса кости. Они придают костному матриксу уникальную структуру. От правильного соотношения матриксных белков, синтез которых осуществляется клетками остеобластной линии, во многом зависит отложение гидроксиапатита.
Минеральная часть кости состоит из гидроксиапатита [Са10(РО4)6(ОН)2] и аморфного фосфата кальция, которые нековалентно связаны с белками органического матрикса. Ориентация кристаллов гидроксиапатита определяется в первую очередь ориентацией коллагеновых волокон матрикса.
В основе жизнедеятельности костной системы лежат два взаимосвязанных и взаимозамещающих процесса: процесс образования (формации) новой кости и процесс разрушения - резорбции старой кости. В норме образование и резорбция костной ткани (ремоделирование кости) уравновешены.
Остеокласты непрерывно резорбируют старую костную ткань, а остеобласты образуют новую путём синтеза остеоида (протеинового матрикса), который впоследствии минерализуется кальцием и фосфатом из внеклеточной жидкости. Эти комплексы клеток, участвующих в локальном процессе резорбции и формирования кости, называются основными многоклеточными единицами ремоделирования.
Нарушения в местах ремоделирования кости возникают вследствие изменения баланса между процессом формирования и процессом резорбции в сторону преобладания последнего, что приводит к потерям костной массы. Интенсивность и выраженность костных потерь зависят от скорости «костного оборота». Преобладание процессов формирования костной ткани и её усиленная минерализация приводят к увеличению массы и плотности костей - остеосклерозу.
Для обозначения клинических, лабораторных и рентгенологических проявлений потери костной ткани используют собирательное понятие - остеопению . Причины остеопении - остеопороз, остеомаляция, первичный гиперпаратиреоз, миеломная болезнь, мастоцитоз, почечная остеодистрофия.
Увеличение массы костной ткани и её плотности называют остеосклерозом. При остеосклерозе возникают очаги усиленного образования органического матрикса, который впоследствии минерализуется, в результате масса костной ткани и её плотность увеличиваются. Остеосклероз возникает обычно на поздних стадиях хронической почечной недостаточности.
К маркёрам метаболизма костной ткани (маркёрам формирования костной ткани) относятся костный изофермент щелочной фосфатазы, остеокальцин, С-концевой пропептид коллагена I типа.
Основные биохимические показатели, используемые в клинической практике в качестве критериев резорбции костной ткани, включают экскрецию кальция с мочой, N-концевой пропептид коллагена I типа, пиридиновые связи коллагена.

[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11]

Костная ткань человека является уникальной структурой, которая функционирует в гармоничном взаимодействии с другими органами и системами. В условиях патологического процесса, патогенетические пути которого пересекаются на любом уровне костной системы, последняя отвечает соответствующими защитными реакциями.
Костный скелет человека составляет 15-20% массы тела, а в его составе насчитывается более 200 костей. Главные функции костной ткани — метаболическая и опорно-двигательная.
Кости защищают жизненно важные органы от механических повреждений, участвуют в перемещении тела, а костные трабекулы образуют каркас для образования костного мозга.
При всем вышесказанном существенной разницы в строении костных органов нет.
Практически до середины ХХ столетия ученые рассматривали кость только как примитивный орган для накопления минеральных веществ и регуляции этого процесса.
Накопленный в последние десятилетия клинический и экспериментальный опыт свидетельствует о высокой функциональной активности костной ткани как постоянно регенерирующей биологической системы.
Способность клеточных элементов костной ткани к самовосстановлению обеспечивает регенерацию при травмах, а также замену старых несовершенных структур.
Структура и функции костной ткани
По степени дифференциации костную ткань подразделяют на пластинчатую (зрелую) и грубоволокнистую (незрелую), которые отличаются структурной организацией и физическими свойствами межклеточной жидкости.
Грубоволокнистая костная ткань характеризуется высокой скоростью образования и метаболических процессов. Незначительное ее количество находится в местах прикрепления связок или образуется при патологических состояниях, в том числе при переломах, нарушении метаболизма, воспалительных и неопластических процессах.
Незрелая костная ткань на протяжении жизни человека может формироваться в ответ на повреждение, в результате инвазивных медицинских процедур, стимуляции остеогенеза.
Особенностью грубоволокнистой костной ткани является хаотичное расположение фибрилл, высокая плотность клеток с пониженным содержанием минеральных солей, локализованные в лакунах без четкой пространственной ориентации уплощенные остеоциты.
Насыщение органического матрикса незрелой кости минеральными солями, катионами и анионами приводит к повышению механической прочности ее межклеточной жидкости и возникновению относительно упорядоченной структуры.
Такой вид костной ткани называют пластинчатой, или зрелой.
Зрелая костная ткань составляет основу губчатого и компактного вещества. Структурной единицей ее является пластинка, которая в кортикальном слое формирует концентрические цилиндры остеонов, а в губчатом слое — трабекулы.
Остеон состоит из системы связанных между собой костных пластинок, которые располагаются вокруг центрального канала. Остеоны бывают трех групп:
Структурно зрелые остеоны
Остеоны, пребывающие в стадии роста
Остеоны резорбционного типа.
Костная ткань состоит из органического матрикса (60%), минерального компонента (30%) и клеток. Органический матрикс составляет 90% объема костной ткани, а остальное занимают клетки, кровеносные и лимфатические сосуды.
В органическом матриксе структурной основой являются коллагеновые белки, на которые приходится 88% массы. Коллаген 1 типа занимает среди них 95% объема и образует волокна большого диаметра, обладающие значительной механической прочностью.
Минерализация осуществляется вдоль волокон коллагена 1 типа. Эта разновидность коллагена входит в состав оссеиновых волокон, определяющий прочность кости.
Кроме коллагена 1 типа, в структуре присутствуют коллагены 3, 4, 5, 11, 12 типов, составляющие 5% общего количества коллагенов, а также большое количество органических кислот (например, лимонная), которые способны формировать комплексы с ионами кальция.
До недавнего времени принято было считать, что коллагеновые структуры выполняют исключительно опорную функцию, однако новые исследования Grimston и соавторов свидетельствуют об активном влиянии коллагеновых структур органического матрикса на метаболические процессы в костной ткани. Эти структуры также выступают регуляторными медиаторами пространственной ориентации клеток костной ткани, влияют на их дифференциацию и моделирование.
В межклеточном пространстве 5% приходится на долю неколлагеновых белков (остеокальцин, остеонектин, костные сиалопротеины, костные фосфопротеины, костные морфогенетические белки и протеогликаны). Они регулируют процессы синтеза и накопления коллагена.
Основу неколлагеновых белков составляет остеокальцин. Среди других неколлагеновых белков органического матрикса выделяют остеопонтин, цитокины и другие. Протеогликаны составляют 10% неколлагеновых белков и обеспечивают консолидацию коллагеновых фибрилл, связь коллагена с кристаллической фазой матрикса.
К длинным протеогликанам относят хондроитинсульфатный протеогликан, а к малым протеогликанам — декорин и бигликан. Они влияют на формирование фибрилл коллагена 1 типа, стимулируют скорость образования и прирост фибрилл в длину и ширину.
Зрелые остеоциты продуцируют только бигликан.
Протеогликаны располагаются на клеточной поверхности, выполняя роль медиаторов основных ростовых факторов костной ткани — фактора роста фибробластов, TGNb.
Механические свойства костной ткани зависят от функциональных характеристик взаимосвязанной системы «коллаген — протеогликаны — кристаллы».
К гликопротеинам кости относятся:
Щелочная фосфатаза принимает участие в процессах минерализации костной ткани. Остеонектин связывается с гидроксиапатитом и кальцием, участвует в пролиферации костных клеток, а также способствует взаимодействию клеток с матриксом.
Тромбоспондин связывает гепарансульфат-протеогликаны, фибронектин, ламинин, коллагены 1 и 5 типов, остеонектин. Локализуется в минерализованном матриксе.
В остеоиде тромбоспондин обеспечивает процессы клеточной адгезии.
Минеральный компонент занимает около 30% массы костной ткани, но содержит 98% неорганических веществ человеческого организма, в том числе около 99% кальция, 87% фосфора, 58% магния, 46% натрия и 20% жизненно важных микроэлементов.
Стереохимическое изучение основных кристаллических компонентов минерального матрикса дает возможность классифицировать их не только как кристаллы гидроксиапатита и аморфного фосфата кальция, и как кристаллический апатит, который не содержит в своем составе свободных ОН-групп, наоборот, включает фосфатные и карбонатные ионы.
Эти кристаллические структуры своей продольной осью располагаются параллельно коллагеновым фибриллам и характеризуются достаточно стабильным соотношением основных неорганических костных ионов кальция и фосфора.
При этом в аморфной фазе может содержаться до половины всех минеральных компонентов кристалла. На роль универсальных регуляторов стабильности апатитной структуры сегодня претендуют ионы магния, стронция и марганца.
Основы регенерации костной ткани
Известны два основных пути образования минерального матрикса:
На основе ранее сформировавшегося органического матрикса — образование апатита путем быстрой кристаллизации первичных кристаллов.
Путем кристаллизации из аморфных структур — медленная кристаллизация.
Возможным регуляторным механизмом данного процесса может быть изменение концентрации остатков фосфорных кислот за счет отщепления щелочной фосфатазы от глицеро- или гексофосфатов. В результате изменяется соотношение фосфатных ионов и ионов кальция, что приводит к отложению нерастворимых минеральных солей — образованию того самого минерального матрикса.
Насыщение органического матрикса грубоволокнистой костной ткани минеральными кристаллами, катионами и анионами приводит к повышению механической прочности межклеточного вещества, о чем было сказано выше.
Клетки костной ткани происходят из двух клеточных линий:
Полипотентные мезенхимальные стволовые клетки, которые находятся в костных каналах и костном мозге (преостеобласты, остеобласты, остеоциты).
Клетки, которые могут дифференцироваться из гемопоэтических стволовых клеток костного мозга — это остеобласты.
Источником преостеобластов также являются васкулярные клетки — периваскулоциты. Дифференциация преостеобластов в остеобласты происходит одновременно с процессом образования новых капилляров. При высоких показателях рО2 остеогенные клетки дифференцируются в остеобласты, при низких — в хондробласты.
В области активного формирования костной ткани выделяют три типа остеобластов, ультраструктура которых отображает особенности их функциональной активности.
Остеобласты подразделяют на зрелые и незрелые, активные и находящиеся в состоянии покоя. Зрелые остеобласты характеризуются высокой остеогенной активностью, быстро вырабатывают коллаген 1 типа, протеогликаны и остеокальцин.
Незрелые остеобласты непосредственно прилегают к кости со стороны надкостницы, а их цитоплазма содержит низкие концентрации гранул гликогена, тогда как преостеобласты богаты этим веществом.
Основной функцией активным остеобластов является синтез компонентов органического матрикса кости, цитокинов и факторов роста, а также продукция матриксных пузырьков, которые принимают участие в минерализации костной ткани.
Маркером остеобластов выступают синтезируемые ими ферменты — щелочная фосфатаза и остеокальцин. Остеобласты, которые не участвуют в процессе формирования костной ткани, называют дремлющими. Плотность мембранных органелл у этих клеток значительно ниже по сравнению с активными остеобластами, и находятся они на поверхности кости.
Определенная часть клеток перестает синтезировать костный матрикс — они называются остеоцитами. Клетки-остеоциты — высокодифференцированные клетки, происходящие из остеобластов и окруженные минерализованным костным матриксом. Они находятся преимущественно в лакунах, заполненных коллагеновыми фибриллами.
В зрелом скелете человека остеоциты составляют до 90% от общей популяции остеогенных клеток. Остеоциты отличаются слабовыраженными органеллами и не способны к дальнейшей пролиферации. От тел остеоцитов отходят длинные (до 60 мкм) отростки, которые размещаются в канальцах и анастомозируют с соседними клетками.
Основной функцией остеоцитов является обеспечение обмена воды, белков и ионов в костной ткани. Они принимают участие в остеолизисе, регулируют содержание минералов, особенно кальция, в плазме крови, а также обеспечивают транспортно-обменные процессы, противодействуют механическим нагрузкам на костные структуры.
Биологическая активность клеток-остеобластов и остеоцитов зависит от величины и направленности вектора нагрузки, характера и выраженности гормональных влияний и факторов местного окружения (экосистемы) клетки.
Согласно современным представлениям, одним из самых эффективных путей костной резорбции является остеокластическая резорбция.
Остеокласты происходят от гемопоэтических гранулоцитарных колониеобразующих единиц, которые являются предшественниками моноцитов / макрофагов. Об этом свидетельствует экспрессия на мембранах остеокластов рецепторов Fc, C3 и других мембранных маркеров макрофагов.
По своей структуре остеокласты — крупные многоядерные клетки размеров 150-180 мкм, которые содержат от 2 до 100 ядер. Разрушение костной ткани под их влиянием обусловлено выделением секрета двух типов: ионов Н+, которые растворяют минералы, и протеолитических ферментов (катепсин, коллагеназы), которые вызывают лизис органического матрикса костной ткани.
Адгезия остеокластов к кости опосредована белковыми рецепторами-интегринами, а регуляция функциональной активности клеток осуществляется остеобластами, а также многочисленными системными и локальными факторами.
В соответствии с современными представлениями, регенерация костной ткани протекает в двух формах — репаративной и физиологической.
Физиологическая регенерация костной ткани — это процесс замены старых несовершенных структур новыми, что можно рассматривать как непрерывный процесс ремоделирования.
У разных тканях возможности регенерации разные, и в значительной мере они связаны с наличием и активностью стволовых клеток.
Все известные механизмы образования костной ткани можно объединить двумя основными теориями морфогенеза. Они рассматривают процесс реконструкции с разных позиций.
По теории Frost, процесс ремоделирования костной ткани можно рассматривать как результат двух разнонаправленных процессов — резорбции и образования кости, в основе которых лежит понятие о функциях морфологической единицы ремоделирования кости.
Теория основана на морфологических (клеточных) ориентирах остеогенных механизмов и позволяет выделить два направления ремоделирования кости — поверхностное (в эндосте и надкостнице) и внутреннее (в трабекулах губчатой пластинки и кортикальном слое).
Другая теория, характеризующая процесс костного ремоделирования, ставит в основу биохимические аспекты его формирования. Lemperg, анализируя структуру цитоплазмы остеобластов, выявил многочисленные вакуоли, которые, превратившись в гранулы, становятся активными метаболическими центрами.
Остеокласты продуцируют мембранные пузырьки, которые считаются внеклеточными органеллами, способными накапливать ионизированные фосфаты и кальций. Деятельность этой системы характеризуется высокой точностью, циклическим характером и четкой возрастной зависимостью.
Полное обновление всех костей человеческого скелета происходит приблизительно каждые 10 лет, причем скорость обновления кортикальной пластинки примерно в 5 раз ниже, чем в губчатой. В любой момент времени около 2 миллионов костных единиц находится в состоянии ремоделирования.
Схема процесса физиологической регенерации костной ткани выглядит следующим образом.
Пусковым механизмом регенерации выступает отшелушивание покровных клеток, образовавшихся из остеобластов и выстилающих всю поверхность кости. Эти клетки исключительно богаты щелочной и пирофосфатазой, поэтому в результате образуются фосфорные эфиры с высоким уровнем свободных радикалов.
В этом участке обнажается костная поверхность, на которой фиксируются одноядерные клетки-предшественники остеокластов. Последние в течение 1-2 недель резорбируют определенную часть костной ткани, после чего замещаются мононуклеарными клетками, способствующими подготовке лакунарной поверхности к миграции клеток-предшественников остеобластов в участки резорбции.
Это явление известно как фаза переключения, когда процесс резорбции переходит в формообразующий процесс. В настоящее время достоверно не известны факторы, которые инициируют данный процесс. Возможно, это инсулиноподобный фактор роста II и трансформирующий фактор роста-бета, которые способны стимулировать репликацию и дифференциацию остеобластов в участке костной резорбции.
Далее наблюдается процесс заполнения полости костной резорбции органическим матриксом и минерализация последнего на протяжении 25-40 дней. Формирование минеральных структур носит циркадную периодичность, причем полный цикл ремоделирования костной ткани продолжается приблизительно 100 дней.
В физиологическом ремоделировании активно участвуют резорбирующие и остеогенные клетки. Клетки-инициаторы ремоделирования и клетки, которые индуцируют переключение, являются в настоящее время предметов активных научных исследований.
Цикл ремоделирования может нарушаться на любом этапе, что приводит к аномальному образованию костной ткани. Наиболее уязвимые моменты в данном цикле — повышенная активность остеокластов, замедление фазы переключения, неспособность клеток-остеобластов заполнить так называемую резорбционную нишу.
Описанные выше механизмы отображают морфологических подход к процессу регенерации костной ткани. Теория матриксных пузырьков, в свою очередь, трактует этот процесс через сложные биохимические связи органического и минерального матрикса кости: образование коллагеновых структур, формирование кристаллических и аморфных структур, метаболизм минерального матрикса и др.
Репаративная регенерация костной ткани — это процесс восстановления утраченных в результате действия патогенных факторов костных структур.
Восстановление целостности кости после перенесенного заболевания, травмы или медицинского вмешательства протекает при взаимодействии остеобластического и остеокластического клеточных дифферонов с участием капилляров.
Согласно современным представлениям, травматические повреждения костной ткани влекут за собой цепочку метаболических изменений не только в участке перелома, но и по всему организму. Раздражение соответствующих рецепторов индуцирует изменения активности регуляторных систем системного и локального действия.
В образовавшейся между костными отломками гематоме происходит активное накопление биологических продуктов, которые высвобождаются при процессе распада и лизиса тканей. Последние индуцируют запуск механизмов репаративного процесса.
Участок между костными отломками становится автономной областью, в которой повторяются закономерности, заложенные в филогенезе. На смену катаболической фазе приходит анаболическая фаза регенерации, протекающая с активным участием соединительной ткани.
Нити фибрина кровяного сгустка, которые остаются после абсорбции жидкой части гематомы, выполняют функцию твердого основания для пролиферации соединительнотканных клеток и прорастания капилляров.
Поначалу пролиферация фибробластов протекает в автономном режиме и регулируется по принципу положительной обратной связи, то есть посредством стимулирующего влияния результата на нижележащие звенья биологического процесса.
Отрицательная обратная связь возникает вследствие истощения запасов среды, уменьшения размера гематомы и нарастающего давления окружающих тканей. Направление гистогенеза клеток соединительной ткани определяется условиями механической стабильности и уровнем кровоснабжения окружающих тканей.
Продукты аутолиза, которые высвобождаются в катаболической фазе, являются важными факторами хемотаксиса для прорастания кровеносных сосудов. На месте гематомы быстро формируется соединительная ткань, которая становится мостиком между костными фрагментами.
Дальнейшее протекание и результат процесса консолидации определяется механической нагрузкой и качеством кровообращения в пораженном участке.
В настоящее время выделяют первичное (обусловленное мезенхимальной тканью) и вторичное (обусловленное хрящевой тканью) сращение кости.
Первичное сращение в естественных условиях наблюдается при переломах губчатых костей, когда присутствует механическая стабильность и адекватное кровообращение. При этом образуется костная спайка — интемедиарная костная мозоль со значительной контактной поверхностью, которая обеспечивает восстановление прочности кости.
Вторичное сращение представляет собой вариант консолидации переломов в природных условиях, при котором первоначальную стабильность обеспечивает фиброзно-хрящевая, а затем костно-хрящевая периостальная костная мозоль.
Последняя отвечает за восстановление прочности кости не только на уровне перелома, но и на всем протяжении участка некроза костных отломков.
После консолидации перелома механическая прочность костной мозоли, как правило, остается более высокой по сравнению с интактной костью.
Так в общих чертах выглядят механизмы регенерации костной ткани.
Биохимия костной ткани, тканей зуба, биохимия слюны
Костная ткань - это особый вид соединительной ткани. Костная ткань имеет особенности строения, которые не встречаются в других видах соединительной ткани. В ней преобладает межклеточное вещество, содержащее большое количество минеральных компонентов, главным образом - солей кальция. Основные особенности кости - твердость, упругость, механическая прочность.
В компактном веществе кости большая часть минеральных веществ представлена гидроксилапатитом (смотрите рисунок) и аморфным фосфатом кальция. Кроме них встречаются карбонаты, фториды, гидроксиды и значительное количество цитрата. Химический состав костной ткани (в%%): 20% - органический компонент, 70% - минеральные вещества, 10% - вода. Губчатое вещество: 35-40% - минеральных веществ, до 50% - органические соединения, содержание воды - 10%.
Особенность минерального компонента в том, что фактическое соотношение кальций/фосфор равно 1,5, хотя расчетное соотношение должно быть 1,67. Это позволяет кости легко связывать или отдавать ионы фосфата, поэтому кость - это депо для минералов, особенно для кальция.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ОБМЕН КАЛЬЦИЯ И ФОСФОРА
На обменкальция и фосфора влияют гормоны ПАРАТГОРМОН, СЕРОТОНИН и активная форма витамина D3.
Особое место среди нарушений обмена кальция и фосфора занимают остеопороз, некоторые формы рахита, некоторые заболевания почек.
За сутки из кишечника всасывается примерно 1 грамм кальция и только 1/3 от этого количества усваивается тканями организма. Столько же - 1грамм кальция - ежесуточно теряется с мочой и калом. В межклеточных жидкостях содержится тоже в среднем 1 грамм кальция. Значит, за одни сутки полностью обновляется весь внеклеточный кальций организма. У взрослого здорового человека в возрасте до 40 лет все процессы минерализации и резорбции костной ткани находятся в равновесии. У детей до окончательного окостенения наблюдается положительный кальциевый баланс. После 40-летнего возраста - отрицательный баланс кальция.
Паратгормон влияет на процессы созревания активного витамина D3 в почках. Активный витамин D3 (1,25-диоксивитамин D3) увеличивает всасывание кальция в кишечнике и повышает усвоение кальция костной тканью, усиливает действие паратгормона в костной ткани и почках.
РЕГУЛЯЦИЯ СИНТЕЗА И СЕКРЕЦИИ ПАРАТГОРМОНА И КАЛЬЦИТОНИНА.
Главным регулятором синтеза и секреции этих гормонов является внеклеточный кальций. Если уменьшается его концентрация во внеклеточной жидкости, это приводит к увеличению секреции кальцитонина и уменьшению секреции паратгормона и наоборот. На выработку паратгормона также влияют катехоламины, которые усиливают его секрецию.
КОРТИКОСТЕРОИДЫ (кортизол) тормозят всасывание кальция в кишечнике, увеличивают синтез и секрецию паратгормона.
Повышение содержания фосфатов в крови, приводя к одновременному снижению уровня кальция, также усиливает секрецию паратгормона.
Суммарной эффект паратгормона - резорбция костной ткани. Разрушению подвергается не только минеральный компонент, но и компоненты органического матрикса. Это подтверждается повышенным содержанием оксипролина (показатель ускорения разрушения коллагеновых белков) в моче при гиперсекреции паращитовидной железы. Значит, паратгормон в физиологических условиях способствует обновлению костной ткани, то есть происходит стимуляция остеокластов и одновременно усиливается пролиферация остеобластов. При действии паратгормона в костной ткани происходит закисление (снижение pH среды), так как в межклеточное пространство выделяются лактат и цитрат и повышается активность различных гидролитических ферментов, в том числе и лизосомальных протеиназ.
Кроме повышения концентрации кальция и понижения концентрации фосфатов в крови при гиперпаратиреозе может развиваться образование камней в почках - нефрокальциноз. Причина этого - постоянно повышенная концентрация кальция в крови и моче.
Вторичный гиперпаратиреоз при заболеваниях почек возникает при нарушении созревания активной формы витамина D3. Результат: снижение концентрации кальция в крови, что приводит к увеличению выработки паратгормона.
Гипопаратиреоз. Снижение уровня паратгормона в крови (может возникнуть при повреждении или удалении паращитовидных желез) приводит к снижению концентрации кальция и повышению концентрации фосфора в крови. В результате могут развиваться судороги, паралич дыхательной мускулатуры, ларингоспазм, что приводит к смерти больного.
КАЛЬЦИТОНИН
Пептидный гормон, состоит из 30 аминокислот. Клетки-мишени для этого гормона находится в костной ткани. Гормон обладает мембранным механизмом действия (действует через аденилатциклазную систему). Под действием кальцитонина происходит усиление перехода фосфатов в периостальную жидкость, в результате разрушения фосфорных эфиров различных органических соединений в клетках костной ткани. Выход фосфатов в межклеточное вещество способствует задержке кальция в костной ткани.
Таким образом, кальцитонин ингибирует процессы резорбции кости.
Органический матрикс кости.
Важный компонент органического матрикса - кальций-связывающий белок. Он состоит из 49 аминокислот, содержит 3 остатка гамма-карбоксиглутаминовой кислоты. Функция кальций-связывающего белка - регуляция связывания кальция в костях и зубах.
Основной белок костной ткани - коллаген, который содержится в количестве 15% - в компактном веществе, 24% - в губчатом веществе. Количество неколлагеновых белков составляет от 5 до 8%. В основном это белки- гликопротеины и белково-углеводные комплексы - протеогликаны.
Костный коллаген - коллаген типа 1 - в нем больше, чем в других видах коллагена, содержится оксипролина, лизина и оксилизина, отрицательно заряженных аминокислот, с остатками серина связано много фосфата, поэтому костный коллаген - это фосфопротеин. Благодаря своим особенностям костный коллаген принимает активное участие в минерализации костной ткани.
В зрелом организме процессы минерализации и резорбция кости находятся в состоянии динамического равновесия. Минерализация - это формирование кристаллических структур минеральных солей костной ткани. Активное участие в минерализации принимают остеобласты. Для минерализации требуется много энергии ( в форме АТФ ).
Можно выделить два основных этапа минерализации.
ЭТАПЫ МИНЕРАЛИЗАЦИИ КОСТНОЙ ТКАНИ
1-й ЭТАП: остеобласты начинают синтезировать костный коллаген, который содержит фосфаты и формирует хондроитинсульфаты. Костный коллаген является матрицей для процесса минерализации. Особенностью процесса минерализации является пересыщение среды ионами кальция и фосфора. На 1 этапе минерализации кальций и фосфор связываются с костным коллагеном. Обязательный участник процесса - сложные липиды.
2-й ЭТАП - в зоне минерализации усиливаются окислительные процессы, распадается гликоген, синтезируется необходимое количество АТФ. Кроме того, в остеобластах увеличивается количество цитрата, необходимого для синтеза аморфного фосфата кальция. Одновременно из лизосом остеобластов выделяются кислые гидролазы, которые взаимодействуют с белками органического компонента и приводят к образованию ионов аммония и гидроксид-ионов, которые соединены с фосфатом. Так формируются ядра кристаллизации. Ионы кальция и фосфора, которые были связаны с белково-углеводным комплексом, переходят в растворимое состояние и формируют кристаллы гидроксилапатита. По мере роста кристаллы гидроксилапатита вытесняют протеогликаны и даже воду до такой степени, что плотная ткань становится практически обезвоженной. Ингибитор процесса минерализации - неорганический пирофосфат. Его накопление в кости может препятствовать росту кристаллов. Чтобы этого не происходило, в остеобластах есть щелочная фосфатаза, которая расщепляет пирофосфат на два фосфатных остатка. При нарушении процессов минерализации - например, при заболевании оссифицирующим миозитом - кристаллы гидроксиапатита могут появлятся в сухожилиях, связках, стенках сосудов. Вместо кальция в костную ткань могут включаться другие элементы - стронций, магний, железо, уран и т.д. После формирования гидроксилапатита такое включение уже не происходит. На поверхности кристаллов может накапливаться много натрия в форме цитрата натрия. Кость выполняет функции лабильного (изменчивого) депо натрия, который выделяется из кости при ацидозе и, наоборот, при избытке поступления натрия с пищей, чтобы предотвратить алкалоз - натрий депонируется в кости. В ходе роста и развития организма количество аморфного фосфата кальция уменьшается, потому что кальций связывается с гидроксилапатитом.
БИОХИМИЯ ТКАНЕЙ ЗУБА
Твердые ткани зуба - к ним относят эмаль ( в коронке зуба), дентин и цемент ( на поверхности корня). В отличие от других видов костной ткани, ткани зуба еще более минерализованы.
В заметных количествах в твердых тканях зуба содержатся магний, натрий, калий, хлор (их больше в цементе и в эмали).
ЭМАЛЬ
Содержит гидроксилапатит, фторапатит, фторид кальция. Соотношение кальций/фосфор в эмали равно 1,75, поэтому эмаль еще более минерализирована, чем кость. С возрастом это соотношение доходит до 2,09. Органическое вещество эмали образуют в основном белки - амелогенины. Основная функция этих белков - формирование нерастворимой органической матрицы эмали, которая затем минерализируется благодаря особому кальций-связывающему белку эмали. В состав эмали также могут входить глюкозаминогликаны и цитрат. Особенности метаболизма эмали - это крайне низкая скорость обмена. Обмен ионами возможен со стороны полости рта - через слюну.
ДЕНТИН.
Дентин в отличие от эмали содержит много сиалопротеинов (это неколлагеновые белки). По степени минерализации дентин аналогичен компактному веществу костной ткани. Минеральный компонент - гидроксилапатит, в котором чаще, чем в кости, обнаруживается магний. Фтористые соли также содержатся в дентине. В состав органического вещества дентина входит коллаген, богатый фосфатом, хондроитинсульфаты, гиалуроновая кислота. При развитии кариеса в поврежденном дентине и уменьшается количество оксипролина и оксилизина и растет количество глюкозаминогликанов. Клеточные элементы - одонтобласты.
ЦЕМЕНТ
Цемент еще менее минерализован, чем дентин. Здесь больше воды и протеогликанов. Клеточные элементы - цементобласты.
ПУЛЬПА.
Это особая соединительная ткань, похожая на эмбриональную соединительную ткань. Поскольку пульпа наиболее метаболически активна, в ней много ферментов. Кроме фибропластов, в пульпе есть и жировые клетки. В межклеточном веществе - гликопротеины, глюкозаминогликаны. Волокнистая структура пульпы - это тонкие коллагеновые волокна. Функция пульпы: формирование дентина и обеспечение метаболических процессов в дентине.
БИОХИМИЯ СЛЮНЫ.
Слюна - это секрет слюнных желез. В состав смешанной слюны входит секрет 3-х пар слюнных желез и мелких желез. В составе смешанной слюны присутствуют белки - из разрушенных клеток слюнных желез, эпителиальные клетки слизистой оболочки. Общее количество слюны выделяемой за сутки составляет 1-2л. Секреция слюны протекает как безусловно рефлекторно, так и условно рефлекторно.
Основные функции слюны:
1) переваривание углеводов,
2) защитная - благодаря содержанию некоторых специальных белков: лизоцима, Ig А и некоторых факторов свертывания крови
3) источник минеральных веществ для эмали зуба.
Физико-химические свойства:
Слюна - это бесцветная жидкость, обладающая высокой вязкостью, удельный вес - 1,001-1,017. Вязкость связана с наличием гликопротеинов. рН слюны составляет от 6,4 до 7,0 и зависит от гигиенического состояния полости рта, характера пищи и скорости секреции. Снижение скорости секреции снижает рН. А снижение рН слюны приводит к быстрому развитию кариеса.
Химический состав слюны:
99,5% - вода, а остальное - растворенные в ней минеральные вещества и органические компоненты.
Органические вещества слюны - это белки, которые синтезируются в слюнных железах и вне их. Концентрация белков в слюне - от 1 до 4 г/л. При исследовании состава слюны из околоушных желез было показано, что концентрация белка меняется с возрастом. У детей в возрасте до 14 лет - 2,5-3г/л, от 14 до 20 лет - до 6-7г/л, в зрелом возрасте падает до 3г/л. Это объясняется интенсивностью синтеза белка слюнными железами. Из слюнных желез секретируются гликопротеины - муцины и Ig А. Некоторые белки - из крови - ферменты, Ig G, Ig M, трансферрин, церулоплазмин, групповые специфич. белки АВО-системы, лизоцимы слюны - гликопротеины, содержащие углеводы до 50%. Углеводный компонент - N-ацетилгалактозамин, фукоза и галактоза, сиаловые кислоты. Саливапаротин (молекулярная масса - 16 кДа), его функция - cвязывание кальция в слюне. Фосфопротеин - кальций-связывающий белок имеет большое сродство к гидроксилапатиту. Способствует образованию зубного камня и зубного налета.
В слюне также есть небелковые азотистые соединения - 200мг/л - мочевина, мочевая кислота, свободные аминокислоты, нуклеотиды.
Из углеводов в слюне присутствуют свободные моносахариды - 30 мг/л (глюкоза-10мг/л, лактат- 20-40мг/л, ПВК - 2-4мг/л, цитрат - 2-20мг/л).
В смешанной слюне есть стероиды (из коры надпочечников и половых желез), свободные жирные кислоты, фосфолипиды и некоторые витамины - В1 , В2 , В3 , РР, В6 , фолиевая кислота.
Минеральный состав слюны: натрий - 20-40мэкв/л (это в 5-7 раз меньше, чем в плазме), калий - 15-25 мэкв/л ( в плазме - 4 мэкв/л), кальций - от 3 до 8 мэкв/л (как в плазме). Рост концентрации кальция в слюне может приводить к развитию слюннокаменной болезни и образованию камней в протоках. Содержание фосфора в слюне - в 5-10 раз выше, чем в крови, в основном, в форме гидро- и дигидрофосфата. СI - 20-40мэкв/л, НСО3 - 10-20мэкв/л. Кроме этого, в слюне есть магний, цинк и медь. Концентрация других минеральных веществ зависит от диеты.
Наличие кальция и фосфора в слюне обеспечивает поддержание постоянства состава тканей зуба. Высокое содержание кальция и фосфора в слюне:
1) препятствует растворению эмали;
2) обеспечивает поступление ионов кальция и фосфора в эмаль;
3) регулирует рН слюны. Изменение рН в щелочную сторону связано с увеличением количества кальция и фосфора в слюне. Если рН слюны снижается, то это говорит о недостатке кальция и фосфора в слюне.
В слюне содержатся ферменты всех классов, кроме лигаз (всего 30 ферментов). Не все они синтезируются слюнными железами, часть попадает в слюну из разрушенных клеток или из крови.
Альфа-амилаза синтезируется у человека, у собаки, кошки, в слюне лошади нет альфа-амилазы. Активность альфа-амилазы изменяется при патологических состояниях. Например, при воспалении поджелудочной железы (панкреатит) в смешанной слюне ее активность возрастает в 20-30 раз. В норме в слюне обнаруживается альфа-амилаза панкреатического сока. Растет содержание альфа-амилазы в слюне и у больных сахарным диабетом.
Лизоцим, который содержится в слюне, обладает бактерицидным действием, катализирует гидролиз гликозамингликанов, 1,4-гликозидных связей в N-ацетилмурамовой кислоте. Синтезируется слюнными железами. Молекулярная масса лизоцима составляет 15-17 кДа, оптимум действия при рН 5-7. Синтезируется околоушными железами в концентрации 0.5 мг/л.
Читайте также:

