Какие еще окислительно восстановительного процессы протекают в пародонте
Опубликовано: 01.05.2024
2015-01-21
16326
Окислительно-восстановительные процессы (ОВП) играют важную роль в жизнедеятельности организма, поскольку именно в процессах окисления происходит выделение и запас энергии, а восстановительные процессы связаны с биосинтезом белков, нуклеиновых кислот, полисахаридов в организме. Окислительно-восстановительные реакции – это реакции, идущие с переносом электронов и изменением степени окисления элементов.
ОВП состоят из двух одновременно протекающих и противоположно направленных процессов - окисления и восстановления. Окисление – это процесс отдачи электронов, в ходе которого происходит увеличение степени окисления элементов. Восстановление - это процесс присоединения электронов, в ходе которого происходит уменьшение степени окисления элементов. Окислитель – это вещество, атом которого принимает электроны, тем самым уменьшая степень окисления. Восстановитель – это вещество, атом которого отдает электроны, тем самым увеличивая степень окисления. ОВП подразделяются на три типа.
1. Межмолекулярные, в которых окислитель и восстановитель находятся в разных молекулах, например:
окислитель - Mn +7 , восстановитель - N +3 .
2. Внутримолекулярные, в которых окислитель и восстановитель находятся в одной молекуле, но являются разными элементами, например:
2KCl +5 O3 -2 = 2KCl -1 + 3O4 0
окислитель - Cl +5 , восстановитель - O -2 .
3. Диспропорционирования (самоокисления - самовосстановления), в которых окислителем является один и тот же элемент в одной и той же степени окисления, например:
3Cl2 0 + 6KOH = 5КСl -1 + KCl +5 O3 + 3H2O
окислитель - Cl 0 , восстановитель - Cl 0 .
В ходе окислительно-восстановительных процессов между частями системы происходит перераспределение зарядов. Возникающая разность зарядов между частями системы носит название потенциал. Существует несколько видов потенциалов, связанных с прохождением различных процессов.
Одним из них является электродный потенциал, который возникает в том случае, когда пластинку металла погружают в раствор его соли (например, пластинку цинка в раствор сульфата цинка). При этом возможно прохождение двух процессов, которые определяются активностью металла и концентраций его катиона в растворе (рис.1).
Ме n+ + _ + Ме n+ _ + _
рис. 1 Виды электродных процессов
Первый процесс происходит в том случае, когда активность металла высока, а концентрация его катиона невелика. В этом случае (см. рис. 1) ионы металла, находящиеся в узлах кристаллической решетки металла, вследствие гидратации будут переходить в раствор, заряжая его положительно; электроны, входящие в состав «электронного газа» (особенности металлической связи) остаются на куске металла, придавая ему отрицательный заряд.
В случае низкой активности металла и высокой концентрации его катиона процесс может идти в другом направлении (см. рис. 2). Катионы металла могут перейти на пластинку, достраивая кристаллическую решетку металла и придавая ей положительный заряд; анионы соли остаются в растворе, заряжая его отрицательно. В обоих процессах между пластинкой металла и раствором его соли возникает разность зарядов, называемая электродным потенциалом Е. Независимо от механизма возникновения электродного потенциала, он определяется окислительно-восстановительным процессом, а его величина - уравнением Нернста:
где: Е - потенциал системы,
Е 0 - стандартный потенциал системы, т.е. потенциал, определенный в стандартных условиях (Т=292 К, р=1 атм, [Red] = [Ох] = 1 моль/л)
Т - абсолютная температура,
n - число электронов, участвующих в процессе,
R = 8,31 Дж/моль * К,
F = 96500 Кл/моль
[Ме п+ ] - равновесная концентрация соли данного металла.
Подставляя постоянные при 25 0 С, получим:
По величине стандартного электродного потенциала все металлы выстраиваются в электрохимический ряд напряжений.

Одним из основных является окислительно-восстановительный потенциал. Его возникновение связано с обратимостью окислительно-восстановительных процессов. Одно и то же вещество в зависимости от условий может находиться либо в окисленной (Oх), либо восстановленной (Red) форме. Между этими двумя формами идут процессы взаимного перехода, сопровождающиеся изменением заряда системы. Процесс взаимного перехода идет до тех пор, пока между двумя формами не установится равновесие:
После установления равновесия в системе возникает избыточный заряд, называемый окислительно-восстановительным или редокс-потенциалом. Его величина определяется уравнением Нернста:
где: Е - потенциал системы,
Е 0 - стандартный потенциал системы, т.е. потенциал, определенный в стандартных условиях (Т=292 К, р=1 атм, [Red] = [Ох] = 1 моль/л)
[Red], [Ох] - равновесные концентрации восстановленной и окисленной форм.
Любой окислительно-восстановительный процесс можно представить как взаимодействие двух редокс-систем - системы окислителя и системы восстановителя. Направление ОВП будет определяться величинами редокспотенциалов систем.
При этом можно выделить следующие закономерности:
1. Одна и та же редокс-система может являться как окислителем, так и восстановителем - это зависит от соотношения величин потенциалов;
2. Системы с более отрицательным потенциалом будут восстанавливать системы с более положительным потенциалом;
3. После прохождения ОВП потенциалы редокс-систем выравниваются.
Возникновение разности зарядов между частями системы может быть и не связано с прохождением ОВП. Так, в ходе процесса диффузии между частями раствора, вследствие различной подвижности ионов, возникает разность зарядов, называемая диффузным потенциалом. Диффузный потенциал существует недолго и исчезает по окончании процесса диффузии.
Если два раствора разделить полупроницаемой мембраной, то на сторонах мембраны возникает разность зарядов, называемая мембранным потенциалом. Возникновение мембранного потенциала связано с тем, что вследствие различного размера ионов они могут проходить или не проходить через мембрану.
В живых организмах, вследствие наличия многочисленных мембран, направленного транспорта веществ и прохождения различных ОВП между его частями, возникает разность зарядов, называемая биопотенциалами. По своей природе биопотенциалы могут быть диффузными, мембранными и редокспотенциалами. Биопотенциалы играют важнейшую роль в направленном транспорте веществ, работе мембранных систем, процессах биосинтеза, выделение и запасание энергии. Выделение и запасание организмом энергии тесно связано с процессами окисления и восстановления.
Электродные потенциалы. ЭДС реакции
Окислительно — восстановительный потенциал является частным, узким случаем понятия электродного потенциала. Рассмотрим подробнее эти понятия.
В ОВР передача электронов восстановителями окислителям происходит при непосредственном контакте частиц, и энергия химической реакции переходит в теплоту.
Энергия любой ОВР, протекающей в растворе электролита, может быть превращена в электрическую энергию, если, например, окислительно-восстановительные процессы разделить пространственно, т.е. передача электронов восстановителем будет происходить через проводник электричества.
Это реализовано в гальванических элементах, где электрическая энергия получается из химической энергии окислительно-восстановительной реакции.
Элемент Даниэля-Якоби
Рассмотрим гальванический элемент Даниэля-Якоби, в котором левый сосуд наполнен раствором сульфата цинка ZnSO4, с опущенной в него цинковой пластинкой, а правый сосуд – раствором сульфата меди CuSO4, с опущенным в него медной пластинкой.
гальванический элемент Даниэля-Якоби
Взаимодействие между раствором и пластиной, которая выступает в качестве электрода, способствует тому, чтобы электрод приобрел электрический заряд.
Возникающая на границе металл-раствор электролита разность потенциалов, называется электродным потенциалом. Значение и знак (+ или -) электродного потенциала определяются природой раствора и находящегося в нем металла.
При погружении металлов в растворы их солей более активные из них (Zn, Fe и др.) заряжаются отрицательно, а менее активные (Cu, Ag, Au и др.) положительно.
Результатом соединения цинковой и медной пластинки проводником электричества, является возникновение в цепи электрического тока за счет перетекания электронов с цинковой к медной пластинке по проводнику.
При этом происходит уменьшение количества электронов в цинке, что компенсируется переходом Zn 2+ в раствор т.е. происходит растворение цинкового электрода — анода (процесс окисления).
Zn — 2e — = Zn 2+
В свою очередь, рост количества электронов в меди компенсируется разряжением ионов меди, содержащихся в растворе, что приводит к накоплению меди на медном электроде – катоде (процесс восстановления):
Cu 2+ + 2e — = Cu
Таким образом, в элементе Даниэля-Якоби происходит такая реакция:
Zn + Cu 2+ = Zn 2+ + Cu
Zn + CuSO4 = ZnSO4 + Cu
Количественно охарактеризовать окислительно-восстановительные процессы позволяют электродные потенциалы, измеренные относительно нормального водородного электрода (его потенциал принят равным нулю).
Чтобы определить стандартные электродные потенциалы используют элемент, одним из электродов которого является испытуемый металл (или неметалл), а другим является водородный электрод. По найденной разности потенциалов на полюсах элемента определяют нормальный потенциал исследуемого металла.
Окислительно-восстановительный потенциал
Значениями окислительно-восстановительного потенциала пользуются в случае необходимости определения направления протекания реакции в водных или других растворах.
2Fe 3+ + 2I — = 2Fe 2+ + I2
таким образом, чтобы йодид-ионы и ионы железа обменивались своими электронами через проводник.
В сосуды, содержащие растворы Fe 3+ и I — , поместим инертные (платиновые или угольные) электроды и замкнем внутреннюю и внешнюю цепь. В цепи возникает электрический ток.
Йодид-ионы отдают свои электроны, которые будут перетекать по проводнику к инертному электроду, погруженному в раствор соли Fe 3+ :
2I — — 2e — = I2
2Fe 3+ + 2e — = 2Fe 2+
Процессы окисления-восстановления происходят у поверхности инертных электродов. Потенциал, который возникает на границе инертный электрод – раствор и содержит как окисленную, так восстановленную форму вещества, называется равновесным окислительно-восстановительным потенциалом.
Факторы, влияющие на значение окислительно-восстановительного потенциала
Значение окислительно-восстановительного потенциала зависит от многих факторов, в том числе и таких как:
1) Природа вещества (окислителя и восстановителя)
2) Концентрация окисленной и восстановленной форм.
При температуре 25°С и давлении 1 атм. величину окислительно-восстановительного потенциала рассчитывают с помощью уравнения Нернста:
E – окислительно-восстановительный потенциал данной пары;
E°- стандартный потенциал (измеренный при Cок = Cвос);
R – газовая постоянная (R = 8,314 Дж);
T – абсолютная температура, К
n – количество отдаваемых или получаемых электронов в окислительно-восстановительном процессе;
F – постоянная Фарадея (F = 96484,56 Кл/моль);
Cок – концентрация (активность) окисленной формы;
Cвос– концентрация (активность) восстановленной формы.
Подставляя в уравнение известные данные и перейдя к десятичному логарифму, получим следующий вид уравнения:
При Cок > Cвос, E > E° и наоборот, если Cок 2- , CrO4 2- , MnO4 — ) при уменьшении pH раствора окислительно-восстановительный потенциал возрастает, т.е. потенциал растет с ростом H + . И наоборот, окислительно-восстановительный потенциал падает с уменьшением H + .
4) Температура
При увеличении температуры окислительно-восстановительный потенциал данной пары также растет.
Стандартные окислительно-восстановительные потенциалы представлены в таблицах специальных справочников. Следует иметь ввиду, что рассматриваются только реакции в водных растворах при температуре ≈ 25°С.
Такие таблицы дают возможность сделать некоторые выводы:
Что можно определить по значению окислительно-восстановительного потенциала
- Величина и знак стандартных окислительно-восстановительных потенциалов, позволяют предсказать какие свойства (окислительные или восстановительные) будут проявлять атомы, ионы или молекулы в химических реакциях, например
E°(F2/2F — ) = +2,87 В – сильнейший окислитель
E°(K + /K) = — 2,924 В – сильнейший восстановитель
Окислительно-восстановительная пара будет обладать тем большей восстановительной способностью, чем больше числовое значение ее отрицательного потенциала, а окислительная способность тем выше, чем больше положительный потенциал.
- Возможно определить какое из соединений одного элемента будет обладать наиболее сильным окислительными или восстановительными свойствами.
- Возможно предсказать направление ОВР. Известно, что работа гальванического элемента имеет место при условии, что разность потенциалов имеет положительное значение. Протекание ОВР в выбранном направлении также возможно, если разность потенциалов имеет положительное значение. ОВР протекает в сторону более слабых окислителей и восстановителей из более сильных, например, реакция
Sn 2+ + 2Fe 3+ = Sn 4+ + 2Fe 2+
практически протекает в прямом направлении, т.к.
E° (Sn 4+ /Sn 2+ ) = +0,15 В,
E° (Fe 3+ /Fe 2+ ) = +0,77 В,
т.е. E° (Sn 4+ /Sn 2+ ) 3+ /Fe 2+ ).
Cu + Fe 2+ = Cu 2+ + Fe
невозможна в прямом направлении и протекает только справа налево, т.к.
В процессе ОВР количество начальных веществ уменьшается, вследствие чего Е окислителя падает, а E восстановителя возрастает. При окончании реакции, т.е. при наступлении химического равновесия потенциалы обоих процессов выравниваются.
- Если при данных условиях возможно протекание нескольких ОВР, то в первую очередь будет протекать та реакция, у которой разность окислительно-восстановительных потенциалов наибольшая.
- Пользуясь справочными данными, можно определить ЭДС реакции.
Как определить электродвижущую силу (ЭДС) реакции?
Рассмотрим несколько примеров реакций и определим их ЭДС:
- Mg + Fe 2+ = Mg 2+ + Fe
- Mg + 2H + = Mg 2+ + H2
- Mg + Cu 2+ = Mg 2+ + Cu
E° (Mg 2+ /Mg) = — 2,36 В
E° (Fe 2+ /Fe) = — 0,44 В
Чтобы определить ЭДС реакции, нужно найти разность потенциала окислителя и потенциала восстановителя
ЭДС = Е 0 ок — Е 0 восст
- ЭДС = — 0,44 — (- 2,36) = 1,92 В
- ЭДС = 0,00 — (- 2,36) = 2,36 В
- ЭДС = + 0,34 — (- 2,36) = 2,70 В
Все вышеуказанные реакции могут протекать в прямом направлении, т.к. их ЭДС > 0.
Связь константы равновесия и окислительно — восстановительного потенциала
Если возникает необходимость определения степени протекания реакции, то можно воспользоваться константой равновесия.
Например, для реакции
Zn + Cu 2+ = Zn 2+ + Cu
Применяя закон действующих масс, можно записать
Здесь константа равновесия К показывает равновесное соотношение концентраций ионов цинка и меди.
Значение константы равновесия можно вычислить, применив уравнение Нернста
Подставим в уравнение значения стандартных потенциалов пар Zn/Zn 2+ и Cu/Cu 2+ , находим
В состоянии равновесия E 0 Zn/Zn2+ = E 0 Cu/Cu2+, т.е.
-0,76 + (0,59/2)lgCZn2+ = +0,34 + (0,59/2)lgCCu2+, откуда получаем
Значение константы равновесия показывает, что реакция идет практически до конца, т.е. до того момента, пока концентрация ионов меди не станет в 10 37,7 раз меньше, чем концентрация ионов цинка.
Константа равновесия и окислительно-восстановительный потенциал связаны общей формулой:
lgK = (E1 0 -E2 0 )n/0,059, где
K — константа равновесия
E1 0 и E2 0 – стандартные потенциалы окислителя и восстановителя соответственно
n – число электронов, отдаваемых восстановителем или принимаемых окислителем.
Если E1 0 > E2 0 , то lgK > 0 и K > 1.
Следовательно, реакция протекает в прямом направлении (слева направо) и если разность (E1 0 — E2 0 ) достаточно велика, то она идет практически до конца.
Напротив, если E1 0 0 , то K будет очень мала.
Реакция протекает в обратном направлении, т.к. равновесие сильно смещено влево. Если разность (E1 0 — E2 0 ) незначительна, то и K ≈ 1 и данная реакция не идет до конца, если не создать необходимых для этого условий.
Зная значение константы равновесия, не прибегая к опытным данным, можно судить о глубине протекания химической реакции. Следует иметь ввиду, что данные значений стандартных потенциалов не позволяют определить скорость установления равновесия реакции.
По данным таблиц окислительно-восстановительных потенциалов возможно найти значения констант равновесия примерно для 85000 реакций.
Как составить схему гальванического элемента?
Приведем рекомендации ИЮПАК, которыми следует руководствоваться, чтобы правильно записать схемы гальванических элементов и протекающие в них реакции:
- ЭДС элемента — величина положительная, т.к. в гальваническом элементе работа производится.
- Значение ЭДС гальванической цепи – это сумма скачков потенциалов на границах раздела всех фаз, но, учитывая, что на аноде происходит окисление, то из значения потенциала катода вычитают значение потенциала анода.
Таким образом, при составлении схемы гальванического элемента слева записывают электрод, на котором происходит процесс окисления (анод), а справа – электрод, на котором происходит процесс восстановления (катод).
- Граница раздела фаз обозначается одной чертой — |
- Электролитный мостик на границе двух проводников обозначается двумя чертами — ||
- Растворы, в которые погружен электролитный мостик записываются слева и справа от него (если необходимо, здесь же указывается концентрация растворов). Компоненты одной фазы, при этом записываются через запятую.
Например, составим схему гальванического элемента, в котором осуществляется следующая реакция:
Fe 0 + Cd 2+ = Fe 2+ + Cd 0
В гальваническом элементе анодом является железный электрод, а катодом – кадмиевый.
Анод Fe 0 |Fe 2+ || Cd 2+ |Cd 0 Катод
Типичные задачи на составление схем гальванического элемента и вычисление ЭДС реакции с решениями вы найдете здесь.
Окислительно-восстановительный (редокс) потенциал
Напомним, что ОВП крови (-100/-50) мВ, рн крови (7,35-7,45).
ВЫВОД
Получается, что если хочешь быть здоровым — пей нормальную воду с ОВП не больше (+50), а лучше (-100) из озера Байкал
ЧТО ПИТЬ ПОЛЕЗНЕЕ ВСЕГО?
Восстановление качества воды
ОВП - Редокс-потенциал некоторых распространенных напитков
• Ионизированная вода -100-300 мВ
• Молоко матери: около -70 мВ
• Кровь человека имеет от -50 до -100 мВ
• Сок томатный +36 мВ (±15)
• Чай зелёный +50 мВ (±15)
• Красное вино +50 мВ (±15)
• Чай чёрный +65 мВ (±15)
• Кофе «Нескафе» растворимый +70 мВ (±15)
• Вода из природных источников: от -30 до +70 мВ
• Свежевыжатый сок «с грядки»: от -30 до +70 мВ
• Пиво «Девятка» крепкое +74 мВ (±15)
• Свежевыжатый сок после суток хранения:до +100 мВ
• Молоко сырое: около +150 мВ
• Чай чёрный: около +200 мВ
• Вино красное: от +200 до +250 мВ
• Кока-кола +300 мВ (±25)
• Вода водопроводная +250 +350 мВ
• Вода водопроводная: от +220 до +380 мВ
• Фасованные соки и воды: от +210 до +400 мВ
• Уксусная 5% кислота +400 мВ (±15)
ОВП - Окислительно-восстановительный (редокс) потенциал
Окислительно-восстановительный потенциал определяют электрохимическими методами с использованием стеклянного электрода с red-ox функцией и выражают в милливольтах (мВ) относительно стандартного водородного электрода в стандартных условиях.
В справочнике по гидрохимии дано следующее определение:
"Окислительно-восстановительный потенциал (ОВП) является мерой химической активности элементов или их соединений в обратимых химических процессах, связанных с изменением заряда ионов в растворах".
Окислительно-восстановительный потенциал (ОВП)
В переводе на более понятный неспециалисту язык это означает, что ОВП, называемый также редокс-потенциал (от английского RedOx - Reduction/Oxidation), характеризует степень активности электронов в окислительно-восстановительных реакциях, т.е. реакциях, связанных с присоединением или передачей электронов.
Значение окислительно-восстановительного потенциала для каждой окислительно-восстановительной реакции вычисляется по довольно сложной формуле, выражается в милливольтах (мВ) и может иметь как (+)положительное, так и (-)отрицательное значение.
В природной воде значение Eh колеблется от -400 до +700 мВ, что определяется всей совокупностью происходящих в ней окислительных и восстановительных процессов.
В условиях равновесия значение ОВП определенным образом характеризует водную среду, и его величина позволяет делать некоторые общие выводы о химическом составе воды.
В зависимости от значения ОВП различают несколько основных ситуаций, встречающихся в природных водах:
1.Окислительная.
Характеризуется значениями Еh> +(100-150) мВ, присутствием в воде свободного кислорода, а также целого ряда элементов в высшей форме своей валентности (Fe3+, Mo6+, As5-, V5+, U6+, Sr4+, Cu2+, Pb2+).
Ситуация, наиболее часто встречающаяся в поверхностных водах.
2.Переходная окислительно-восстановительная
Определяется величинами Еh от 0 до +100 мВ, неустойчивым геохимическим режимом и переменным содержанием сероводорода и кислорода.
В этих условиях протекает как слабое окисление, так и слабое восстановление целого ряда металлов;
3.Восстановительная.
Характеризуется значениями Еh
ОВП ОБЫЧНОЙ ПИТЬЕВОЙ ВОДЫ
Вода из под крана, питьевая вода в бутылках и пр., измеренный таким же способом, практически всегда больше нуля и обычно находится в пределах от +200 до +300 mV.
Когда обычная питьевая вода проникает в ткани человеческого (или иного) организма, она отнимает электроны от клеток и тканей, которые состоят из воды на 70-80 %.
В результате этого биологические структуры организма (клеточные мембраны, органоиды клеток, нуклеиновые кислоты и другие) подвергаются окислительному разрушению.
Так организм изнашивается, стареет, жизненно-важные органы теряют свою функцию.
Но эти негативные процессы могут быть замедлены, если в организм с питьём и пищей поступает вода, обладающая свойствами внутренней среды организма, т.е. обладающая защитными восстановительными свойствами.
Это подтверждается многочисленными исследованиями в специализированных научных центрах в России и за рубежом.
Для того, чтобы организм оптимальным образом использовал в обменных процессах питьевую воду с положительным значением окислительно-восстановительного потенциала, её ОВП должен соответствовать значению ОВП внутренней среды организма.
Необходимое изменение ОВП воды в организме происходит за счёт затраты электрической энергии клеточных мембран, т.е. энергии самого высокого уровня, энергии, которая фактически является конечным продуктом биохимической цепи трансформации питательных веществ.
Количество энергии, затрачиваемой организмом на достижение биосовместимости воды, пропорционально ее количеству и разности ОВП воды и внутренней среды организма.
Различия ОВП внутренней среды организма человека и питьевой воды означают, что активность электронов во внутренней среде организма человека намного выше, чем активность электронов в питьевой воде.
Если поступающая в организм жидкость имеет ОВП, близкий к значению ОВП внутренней среды организма человека, то электрическая энергия клеточных мембран (жизненная энергия организма) не расходуется на коррекцию активности электронов этой жидкости, и она тотчас же усваивается, поскольку обладает биологической совместимостью по этому параметру.
Если же поступающая жидкость имеет ОВП более отрицательный, чем ОВП внутренней среды организма, то она подпитывает его этой энергией, которая используется клетками как энергетический резерв антиоксидантной защиты организма от неблагоприятного влияния внешней среды.
Широко известны антисептические, бактерицидные свойства водных растворов с повышенным ОВП.
Например, электрохимически активированная вода, обработанная в анодных камерах двухкамерных электролитических реакторов.
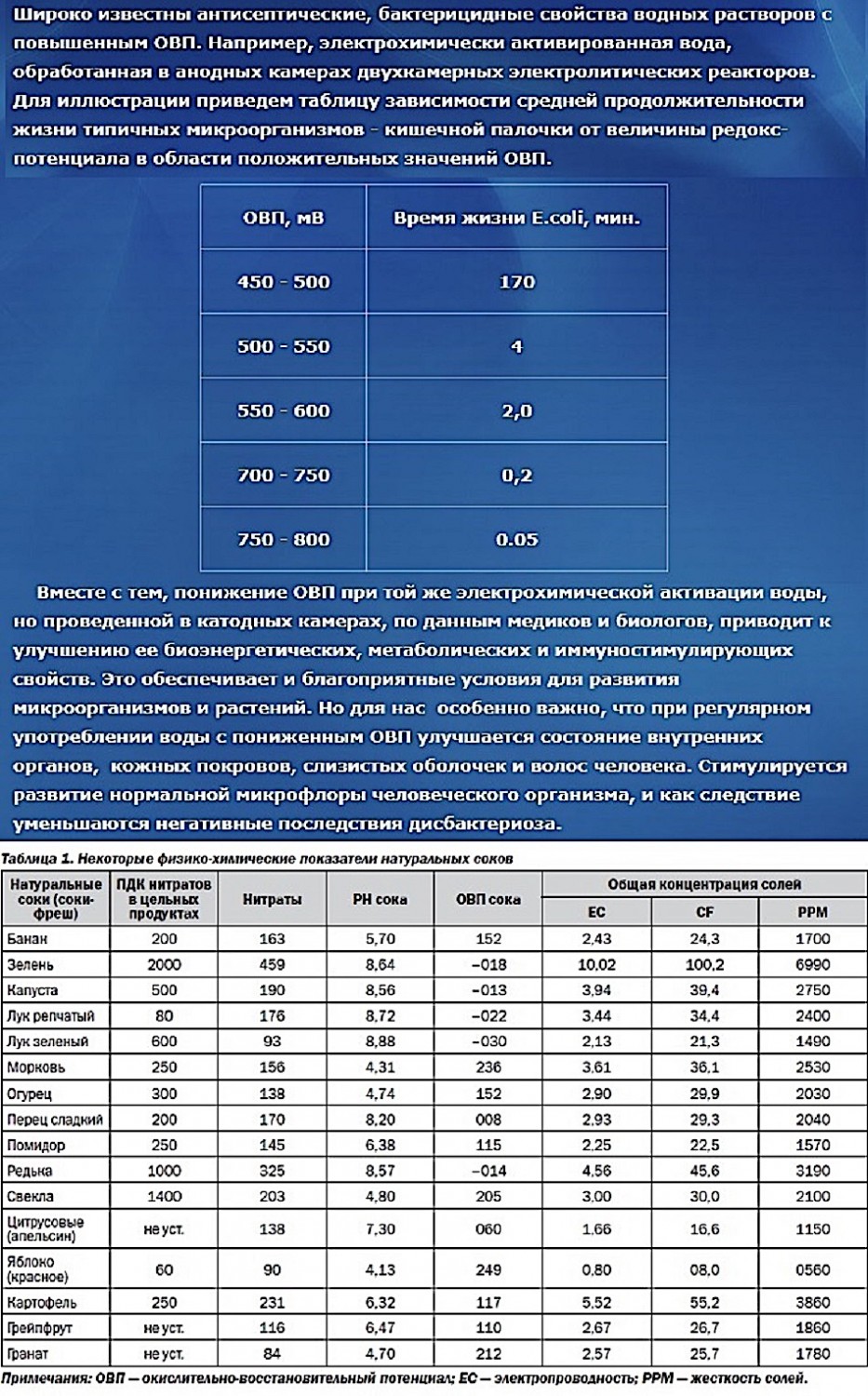
Для иллюстрации приведем таблицу зависимости средней продолжительности жизни типичных микроорганизмов - кишечной палочки от величины редокс-потенциала в области положительных значений ОВП. табл 1
Такая вода за счёт своих восстановительных свойств нормализует окислительно-восстановительный баланс в организме и тем самым:
# нормализует микрофлору желудочно-кишечного тракта путём стимулирования роста собственной нормальной микрофлоры (бифидобактерий и лактобацилл) и подавления патогенной и условнно-патогенной микрофлоры, в том числе золотистого стафилококка, сальмонеллы, шигеллы (дизентерия), аспергилл, листерий, клостридий, синегнойной палочки, хеликобактер пилори (которая считается основной причиной возникновения язвенных болезней);
- # подавляет кандидоз (молочницу) в желудочно-кишечном тракте и слизистых;
- # восстанавливает и активизирует иммунную систему у людей с ослабленным иммунитетом и после иммунодепрессивной терапии, в том числе, после воздействия лучевой и химиотерапии;
- # обладает мощными антиоксидантными свойствами;
- # обладает антимутагенными свойствами;
- # восстанавливает детоксицирующую функцию печени;
- # обладает гепатопротекторными свойствами;
- # обладает ранозаживляющими и противовоспалительными свойствами;
- # обладает высокими противовирусными и вирулицидными свойствами в отношении вируса гепатита С, генитального герпеса и вируса простого герпеса 1 типа (больше известного как «простуда на губах»);
- # обладает противовирусными и вирулицидными свойствами в отношении вируса гриппа «А» — самого распространенного гриппа среди людей.
По данным российских и иностранных научных публикаций, кроме вышеперечисленных свойств, вода с отрицательным окислительно-восстановительным потенциалом:
- # способствует устранению инфекционных и воспалительных проявлений простатита;
- # стимулирует процессы роста, физиологической и репаративной регенерации;
- # обладает спазмолитическим действием при почечной колике;
- # обладает антсептическим, диуретеским (мочегоны) действием;
- # рекомендуется для профилактики мочекаменной болезни (вымывание «песка» и мелких камней);
- # влияет на регуляцию процессов роста и деятельности клеток всех видов тканей;
- # является биостимулятором для восстановления печеночной ткани;
- # нормализует обмен веществ;
- # вызывает общий анаболический эффект;
- # является общеукрепляющим средством при переутомлении, астенических состояниях и для ослабленных больных;
- # способствует уменьшению отечности и снижению артериальной гипертензии, уменьшает интенсивность аллергических реакций и дерматозов, снижает костно-суставные боли;
- # является средством профилактики онкологических заболеваний;
- # рекомендуется в качестве профилактического и лечебного средства при болезнях желудочно-кишечного тракта, пищевода, печени, почек, мочевого пузыря;
- # снижает потребность больного сахарным диабетом в инсулине;
- # повышает активность ферментов тканевого дыхания;
- # снижает риск заболевания ишемической болезнью сердца;
- # обладает рядом других полезных для человека свойств.
ПРИБОР - Ph/ОВП/°C МЕТР - МОДЕЛЬ - Milwaukee pH58 Martini

Профессиональный прибор-анализатор кислотности pH, ОВП и температуры воды Milwaukee pH58 Martini (три прибора в одном корпусе) во влагозащищенном IP67 корпусе имеет большой двухуровневый экран для отображения уровня pH, ОВП и температуры воды (°C или °F).
Ph/ORP/°C метр Milwaukee pH58 Martini измеряет уровень кислотности растворов от -2 до 16 pH с шагом 0.01 pH, окислительно-восстановительный потенциал от -1000 mV до +1000 mV и одновременно отображает температуру воды от -5 to 60°C (от 23 до 140°F).
Для фиксации (запоминания) результатов измерений есть функция "Hold".
Прибор также оснащён автоматической термокомпенсацией и имеет широкий диапазон применения – от бытового до лабораторного и промышленного (тест питьевой воды, в аквариумах, исскуственных водоёмах, сточных водах).
Режим автоотключения в случае неиспользования тестера в течение 8 минут продлит срок службы элементов питания.
Сменный электрод легко удаляется и устанавливается.
Для этого нужно просто открутить пластиковое кольцо в верхней чаcти электрода.
Milwaukee pH58 Martini оснащён температурным сенсором, который обеспечивает быстрое время измерения, а близкое расположение к электроду гарантирует точность измерений.
ОПИСАНИЕ Ph/ОВП/°C метра модели Milwaukee pH58 Martini:
• Функция измерения уровня кислотности pH, ОВП и температуры воды
• Автоматическая калибровка по 2 точкам
• Диапазон измерения кислотности: -2 - 16 pH
• Диапазон измерения ОВП: ±1000 mV
• Диапазон измерения температуры: -5 - 60 °C (23-140 °F)
• Защитный колпачок для хранения электродов в растворе pH 4.01
• Влагозащитный корпус, выполненный по классу защиты IP67
• Функция автоотключения
• Функция Hold (удержание результатов измерения)
• Функция индикации разрядки аккумулятора
• LED (светодиодный) дисплей
• Калибровка в заводских условиях по 2 точкам с использованием буферных растворов (pH 4.01, 7.01, 10.01 или 4.01, 6.86, 9.18)
• В комплекте: pH 4.01 и pH 7.01 буферные растворы (ёмкости по 20 мл) для калибровки.
ХАРАКТЕРИСТИКИ:
• Диапазон измерения pH: -2 - 16 pH
• Дипазон измерения ОВП: ±1000 mV
• Диапазон измерения температуры: -5 - 60°C / 23 - 140°F
• Цена деления: 0.01pH, 1 mV, 0.1 °C/F
• Погрешность (@25°C) : ±0.05 pH, ±2 mV, ±0.5°C / ±1°F
• Автоматическая калибровка по двум точкам с выбором из 6-ти буферных типов (pH 4.01, 7.01, 10.01 или 4.01, 6.86, 9.18)
• Сменный электрод Mi58P
• Автоматическая компенсация температуры (ATC): -5 - 60°C / 23 - 140°F
• Питание: батареи 4 x 1.5V; IEC LR44, A76 в комплекте
• Продолжительность работы от комплекта батарей: свыше 250 часов непрерывного использования
• Класс защиты: IP67
• Размеры: 200 мм, диаметр 38 мм
• Вес: 100 г
ИНСТРУКЦИИ ПРОВЕДЕНИЯ ИЗМЕРЕНИЙ
Снимите защитный колпачок и опустите pH58 в раствор для хранения электродов (арт. MA9015) на 2 часа для активации нового электрода.
Включите pH58 нажатием кнопки ON/OFF.
Все используемые сегменты на LCD дисплееотобразятся на 1 секунду или на время нажатия кнопки.
Погрузите электрод в жидкость для проведения измерения и, слегка помешивая, дождитесь стабилизации показаний на дисплее прибора.
Выберите pH или ORP (mV) режим нажатием кнопки SET/HOLD.
Отображаемый уровень pH будет автоматически компенсирован с учётом температуры.
Значение ОВП (ORP) в mV будет отображен на LCD дисплее, а значение температуры - на дополнительном дисплее.
Для фиксирования результатов измерений на дисплее, нажмите кнопку SET/HOLD.
Значок "HOLD” появится на дополнительно дисплее и показания измерений запомнятся дисплее.
Нажмите на любую кнопку для возврата в режим измерений.
Для выключения pH58, нажмите кнопку ON/OFF.
Сигнал"OFF” появится на дополнительном дисплее.
ВАЖНО:
• Перед измерениями убедитесь в том, что pH58 калиброван (сигнал CAL присутствует на дисплее прибора).
• После использования всегда выключайте pH58 и промывайте электрод для уменьшения отложений.
Храните электрод во влажном состоянии, добавив несколько капель раствора для хранения (MA9015) или pH7 (M10007) в защитный колпачок.
Никогда не используйте дистиллированную или деионизированную воду для хранения электрода.
КАЛИБРОВКА
• Ваш pH58 имеет заводскую калибровку, но для получения наилучших результатов измерений рекомендуется периодически калибровать прибор.
Калибровка также необходима после замены электрода, после проведения измерений в агрессивных растворах и при высоких требованиях к точности измерений.
• Включите pH метр и выберите режим pH с помощью кнопки SET/HOLD.
• Нажмите и удерживайте кнопку ON/OFF/CAL пока сигнал "OFF” на вспомогательном дисплее заменится на "CAL”.
Отпустите кнопку.
• pH58 перейдёт в режим калибровки, отображая "pH 7.01 USE” (или "pH 6.86 USE” если выбраны растворы типа NIST).
• Для калибровки по одной точке, погрузите прибор в любой калибровочный раствор, напр. pH 4.01, 7.01 (6.86), 10.01 (9.18).
• pH58 автоматически определит значение калибровочного раствора.
Если не было обнаружено подходящего калибровочного раствора pH метр сохранит индикацию USE на 12 секунд, а после заменится на WRNG.
И наоборот, при обнаружении подходящего буферного раствора, его значение отобразится на основном дисплее, а на дополнительном - сигнал REC.
• При использовании pH 7.01 (или pH 6.86) нажмите кнопку SET для входа в режим калибровки и на дисплее появится сообщение "OK1”.
Настройка калибровки по первой точке сохранена и pH метр вернётся в режим измерений.
ДЛЯ ТОЧНОСТИ pH метра рекомендуется проводить калибровку по 2-м точкам.
• Для калибровки по 2-м точкам, опустите pH58 в pH 7.01 (или pH 6.86).
• После калибровки по первой точке, pH58 запросит второй калибровочный раствор и появится сообщение "pH 4.01 USE”.
• Промойте и затем опустите электрод во второй раствор (pH 4.01, 10.01 или 9.18).
• При обнаружении подходящего буферного раствора, его значение отобразится на основном дисплее, а на дополнительном - сигнал REC.
На дисплее появится сообщение "OK2”.
Настройка калибровки по второй точке сохранена и pH58 вернётся в режим измерений.
В противном случае pH метр отобразит сообщение WRNG.
ВНИМАНИЕ:
По окончании калибровки сигнал CAL на дисплее pH58 отключится.
• Для прекращения калибровки, и возврата к последним сохранѐнным настройкам нажмите кнопку ON/OFF.
Вспомогательный дисплей отобразит сигнал "ESC” на 1 секунду и затем вернется в режим измерений.
• Для сброса предыдущих настроек калибровки нажмите кнопку SET/HOLDпосле входа в режим калибровки и перед калибровкой по первой точке.
Дополнительный дисплей отобразит "CLR” на 1 секунду, pH метр вернётся к предустановленным значениям калибровки и сигнал CAL на дисплее выключится.
НАСТРОЙКИ
Режим настроек позволяет выбрать вариант отображения температуры (°C или °F) и тип буферных растворов pH для калибровки.
Для входа в режим настройки нажмите кнопку ON/OFF до замены на вспомогательном дисплее прибора сигнала "CAL” на "TEMP” и текущего режима отображения температуры (напр. TEMP °C).
Затем:
• Для выбора градусов C/F нажмите кнопку SET/HOLD затем нажмите кнопку ON/OFF один раз для выбора типов калибровочных растворов или дважды для возврата в режим измерений.
• Для смены типов калибровочных растворов: после установки режима отображения температуры, нажмите ON/OFF один раз и выберите ("pH 7.01 BUFF” или "pH 6.86 BUFF” для NIST) нажатием кнопки SET/HOLD.
Нажмите ON/OFF для возврата.
ЗАМЕНА ЭЛЕКТРОДА
• Снимите защитный колпачок и открутите пластиковое кольцо в верхней части электрода.
• Достаньте и замените на новый электрод марки MI58P.
• Перед закручиванием пластикового кольца убедитесь в наличии прокладки.
ЗАМЕНА БАТАРЕЕК
В случае необходимости замены элементов питания сигнал батарейки будет мигать на дисплее, сообщая о том, что осталось несколько часов их работы.
Прибор тажке оснащен функцией BEPS (Battery Error Prevention System), которая выключит его при слабых элементах питания во избежание неточных измерений.
Рекомендуется срочно заменить.
Для замены батареек, откройте отсек для элементов питания и замените все 4 батарейки 1,5V, обращая внимание на полярность установки.
При закрытии отсека убедитесь в наличии прокладки.
Замену элементов питания проводите в безопасном месте и при безопасных условиях.
Окисли́тельно-восстанови́тельные реа́кции, ОВР, редокс (от англ. redox ← reduction-oxidation — окисление-восстановление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Содержание
Описание
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление
Окисление - процесс отдачи электронов, с увеличением степени окисления.
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель + e − ↔ сопряжённый восстановитель.
Восстановление
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
восстановитель — e − ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Окислительно-восстановительная пара
Окислитель и его восстановленная форма, либо восстановитель и его окисленная форма составляет сопряжённую окислительно-восстановительную пару, а их взаимопревращения являются окислительно-восстановительными полуреакциями.
В любой окислительно-восстановительной реакции принимают участие две сопряжённые окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, т.е. восстановлением, другая — с отдачей электронов, т.е. окислением.
Виды окислительно-восстановительных реакций
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
Примеры
Окислительно-восстановительная реакция между водородом и фтором

Разделяется на две полуреакции:


Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:





Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:





Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями.
См. также
- Окислитель
- Восстановитель
- Электролиз
- Электрохимия
- Окислительно-восстановительные реакции в биохимии
Ссылки
Wikimedia Foundation . 2010 .
- Ил-96
- Тутмос IV
Смотреть что такое "Окислительно-восстановительные реакции" в других словарях:
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ — ОКИСЛИТЕЛЬНО ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ, химические реакции, сопровождающиеся переходом электронов от одного вещества (восстановителя) к другому (окислителю). Присоединение электронов называется восстановлением, отдача окислением. Окислительно… … Современная энциклопедия
окислительно-восстановительные реакции — – химические реакции, сопровождающиеся изменением степеней окисления химических элементов, входящих в состав реагентов. Словарь по аналитической химии [3] … Химические термины
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ — сопровождаются изменением степени окисления атомов, входящих в состав реагирующих веществ, напр.:HCl+5O3+3H2S+4O3 ??HCl 1+3H2S+6O4 вещество, в котором понижается степень окисления атома, т. е. он приобретает электроны (здесь Cl в HClO3),… … Большой Энциклопедический словарь
окислительно-восстановительные реакции — сопровождаются изменением степени окисления атомов, входящих в состав реагирующих веществ, например: . Вещество, в котором понижается степень окисления атома, то есть он приобретает электроны (здесь Cl в HClO3), называется окислителем; если… … Энциклопедический словарь
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ — (р ции окисления восстановления) происходят с изменением степени окисления атомов, входящих в состав реагирующих в в. При окислении в в степень окисления элементов возрастает, при восстановлении понижается. Первоначально окислением называли… … Химическая энциклопедия
Окислительно-восстановительные реакции — в организме, биохимические процессы, при которых происходит перенос электрона или атома водорода (иногда с сопровождающими его атомами или группами) от одной молекулы (окисляемой) к другой (восстанавливаемой). О. в. р. катализируются… … Большая советская энциклопедия
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ — хим. реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих в в. В во, в к ром понижается степень окисления атома, т. е. он приобретает электроны (здесь С1 в НСlO3), наз. окислителем; если повышается степень… … Естествознание. Энциклопедический словарь
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ — класс хим. реакций, осуществляющихся за счёт полного или частичного перехода электронов от одних атомов к другим. Отдача электронов наэ. окислением, присоединение электронов восстановлением. Простой пример О. в. р. восстановление меди из её… … Большой энциклопедический политехнический словарь
внутримолекулярные окислительно-восстановительные реакции — – окислительно восстановительные реакции, которые протекают, когда окисляющиеся и восстанавливающиеся атомы находятся в одном веществе. К данному типу относятся реакции диспропорционирования, реакции изомеризации. Общая химия : учебник / А. В.… … Химические термины
Окислительно-восстановительная реакция — Окислительно восстановительные реакции это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом окислителем и атомом… … Википедия
Учеными установлено, что процесс жизнедеятельности человеческого организма – это совокупность окислительно-восстановительных реакций [1]. Под окислительно-восстановительными реакциями в химии понимают процесс отдачи электронов окисляемого вещества и присоединения их к восстанавливаемым веществам.
При этом электрические потенциалы и того и другого вещества изменяются: вещество, которое окисляется, отдает свои электроны и приобретает положительный заряд называется восстановителем; вещество, которое восстанавливается, присоединяет электроны, получая отрицательный заряд, называется окислителем.
Разность электрических потенциалов между этими двумя веществами получила название окислительно-восстановительного потенциала (ОВП). Иными словами, окислительно-восстановительный потенциал – мера химической активности элементов или их соединений в обратимых химических процессах, которые связаны с изменением зарядов ионов в растворах.
ОВП также известен под названием редокс-потенциал, так как на английском языке обозначается как Reduction/Oxidation, обозначается латинскими буквами Eh и имеет размерность милливольт (мВ).
Таким образом, окислительно-восстановительный потенциал показывает, насколько активно отдаются электроны одного химического вещества и присоединяются другим.
Значение ОВП любого химического соединения тем больше, чем больше концентрация компонентов, отдающих свои электроны, по отношению к концентрации компонентов принимающих эти электроны.
При проведении специальных измерений, было установлено, что кислород является самым активным восстановителем и имеет высокий электрический потенциал, а водород – напротив, обладает низким электрическим потенциалом и является ярким представителем элементов с большой восстановительной способностью.
Как известно, вода – сложное химическое соединение, состоящее из атомов водорода и кислорода, а также других химических элементов, содержащихся в воде в виде примесей.
Все эти примеси также обладают различными электрическими потенциалами и выступают менее активными окислителями либо восстановителями.
Значение ОВП природной воды находится в пределах от -400 до +700 мВ, столь широкий диапазон значений ОВП объясняется наличием в воде различных окислительно-восстановительных процессов.
Внутренняя среда здорового организма человека
Вода природная в местах проживания долгожителей
Оптимальная среда для подвижности сперматозоидов
Оптимальная среда для роста полезных бактерий (кишечная палочка, бифидобактерии)
Значение показателя ОВП в некоторой степени характеризует химический состав воды.
Значение окислительно-восстановительного потенциала веществ часто используется в биохимии, где оно выражается в условных единицах rH (от английского reduction Hydrogenii).
Для перевода единиц rH в милливольты разработана формула Нернста:
где Еh – окислительно-восстановительный потенциал, мВ;
рН – показатель кислотно-щелочного равновесия.
Также вычислить значение rH можно, используя специальную диаграмму:

Данные диаграммы показывают, что значение 0 имеет чистый водород, а значение 42 имеет чистый кислород, нормальной среде соответствует соответствует значение 28.
Необходимо установить связь между показателем кислотно-щелочного равновесия и окислительно-восстановительного потенциалом. Доказано, что чем выше значение rH, тем ниже показатель рН, то есть при окислении показатель кислотно-щелочного равновесия уменьшается, а при восстановлении, напротив, увеличивается.
В результате окислительно-восстановительных реакций, которые постоянно протекают в организме человека, высвобождается энергия, которая впоследствии используется для поддержания гомеостаза.
Гомеостаз (в переводе с древне греческого гомео означает одинаковый, подобный, а стаз – состояние) – это способность организма сохранять относительное динамическое постоянство своего внутреннего состояния путем проведения скоординированных реакций. Другими словами, энергия, полученная в ходе окислительно-восстановительных реакций, расходуется для обеспечения процессов жизнедеятельности организма человека, а также для регенерации его клеток.
Учеными была проведена серия экспериментов, направленная на установление величины окислительно-восстановительного потенциала человеческого организма методами электрохимии.
Для измерения был использован платиновый электрод, а для сравнения взяли хлорсеребряный электрон. В ходе эксперимента было выяснено, что в нормальном состоянии окислительно-восстановительный потенциал человека колеблется от -100 до -200 милливольт.
Таким же способом был измерен и окислительно-восстановительный потенциал употребляемой нами питьевой воды, при это было выявлено, что вода, напротив, всегда имеет положительный ОВП в пределах значений от +100мВ до +400 мВ.
При этом, не имеет значения, какая вода используется для питья или в пищу: водопроводная, купленная в магазинах в бутылках, очищенная при помощи различных фильтров, или с использованием установок обратного осмоса. То есть, проведенные измерения ОВП человека и воды, позволяют сделать вывод, что активность электронов питьевой воды значительно уступает активности электронов человеческого организма. От активности присутствующих в человеческом организме электронов зависят все процессы обеспечивающие его жизнедеятельность. Известно, что все имеющие биологическое значение системы, которые отвечают за накопление и потребление энергии, репликацию и передачу различных наследственных признаков, а также системы организма, вырабатывающие различные ферменты, содержат определенные молекулярные структуры с разделенными зарядами, между которыми образуется напряженность электрического поля в пределах 104-106 В/см. Эти поля определяют передачу зарядов в биологических системах, что в свою очередь обуславливает осуществления выбора и автоконтроля на некоторых стадиях сложнейших биохимических превращений. Активность электронов, которую и выражает окислительно-восстановительный потенциал-ОВП, оказывает большое влияние на функциональные свойства электроактивных компонентов биологических систем.
Из-за разности ОВП человеческого организма и питьевой воды, при попадании воды в ткани и клетки организма, происходит окислительная реакция, в результате которой клетки изнашиваются и разрушаются.
В условиях равновесия значение ОВП определенным образом характеризует водную среду, и его величина позволяет делать некоторые общие выводы о химическом составе воды. В зависимости от значения ОВП различают несколько основных ситуаций, встречающихся в природных водах:
Окислительная:
Характеризуется значениями ОВП > + (100 - 150) мВ, присутствием в воде свободного кислорода, а также целого ряда элементов в высшей форме своей валентности (Fe 3+ , Mo 6+ , As 5- , V 5+ , U 6+ , Sr 4+ , Cu 2+ , Pb 2+ ). Такая ситуация, наиболее часто встречается в поверхностных и водах.
Вода, обладающая ярко выраженными кислотными свойствами называется «мертвой» водой. Ее ОВП может достигать +800+1000 мВ. Вода с положительными значениями ОВП называется «мертвой» водой и является сильнейшим окислителем, чем и объясняются ее дезинфецирующие и бактерицидные свойства.
«Мертвая» вода используется для лечения и профилактики простудных заболеваний, ангины, гриппа. «Мертвая» вода имеет широкий спектр воздействия на организм: снижает кровяное давление, улучшает сон, успокаивает нервную систему. «Мертвая» вода растворяет камни на зубах, прекращает кровотечение десен, помогает при лечении пародонтоза. Снижает боли в суставах, помогает при расстройствах кишечника.
Переходная окислительно-восстановительная:
Определяется величинами ОВП от 0 до + 100 мВ, неустойчивым геохимическим режимом и переменным содержанием сероводорода и кислорода. В этих условиях протекает как слабое окисление, так и слабое восстановление целого ряда металлов.
Восстановительная:
Характеризуется значениями ОВП 2+ , Mn 2+ , Mo 4+ , V 4+ , U 4+ ), а также сероводород. Это типично для подземных горных источников, талой воды.
Вода с отрицательными значениями ОВП получила название «живой» воды. «Живая» вода (щелочная) является отличным стимулятором, тонизатором, источником энергии, придает бодрость, стимулирует регенерацию клеток, улучшает обмен веществ, нормализует кровяное давление. «Живая» вода способна заживлять раны, ожоги, язвы (в т.ч. желудка и 12- перстной кишки). «Живая» вода используется для лечения и профилактики остеохондроза, атеросклероза, аденомы предстательной железы, полиартрита и других заболеваний.
Окислительно-восстановительный потенциал также зависит от температуры, количества растворённого в воде кислорода и значения рН водной среды.
Обычно ОВП организма человека колеблется от -70 мВ до -200 мВ, а ОВП обычной питьевой воды практически всегда значительно выше нуля:
водопроводная вода от +80 мВ до +300 мВ;
вода в пластиковых бутылках от +100 мВ до +300 мВ;
колодезная, родниковая вода от +120 мВ до +300 мВ.
Отрицательный ОВП природной воды - явление не частое и характерно для вод подземных горных источников, где присутствуют металлы низких степеней валентности (Fe 2+ , Mn 2+ , Mo 4+ , V 4+ , U 4+ ), а также сероводород и талой воды.
Cчитается, что отрицательный ОВП питьевой воды дает энергетическую зарядку клеткам, органам, системам. Электрическая энергия клеточных мембран не расходуется на коррекцию активности электронов воды и вода тотчас же усваивается, т.к. обладает биологической совместимостью по этому параметру. Именно поэтому питьевая вода с отрицательным ОВП - идеальный антиоксидант.
Вода с отрицательным окислительно-восстановительным потенциалом (ОВП) и обладающая восстановительными свойствами обычно называется "активированной". Активированной называется также вода с большим положительным ОВП, обладающая заметно выраженными окислительными свойствами. Основной технологией получения таких видов воды является электролиз. Католит и анолит обладают соответственно отрицательным и большим положительным ОВП.
Можно ли уменьшить или замедлить такое клеточное разрушение организма человека? Это возможно, при условии, что вода, которая поступает в организм, будет иметь свойства внутренней среды, а именно окислительно-восстановительный потенциал воды должен иметь значения соответствующие значениям ОВП человеческого организма.
Чем больше разность ОВП человека и воды, тем больше требуется затрат клеточной энергии для достижения соответствия воды и внутренней среды организма. При условии, что ОВП питьевой воды соответствует ОВП внутренней среды человека, вода усваивается клетками организма без использования электрической энергии мембран клеток. В случае, если окислительно-восстановительные потенциал воды имеет большее отрицательное значение, нежели ОВП внутренней среды человека, то при ее усвоении выделяется энергия, расходуемая клетками в качестве энергетического запаса антиоксидантной защиты, которая является основным щитом организма от отрицательного влияния, которое оказывает на него окружающая внешняя среда .
Чтобы понять, в чем заключается польза АО, надо ответить на несколько вопросов. Что такое АО и какова их химическая природа? Что такое свободные радикалы (СР) и откуда они берутся? В чем заключается вред СР, с которыми борются АО? Каков химизм их взаимодействия?
АО – вещества, способные тормозить окисление органических соединений. Окисление – сложный процесс, идущий по радикально-цепному механизму, который может быть представлен следующим образом: свободный радикал R•, образовавшийся, например, из жирной кислоты, под влиянием ряда факторов, взаимодействуя с кислородом, образует пероксид-радикал, способный к взаимодействию с другой ненасыщенной жирной кислотой. При этом образуется новый СР и гидропероксид. Реакции, вначале медленно протекающие, по мере накопления гидропероксидов и их распада с образованием новых радикалов резко ускоряются.
Введение АО приводит к образованию новых радикалов А•, отличающихся значительно большей стабильностью, чем радикалы R•, что приводит к замедлению реакции, а при определенных условиях к ее резкому торможению.
СР – это атомные или молекулярные частицы, способные находиться в несвязанном состоянии и содержащие один или несколько неспаренных электронов. Поскольку электрон один занимает атомную или молекулярную орбиталь, то эти соединения обладают повышенной химической активностью, т.к. им необходимо «найти» еще один электрон для восполнения равновесия. И они находят их, вырывая из органических соединений, разрушая при этом их структуру, нарушая их функции и образуя при этом множество других СР.
Наиболее типичные и часто встречающиеся СР представляют собой активные формы кислорода, активные формы азота, продукты окисления липидов, к которым относятся: синглетный кислород (1О2), супероксидный анион-радикал (О2•-), гидроперекисный радикал (НО2•), гидроксильный радикал (НО•), свободный алкильный радикал (R•), алкоксильный радикал (RO•), пероксирадикал (RОO•), нитроксид (NО•), никтроксильный радикал (NО2•), пероксинитрит (ОNОО-), липидный алкильный радикал (L•), липидный алкоксильный радикал (LO•), липидный пероксирадикал (LOO•) и ряд других 9.
Надо сразу отметить, что не все АО действуют одинаково и полезны в любой концентрации, и не все СР одинаково опасны для живых клеток [1]. Так, например, показано, что аскорбиновая кислота (витамин С) выступает в роли АО лишь при низких концентрациях, а при высоких концентрациях она является уже прооксидантом, т.е. способствует накоплению СР в организме [2]. Теория и практика лечения раковых заболеваний Лайнуса Полинга высокими концентрациями витамина С (в сотни раз превышающими физиологические потребности организма человека) [3] связана, по-видимому, не с анти-, а с прооксидантными свойствами витамина, под действием которого СР накапливаются в раковых клетках и затем разрушают их.
Еще 2 млрд. лет назад в атмосфере Земли практически не было свободного молекулярного кислорода. По мере его накопления благодаря фотосинтезирующим растениям начали появляться биологические виды, использующие кислород для окисления потребляемой ими пищи (органических соединений) с целью извлечения энергии. Эти процессы окисления с образованием СР (и энергии, необходимой для функционирования организма) осуществляются под строгим контролем ферментных систем. Образующиеся в этом случае СР не опасны, т.к. в итоге нейтрализуются.
Однако окружающий нас кислород пытается окислить нашу органику в силу своей химической активности с образованием множества различных СР. Организм борется с этим, создавая АО барьер. Соответственно, выживание организмов в среде кислорода зависит от предотвращения окислительных повреждений в организме.
Для снижения интенсивности свободнорадикальных процессов и уровня окислительного стресса в живых организмах в ходе эволюции возникла особая АО система, обеспечивающая окислительный (или антиоксидантный) гомеостаз, которая состоит из низко- и высокомолекулярных соединений. К низкомолекулярным соединениям, взаимодействующим с диоксидными, гидроксильными и алкилдиоксильными радикалами и образующим малоактивные продукты относятся стероиды, убихиноны, фосфолипиды, некоторые аминокислоты, полиамины, мочевина, мочевая кислота, глутатион, аскорбат, билирубин, токоферолы, каротиноиды, полифенолы и др.. К высокомолекулярным соединениям относятся антиоксидантные ферменты (супероксиддисмутаза, каталаза, пероксидаза и др.), утилизирующие пероксид водорода в организме, и некоторые белки (альбумин, трансферрин и ферритин), способные связывать ионы Fe и Cu, являющиеся катализаторами свободнорадикальных процессов. При различных отклонениях от нормального функционирования организма может развиться дисбаланс между интенсивностью СР процессов и функциональной активностью АО системы. Указанный дисбаланс вызывает окислительное повреждение биомолекул, клеток и тканей и, в конечном итоге, гибель организма, а также играет ключевую роль в развитии большого количества опасных заболеваний, включая онкологические.
Таким образом, в основе процессов старения и окисления организма находится антиоксидантная активность (АОА) употребляемой человеком воды, а также других напитков и продуктов.
В этой связи, целью предложенной работы является определение величины окислительно-восстановительного потенциала и расчет антиоксидантной активности воды и некоторых напитков.
Освоение методики определения окислительно-восстановительного потенциала и основ электрохимии;
Овладение навыками работы с вольтметром – прибором для измерения ОВП;
Изучение методики расчета антиокислительной активности АОА по методу Х.Брайниной.
Читайте также:









