Миелоз пульпы селезенки это
Опубликовано: 30.04.2024
Европейская клиника
Хронический миелолейкоз — это злокачественное заболевание крови, при котором происходит избыточное образование и нарушение созревания гранулоцитов в костном мозге. Уникальной особенностью данного вида лейкоза является наличие в опухолевых клеток специфического маркера — филадельфийской хромосомы. Она образуется в результате транслокации t(9;22), при которой один фрагмент 22 хромосомы меняется местами с фрагментом девятой хромосомы. В итоге образуется химерный ген, который нарушает процесс деления и созревания клеток миелоидного ряда.
- Причины развития хронического миелолейкоза
- Патогенез хронического миелолейкоза
- Стадии хронического миелолейкоза
- Симптомы и признаки хронического миелолейкоза
- Диагностика хронического миелолейкоза
- Лечение хронического миелолейкоза
- Прогноз и профилактика хронического миелолейкоза
Причины развития хронического миелолейкоза
Причиной развития хронического миелолейкоза является та самая мутация, которая приводит к образованию филадельфийской хромосомы. Ее обнаруживают у 90-95% больных. Но вот что становится причиной ее образования до сих пор неизвестно.
Из эпидемиологических данных известно, что заболевание чаще развивается у пожилых людей, преимущественно мужчин. Дети страдают крайне редко, на их долю приходится около 2% всех случаев хронического миелолейкоза.
Патогенез хронического миелолейкоза
Филадельфийская хромосома является результатом взаимной транслокации между 9 и 22 хромосомами. При этом онкоген ABL из 9 хромосомы переносится на 22 хромосому и присоединяется к гену BCR. В результате образуется гибридный BCR-ABL ген, который регулирует синтез особого онкогенного белка — тирозинкиназы bcr-abl. Этот онкопротеин нарушает процесс клеточного деления, защищает опухолевые клетки от запрограммированной гибели (апоптоза) и нарушает их сцепление со стромой костного мозга, благодаря чему недозревшие клетки выходят в кровяное русло.
Чаще всего хронический миелолейкоз развивается в результате мутации в плюрипотентной гемопоэтической стволовой клетке, которая располагается в костном мозге, но есть случаи, когда первичный очаг находится в печени или селезенке.
При хроническом миелолейкозе в основном преобладает патология гранулоцитарного ростка, но могут страдать все линии гемопоэза — эритроцитарный росток, моноциты и др. Здоровые стволовые клетки сохраняются и могут давать начало новому кроветворению после проведения химиотерапии.
Стадии хронического миелолейкоза
В течении хронического миелолейкоза выделяют 4 стадии, которые отражают прогрессирование патологии. При этом заболевание может быть выявлено на любой из них.
Хроническая или доклиническая стадия — не имеет клинических симптомов, диагноз можно заподозрить по общему анализу крови, который пациенты могут сдавать либо в рамках диспансеризации, либо по поводу диагностики другого заболевания. В большинстве случаев хронический миелолейкоз выявляется именно на этой стадии.
Фаза акселерации, или стадия прогрессирования. В этот период нарастает количество опухолевых гранулоцитарных клеток, появляются различные симптомы, например, слабость или боли в костях. Объективно отмечается увеличение количества бластов в крови или костном мозге до 15-29%, увеличивается количество базофилов (более 20%), обнаруживается тромбоцитопения или тромбоцитоз (более 1000×10 9 ).
Бластный криз — это фаза, во время которой происходит резкое увеличение количества бластных клеток (больше 30%) и болезнь по своему течению напоминает агрессивный острый лейкоз.
Пациент при этом находится в тяжелом состоянии. Отмечается повышение температуры, упорные инфекции, кровотечения, лейкозные поражения кожи. На этой стадии лейкоз с трудом поддается терапии.
Фазу хронического миелолейкоза обязательно оценивают при постановке диагноза и далее перепроверяют при прогрессировании патологии и необходимости смены лечения.
Симптомы и признаки хронического миелолейкоза
Симптоматика хронического миелолейкоза характеризуется многообразием клинических проявлений и зависит от агрессивности течения и стадии заболевания. В целом может иметься несколько синдромов:
- Синдром опухолевой интоксикации. Проявляется неадекватной текущему состоянию слабостью, потерей веса, снижением аппетита. Может быть повышение температуры, повышенная потливость, зуд кожи, боли в костях.
- Синдром опухолевой пролиферации. Развивается при активном увеличении количества злокачественных клеток, инфильтрирующих печень и селезенку. При этом пациенты отмечают боль и тяжесть в левом боку.
- Анемический синдром — развивается при снижении количества эритроцитов и уровня гемоглобина. Проявляется слабостью, одышкой, повышенной утомляемостью при рутинных физических нагрузках. Может наблюдаться снижение давления, бледность кожи и слизистых, головокружение, тахикардия.
- Нарушения со стороны кровесвертывающей системы — тромбозы и геморрагии (кровотечения). Причиной тромбозов чаще всего оказывается тромбоцитоз (повышение уровня тромбоцитов выше 1000×10 9 /л). При этом могут возникать тромбофлебиты, инфаркты, инсульты. Геморрагические проявления характеризуются увеличением времени кровотечения после травмы, а также образованием петехиальной геморрагической сыпи. Развиваются они на фоне критического снижения уровня тромбоцитов.
Диагностика хронического миелолейкоза
В большинстве случаев хронический миелолейкоз является случайной находкой, которая обнаруживается при обследовании по другому поводу. Заподозрить его можно по общему анализу крови, в частности по увеличению количества лейкоцитов и преобладанию в формуле гранулоцитарного ростка кроветворения. При этом может увеличиваться не только количество нейтрофилов, но и базофилов с эозинофилами. Может быть умеренная анемия или отклонения в количестве тромбоцитов.
Если врач подозревает хронический миелолейкоз, пациента направляют на дальнейшее обследование — пункцию и биопсию костного мозга. Для подтверждения диагноза необходимо проводить стандартное цитогенетическое исследование костного мозга на предмет наличия филадельфийской хромосомы. Исследуется не менее 20 метафаз. При невозможности проведения цитогенетики, прибегают к флюоресцентной in situ гибридизации, с помощью которой выявляют химерный ген. Также определяется экспрессия химерного гена в клетках периферической крови посредством ПЦР. Если типичный транскрипт не обнаруживается, а при этом есть клинико-гематологические признаки хронического миелолейкоза, показано определение более редких мутаций — BCR-ABLp190, р230.

В фазе бластного криза проводят иммунофенотипирование бластных клеток, цитологическое и биохимическое исследование спинномозговой жидкости. При обнаружении хронического миелолейкоза в фазе активации или бластного криза, поиск филадельфийской хромосомы может осуществляться посредством секвенирования генетического материала клеток крови.
Лечение хронического миелолейкоза
На начальном этапе, до получения цитогенетического подтверждения диагноза (как мы уже знаем, хронический миелолейкоз выставляется при наличии филадельфийской хромосомы), назначается симптоматическая терапия гидроксимочевиной. Ее целью является снижение общего уровня лейкоцитов и тромбоцитов. При непереносимости препарата или недостаточном снижении уровня тромбоцитов может применяться анагрелид. Если имеются признаки лейкостаза (энцефалопатия, зрительные нарушения, нарушения работы почек), проводится лейкаферез.
После цитогенетического подтверждения диагноза, назначается специфическая противоопухолевая терапия. Главными препаратами являются ингибиторы тирозинкиназ (ИТК). Дозировка подбирается в зависимости от уровня лейкоцитов. На начальном этапе для профилактики синдрома лизиса опухоли необходима усиленная гидратация (дополнительное введение жидкости в объеме 2-2,5 л/м 2 , если нет противопоказаний со стороны сердечно-сосудистой системы) и назначение аллопуринола.
Целью специфического лечения хронического миелолейкоза является подавление опухолевого клона клеток, снижение риска прогрессирования патологии и продление жизни пациента до значений, сопоставимых с общепопуляционными показателями. С внедрением в практику ИТК эти задачи стали вполне выполнимы и не только позволили повысить общую выживаемость таких больных в несколько раз, но и оказаться от пожизненного приема препаратов и перехода под динамическое наблюдение у пациентов с хорошим молекулярным ответом опухоли.
В настоящее время согласно принятым протоколам лечения, ИТК должны назначаться всем больным с впервые выявленным хроническим миелолейкозом. В основе механизма их действия лежит блокада АТФ-связывающего кармана патологической молекулы BCR-ABL, что лишает этот белок тирозинкиназной активности, которая стимулирует избыточное деление опухолевых клеток. При постоянном приеме ИТК, опухолевый клон подвергается редукции, что дает возможность восстановлению нормального кроветворения.
В России для терапии первой линии зарегистрированы следующие препараты из группы ИТК:
- иматиниб,
- нилотиниб,
- дазатиниб.
Иматиниб
Иматиниб обладает избирательной активностью в отношении BCR-ABL тирозинкиназы и некоторых других тирозинкиназ. Назначается длительными курсами и должен приниматься ежедневно. Первоначальная дозировка составляет 400 мг в сутки при хронической фазе миелолейкоза, и 600 мг/сут при фазе акселерации или бластном кризе. Дозировка не зависит от роста, пола и массы тела пациента. Препарат выпускается в таблетированной форме или капсулах. Может применяться в амбулаторных условиях. При неудовлетворительном результате терапии, дозировка может быть увеличена, при развитии токсических осложнений — снижена.
Нилотиниб
Нилотиниб — высокоселективный ингибитор BCR-ABL тирозинкиназы. Был разработан на основе молекулы иматиниба и модифицирван для увеличения сродства к BCR-ABL тирозинкиназой. Выпускается в капсулах. Дозировка при терапии хронической фазы составляет 600 мг/сут, при терапии фазы акселерации — 800 мг/сут. Препарат принимают 2 раза в сутки с интервалом в 12 часов строго натощак, поскольку еда увеличивает биодоступность препарата, что повышает его концентрацию в плазме и может спровоцировать развитие токсических осложнений. При недостаточном терапевтическом эффекте в лечении хронической фазы, возможно увеличение дозировки до 800 мг/сутки. При развитии осложнений, дозу снижают.
Дазатиниб
Дазатиниб обладает активностью ко многим тирозинкиназам, в том числе и к мутантной BCR-ABL. Проникает через гематоэнцефалический барьер. Выпускается в формах для перорального применения. Рекомендуемая дозировка составляет 100 мг/сутки для хронической фазы и 140 мг/сут для фазы акселерации и бластного криза. При недостаточной эффективности терапии хронической фазы возможно увеличение дозировки до 140 мг/сут. При развитии токсических осложнений ее снижают до 80 мг/сутки.

Босутиниб
Босутиниб — относительно новый препарат, в России зарегистрирован в 2014 году и применяется для терапии второй и последующих линий при непереносимости или неэффективности вышеперечисленных препаратов. Стандартная суточная доза составляет 500 мг, при необходимости может быть увеличена до 600 мг.
Выбор препарата первой линии проводится индивидуально для каждого пациента. При этом учитывается фаза лейкоза, чувствительность опухолевого клона с отдельными мутациями, профиль токсичности каждого препарата и наличие у пациента сопутствующих заболеваний.
Определение спектра мутаций проводится при манифестации патологии с фазу акселерации или бластного криза, либо при неэффективности терапии выбранным препаратом и необходимости смены препарата, поскольку здесь есть вероятность возникновения резистентных клонов. Например, мутации F317L/V, T315A, V299L обуславливают низкую чувствительность к дазатинибу, поэтому его меняют на нилотиниб. Мутации Y253H, E255K/V, F359V/C, наоборот, делают опухолевые клетки резистентными к нилотинибу, поэтому таким пациентам показан дазатиниб.
Мутации E255K/V, G250E, V299L обуславливают устойчивость к босутинибу. Наличие мутации Т3151 определяет устойчивость ко всем видам ИТК, поэтому таким пациентам рекомендуется аллогенная трансплантация гемопоэтических стволовых клеток. Также возможен вариант терапии понатинибом, но он пока не зарегистрирован в России.
Эффект терапии первой линии может быть отнесен к одной из трех групп:
- Оптимальный ответ. Это хороший результат, который позволяет надеяться на длительный период безрецидивной выживаемости (7-8 и более лет). Критерием достижения оптимального ответа является полный гематологический ответ в течение 3 месяцев, полный цитогенетический ответ в течение 6 месяцев и большой молекулярный ответ в течение 12-18 месяцев.
- Предупреждение. При наличии предупредительных факторов требуется тщательный мониторинг состояния больного и готовность к смене режима лечения. Факторами предупреждения является группа высокого риска хронического миелолейкоза, увеличение более, чем в 10 раз уровня транскрипции мутантного гена, наличие дополнительных хромосомных аномалий в клетках с филадельфийской хромосомой.
- Неудача терапии. Сюда относят прогрессирование заболевания, возникновение новыхмутаций, появление дополнительных хромосомных аномалий в клетках с филадельфийской хромосомой. Требуется смена терапии.
Другие методы лечения хронического миелолейкоза
Трансплантация донорских стволовых клеток показана пациентам с неэффективностью терапии второй линии и пациентам с мутацией T315I. Пациентам с непереносимостью ИТК и невозможностью проведения трансплантации возможно лечение с помощью гидроксимочевины, интерферонов и цитостатиков.
Прогноз и профилактика хронического миелолейкоза
Специфических методов профилактики не существует, поскольку неизвестны причины, из-за которых образуются мутации, вызывающие хронический миелолейкоз. Что касается прогноза, то здесь все зависит от возраста больного, ответа на лечение и возможности проведения аллогенной трансплантации. В целом ситуация довольно благоприятная и позволяет надеяться на продолжительность жизни, сопоставимую с общепопуляционными показателями. У некоторых больных возможно достижение стойкой ремиссии и отказ от пожизненного приема ИТК с регулярным динамическим наблюдением.
В Европейской клинике лечение миелолейкоза соответствует всем современным лечебным протоколам. В сложных случаях, решение принимает консилиум специалистов, а при достижении ремиссии, мы особое внимание уделяем регулярному наблюдению пациента, что также позволяет улучшать результаты лечения.
Часть третья – Селезнка
Селезенка (splen, lien) — периферический и самый крупный орган иммунной системы, располагающийся по ходу кровеносных сосудов. К функциям селезенки относятся:
- - участие в формировании гуморального и клеточного иммунитета, задержка антигенов, циркулирующих в крови;
- - элиминация из кровотока и, затем, разрушение старых и поврежденных эритроцитов и тромбоцитов, - «селезенка – кладбище эритроцитов»;
- - депонирование крови и накопление тромбоцитов (до 1/3 общего их числа в организме);
- - в эмбриональном периоде – кроветворная функция.
В селезенке происходят антигензависимая пролиферация и дифференцировка Т- и В-лимфоцитов и образование антител, а также выработка веществ, угнетающих эритропоэз в красном костном мозге.
Развитие. У человека селезенка закладывается на 5-й неделе эмбрионального периода развития в толще мезенхимы дорсальной брыжейки. В начале развития селезенка представляет собой плотное скопление мезенхимных клеток, пронизанное первичными кровеносными сосудами. В дальнейшем часть клеток дифференцируется в ретикулярную ткань, которая заселяется стволовыми клетками. На 7—8-й неделе развития в селезенке появляются макрофаги. На 12-й неделе развития селезенки впервые появляются В-лимфоциты с иммуноглобулиновыми рецепторами. Процессы миелопоэза в селезенке человека достигают максимального развития на 5-м месяце внутриутробного периода, после чего активность их снижается и к моменту рождения прекращается совсем. Основную функцию миелопоэза к этому времени выполняет красный костный мозг. Процессы лимфоцитопоэза в селезенке к моменту рождения, наоборот, усиливаются.
На 3-м месяце эмбрионального развития в сосудистом русле селезенки появляются широкие венозные синусы, разделяющие ее на островки. Вначале островки кроветворных клеток располагаются равномерно вокруг артерии (Т-зона), а на 5-м месяце начинается концентрация лимфоцитов и макрофагов сбоку от нее (В-зона). К этому времени популяция В-лимфоцитов, выявляемая при помощи иммунологических методов, примерно в 3 раза превышает популяцию Т-лимфоцитов. Одновременно с развитием узелков происходит формирование красной пульпы, которая становится морфологически различимой на 6-м месяце внутриутробного развития.
Строение
Селезенка покрыта соединительнотканной капсулой и брюшиной (мезотелием). Капсула состоит из плотной волокнистой соединительной ткани, содержащей фибробласты и многочисленные коллагеновые и эластические волокна. Между волокнами залегает небольшое количество гладких мышечных клеток.
Внутрь органа от капсулы отходят перекладины — трабекулы селезенки, которые в глубоких частях органа анастомозируют между собой. Капсула и трабекулы в селезенке человека занимают примерно 5—7 % от общего объема органа и составляют его опорно-сократительный аппарат. В трабекулах селезенки человека сравнительно немного гладких мышечных клеток. Эластические волокна в трабекулах более многочисленны, чем в капсуле.
Строма органа представлена ретикулярными клетками и ретикулярными волокнами, содержащими коллаген III и IV типов.
Паренхима (или пульпа) селезенки включает два отдела с разными функциями: белая пульпа (pulpa lienis alba) и красная пульпа (pulpa lienis rubra).
Строение селезенки и соотношение между белой и красной пульпой могут изменяться в зависимости от функционального состояния органа.
Белая пульпа селезенки
Белая пульпа селезенки представлена лимфоидной тканью, расположенной в адвентиции артерий в виде шаровидных скоплений, или узелков, и лимфатических периартериальных влагалищ. В целом они составляют примерно 1/5 органа.
Лимфатические узелки селезенки (фолликулы, или мальпигиевы тельца; lymphonoduli splenici) 0,3—0,5мм в диаметре представляют собой скопления Т- и В-лимфоцитов, плазмоцитов и макрофагов в петлях ретикулярной ткани (дендритных клеток), окруженные капсулой из уплощенных ретикулярных клеток. Через лимфатический узелок проходит, обычно эксцентрично, центральная артерия (a. centralis), от которой отходят радиально капилляры.
Лимфатические узелки селезенки (как и лимфоузлов) – являются B-зависимой зоной белой пульпы селезенки. В лимфатических узелках различают 4 нечетко разграниченные зоны: периартериальную, центр размножения, мантийную и краевую, или маргинальную, зону.
Периартериальная зона занимает небольшой участок узелка около центральной артерии и является продолжением периартериального влагалища (т.е. образована главным образом из Т-лимфоцитов, попадающих сюда через гемокапилляры, отходящие от артерии лимфатического узелка). Субмикроскопические отростки интердигитирующих клеток вытягиваются на значительное расстояние между окружающими их лимфоцитами и плотно с ними контактируют. Полагают, что эти клетки адсорбируют антигены, поступающие сюда с кровотоком, и передают Т-лимфоцитам информацию о состоянии микроокружения, стимулируя их бласт-трансформацию и пролиферацию. В течение 2—3 сут активированные Т-лимфоциты остаются в этой зоне и размножаются. В дальнейшем они мигрируют из периартериальной зоны в синусы краевой зоны через ге-мокапилляры. Тем же путем попадают в селезенку и В-лимфоциты. Причина заселения Т- и В-лимфоцитами «своих» зон недостаточно ясна. В функциональном отношении периартериальная зона является аналогом паракортикальной тимусзависимой зоны лимфатических узлов.
Центр размножения, или герминативный центр узелка, состоит из ретикулярных клеток и пролиферирующих В-лимфобластов, дифференцирующихся антитело-образующих плазматических клеток. Кроме того, здесь нередко можно обнаружить скопления макрофагов с фагоцитированными лимфоцитами или их фрагментами в виде хромофильных телец и дендритные клетки. В этих случаях центральная часть узелка выглядит светлой (т.н. «реактивный центр»).
Периферия лимфатического узелка - мантийная зона - окружает периартериальную зону и центр размножения, состоит главным образом из плотно расположенных малых В-лимфоцитов и небольшого количества Т-лимфоцитов, а также содержит плазмоциты и макрофаги. Прилегая плотно друг к другу, клетки образуют как бы корону, расслоенную циркулярно направленными толстыми ретикулярными волокнами.
Периартериальные лимфатические влагалища (ПАЛВ, vagina periarterialis lymphatica) представляют собою вытянутые по ходу пульпарной артерии скопления лимфоидной ткани. Периартериальные лимфатические влагалища являются Т-зависимой зоной селезенки.
Краевая, или маргинальная, зона узелков селезенки представляет собой переходную область между белой и красной пульпой шириной около 100 мкм. Она как бы окружает лимфатические узелки и периартериальные лимфатические влагалища, состоит из Т- и В-лимфоцитов и единичных макрофагов, окружена краевыми, или маргинальными, синусоидными сосудами с щелевидными порами в стенке.
Антигены, приносимые кровью, задерживаются в маргинальной зоне и красной пульпе. Далее они переносятся макрофагами на поверхность антигенпредставляющих клеток (дендритных и интердигитирующих) белой пульпы. Лимфоциты из кровотока оседают в основном в периартериальной зоне (Т-лимфоциты) и в лимфоидных узелках (В-лимфоциты). При первичном иммунном ответе продуцирующие антитела клетки появляются сначала в эллипсоидных муфтах, а затем в красной пульпе. При вторичном иммунном ответе формируются центры размножения, где образуются клоны В-лимфоцитов и клетки памяти. Дифференцировка В-лимфоцитов в плазмоциты завершается в красной пульпе. Независимо от вида антигена и способа его введения накопление лимфоцитов в селезенке происходит не столько за счет их пролиферации, сколько за счет притока уже стимулированных антигеном клеток.
Красная пульпа селезенки
Красная пульпа селезенки включает венозные синусы и пульпарные тяжи.
Пульпарные тяжи. Часть красной пульпы, расположенная между синусами, называется селезеночными, или пульпарными, тяжами (chordae splenicae) Бильрота. Это форменные элементы крови, макрофаги, плазматические клетки лежащие в петлях ретикулярной соединительной ткани. Здесь по аналогии с мозговыми тяжами лимфатических узлов заканчивают свою дифференцировку и секретируют антитела плазмоциты, предшественники которых перемещаются сюда из белой пульпы. В пульпарных тяжах встречаются скопления В- и Т-лимфоцитов, которые могут формировать новые узелки белой пульпы. В красной пульпе задерживаются моноциты, которые дифференцируются в макрофаги.
Селезенка считается «кладбищем эритроцитов» в связи с тем, что обладает способностью понижать осмотическую устойчивость старых или поврежденных эритроцитов. Такие эритроциты не способны выйти в венозные синусы и подвергаются разрушению и поглощаются макрофагами красной пульпы.
В результате расщепления гемоглобина поглощенных макрофагами эритроцитов образуются и выделяются в кровоток билирубин и содержащий железо трансферрин. Билирубин переносится в печень, где войдет в состав желчи. Трансферрин из кровотока захватывается макрофагами костного мозга, которые снабжают железом вновь развивающиеся эритроциты.
В селезенке депонируется кровь и скапливаются тромбоциты. Старые тромбоциты также подвергаются здесь разрушению.
Синусы красной пульпы, расположенные между селезеночными тяжами, представляют собой часть сложной сосудистой системы селезенки. Это широкие тонкостенные сосуды неправильной формы, выстланы эндотелиальными клетками необычной веретеновидной формы с узкими щелями между ними, через которые в просвет синусов из окружающих тяжей мигрируют форменные элементы. Базальная мембрана прерывиста, ее дополняют ретикулярные волокна и отростки ретикулярных клеток.
Васкуляризация. В ворота селезенки входит селезеночная артерия, которая разветвляется на трабекулярные артерии. Наружная оболочка артерий рыхло соединена с тканью трабекул. Средняя оболочка четко заметна на любом срезе трабекулярной артерии благодаря мышечным пучкам, идущим в составе ее стенки по спирали. От трабекулярных артерий отходят пульпарные артерии. В наружной оболочке этих артерий много спирально расположенных эластических волокон, которые обеспечивают продольное растяжение и сокращение сосудов. Недалеко от трабекул в адвентиции пульпарных артерий появляются периартериальные лимфатические влагалища и лимфатические узелки. Артерия получает название центральной.
Центральная артерия, проходящая через узелок, отдает несколько гемокапилляров и, выйдя из узелка, разветвляется в виде кисточки на несколько кисточковых артериол (arteriolae penicillaris). Дистальный конец этой артериолы продолжается в эллипсоидную (гильзовую) артериолу (arteriolaelipsoideae), снабженную муфтой (или «гильзой») из ретикулярных клеток и волокон. Это своеобразный сфинктер на артериоле. У человека эти гильзы развиты очень слабо. В эндотелии гильзовых или эллипсоидных артериол обнаружены сократительные фила-менты. Далее следуют короткие гемокапилляры. Большая часть капилляров красной пульпы впадает в венозные синусы (это т.н. закрытое кровообращение), однако некоторые могут непосредственно открываться в ретикулярную ткань красной пульпы (это т.н. открытое кровообращение). Закрытое кровообращение — путь быстрой циркуляции и оксигенации тканей. Открытое кровообращение — более медленное, обеспечивающее контакт форменных элементов крови с макрофагами.
Синусы являются началом венозной системы селезенки. Их диаметр колеблется от 12 до 40 мкм в зависимости от кровенаполнения. При расширении совокупность всех синусов занимает большую часть селезенки. Эндотелиоциты синусов расположены на прерывистой базальной мембране. По поверхности стенки синусов в виде колец залегают ретикулярные волокна. Синусы не имеют перицитов. Во входе в синусы и в месте их перехода в вены имеются подобия мышечных сфинктеров. При открытых артериальных и венозных сфинктерах кровь свободно проходит по синусам в вены. Сокращение венозного сфинктера приводит к накоплению крови в синусе. Плазма крови проникает сквозь стенку синуса, что способствует концентрации в нем клеточных элементов. В случае закрытия венозного и артериального сфинктеров кровь депонируется в селезенке. При растяжении синусов между эндотелиальными клетками образуются щели, через которые кровь может проходить в ретикулярную строму. Расслабление артериального и венозного сфинктеров, а также сокращение гладких мышечных клеток капсулы и трабекул ведет к опорожнению синусов и выходу крови в венозное русло.
Отток венозной крови из пульпы селезенки совершается по системе вен. Трабекулярные вены лишены собственного мышечного слоя; средняя оболочка в них выражена очень слабо. Наружная оболочка вен плотно сращена с соединительной тканью трабекул. Такое строение вен обусловливает их зияние и облегчает выброс крови при сокращении гладких мышечных клеток селезенки. Между артериями и венами в капсуле селезенки, а также между пульпарными артериями встречаются анастомозы.
Иннервация. В селезенке имеются чувствительные нервные волокна (дендриты нейронов спинномозговых узлов) и постганглионарные симпатические нервные волокна из узлов солнечного сплетения. Миелиновые и безмиелиновые (адренергические) нервные волокна обнаружены в капсуле, трабекулах и сплетениях вокруг трабекулярных сосудов и артерий белой пульпы, а также в синусах селезенки. Нервные окончания в виде свободных концевых веточек располагаются в соединительной ткани, на гладких мышечных клетках трабекул и сосудов, в ретикулярной строме селезенки.
Возрастные изменения. В старческом возрасте в селезенке происходит атрофия белой и красной пульпы, вследствие чего ее трабекулярный аппарат вырисовывается более четко. Количество лимфатических узелков в селезенке и размеры их центров постепенно уменьшаются. Ретикулярные волокна белой и красной пульпы грубеют и становятся более извилистыми. У лиц старческого возраста наблюдаются узловатые утолщения волокон. Количество макрофагов и лимфоцитов в пульпе уменьшается, а число зернистых лейкоцитов и тучных клеток возрастает. У детей и лиц старческого возраста в селезенке обнаруживаются гигантские многоядерные клетки — мегакариоциты. Количество железосодержащего пигмента, отражающее процесс гибели эритроцитов, с возрастом в пульпе увеличивается, но располагается он главным образом внеклеточно.
Регенерация. Физиологическое обновление лимфоидных и стромальных клеток происходит в пределах самостоятельных стволовых дифферонов. Экспериментальные исследования на животных показали возможность восстановления селезенки после удаления 80—90% ее объема (репаративная регенерация). Однако полного восстановления формы и размеров органа при этом, как правило, не наблюдается.
Что такое Сублейкемический миелоз -
Сублейкемический миелоз относится к лейкозам, проявляющимся несколько повышенной полиморфно-клеточной миелопролиферацией типа панмиелоза или миеломегакариоцитарного миелоза, прогрессирующим миелофиброзом и остеомиелосклерозом, спленомегалией, гепатомегалией с трехростковой миелоидной метаплазией в этих и, значительно реже, в других органах и тканях.
Что провоцирует / Причины Сублейкемического миелоза:
В литературе не встретились данные о структуре заболеваемости сублейкемическим миелозом.
Патогенез (что происходит?) во время Сублейкемического миелоза:
Некоторые исследователи полагают, что при сублейкемическом миелозе первично нарушается процесс кроветворения на уровне клетки-предшественницы миелопоэза. Принадлежность его к гемобластозам и вторичный характер миелофиброза основываются на исследованиях типов Г-6-ФД в клетках крови и фибробластах костного мозга и кожи у мулаток, гетерозиготных по этому ферменту. Согласно одной из концепций, миелофиброз при этой форме лейкоза обусловлен мегакариоцитами и тромбоцитами, продуцирующими ростковый фактор, усиливающий пролиферацию фибробластов. Топография миелофиброза соответствует участкам скопления мегакариоцитов. Сторонники принадлежности сублейкемического миелоза к лейкозам указывают на миелоидную метаплазию в селезенке и других органах, финальное обострение процесса по типу бластного криза, наличие злокачественной формы заболевания и чувствительность таких больных к цитостатической терапии.
Симптомы Сублейкемического миелоза:
При доброкачественном варианте сублейкемического миелоза развернутой клинической картине предшествует длительный бессимптомный период. Продолжительность жизни от момента установления диагноза колеблется от 1,5 до 5 лет, встречаются случаи более длительного течения заболевания (15-20 и более лет).
Злокачественные формы сублейкемического миелоза характеризуются острым (подострым) или молниеносным течением, ранним возникновением бластного криза, глубокой тромбоцитопенией и выраженным геморрагическим синдромом, приводящим к смерти. Часто присоединяются инфекционные осложнения, сердечная и печеночная недостаточность и тромбозы. В 10-17% случаев диагностируется портальная гипертензия с варикозным расширением вен пищевода.
Примерная формулировка диагноза:
Сублейкемический миелоз чаще обнаруживается у лиц старше 40 лет. Иногда в течение многих лет больные не отмечают никаких признаков болезни, обращаются к врачу с жалобами на похудание, периодически возникающую лихорадку, боли в костях и в области селезенки. На фоне несостоятельности гемостаза и тромбоцитопении возникают кровоизлияния в кожу, суставы, нередки кровотечения из вен пищевода и желудка. Анемия чаще носит нормохромный, редко мегалобластный или гемолитический характер. В отдельных случаях выявляются эритроцитоз и увеличение эритропоэза в костном мозге. В гемограмме количество лейкоцитов увеличено, иногда снижено, отмечается нейтрофилез со сдвигом влево. Количество тромбоцитов увеличено или нормально, они функционально неполноценны. В миелограмме — мегакариоцитоз (незрелые формы). В костном мозге — сужение полостей, заполненных фиброзной тканью. В увеличенной селезенке, печени и других органах и тканях очаги внекостномозгового кроветворения полиморфного состава.
Диагностика Сублейкемического миелоза:
Диагноз сублейкемического миелоза устанавливают на основании клинических данных и результатов исследования состояния гемопоэза (гемограммы, миелограммы, биоптата костного мозга).
Сублейкемический миелоз дифференцируют от хронического миелолейкоза, протекающего с сублейкемическим лейкоцитозом. Обнаружение Ph'-хромосомы служит веским аргументом в пользу миелолейкоза.
Дифференциальную диагностику следует проводить также между сублейкемическим миелозом и вторичным миелофиброзом, который может развиваться при злокачественных новообразованиях, длительных инфекциях (туберкулез), а также при токсических воздействиях (бензол и его производные и др.).
Лечение Сублейкемического миелоза:
На ранних стадиях сублейкемического миелоза при умеренной анемии и спленомегалии, не вызывающей абдоминального дискомфорта, цито-статическое лечение применять не следует; можно ограничиться общеукрепляющей терапией. Показаниями к назначению цитостатиков является спленомегалия с компрессионным синдромом и явлениями гиперспленизма, тромбоцитемия с угрозой возникновения тромбозов, прогрессирующая бластемия, плетора.
Миелобромол назначают по 250 мг/сут при исходном количестве лейкоцитов не менее 15-20*10 9 /л и нормальном содержании тромбоцитов, курсовая доза 4-10 г. При несколько меньшем их числе предварительно, на 7-14 дней, назначают глюкокортикоидные и анаболические гормоны. Препарат отменяют, когда лейкоциты достигают 6-7*10 9 /л, а тромбоциты - 100-150*10 9 /л.
Циклофосфан, противоопухолевый эффект которого менее выражен, чем миелобромола, назначают - в случаях сниженного количества лейкоцитов и тромбоцитов - по 200-400 мг/сут внутривенно с промежутками 1 -3 дня (курсовая доза 10- 12 г) в сочетании с глюкокортикоидными гормонами. При бластном кризе используют принципы лечения острых лейкозов.
Основные клинико-гематологические и рентгенологические изменения при сублейкемическом миелозе
Размеры селезенки, печени
Спленомегалия, нередко нижний край селезенки достигает малого таза, гепатомегалия у 50% больных (эти симптомы могут отсутствовать), явления абдоминального дискомфорта
Анемня, чаще нормохромная, иногда мегалобластного или гемолитического характера (снижение продолжительности жизни эритроцитов, повышение уровня свободного билирубина в сыворотке крови); в отдельных случаях эритроцитоз, часто анизо- и пойкилоцитоз, мишеневидные и грушевидные формы эритроцитов, эритро- и нормобласты, ретикулоцитоз; в костном мозге эритропоэз иногда бывает усилен
В гемограмме количество лейкоцитов увеличено, но не существенно, редко снижено; нейтрофилез со сдвигом влево, иногда встречаются миелобласты. В костном мозге увеличено количество незрелых форм нейтрофилов
Количество тромбоцитов увеличено у 50% больных, они функционально неполноценны (снижены ретракция кровяного сгустка, уровень фактора 3, адгезивность тромбоцитов, увеличено время кровотечения); в костном мозге увеличено число мегакариоцитов включая незрелые формы
Экстра медуллярный гемопоэз
Характерно наличие очагов трехросткового кроветворения, состоящих из клеток различной степени зрелости, в селезенке, печени, других органах
Массивное разрастание костной ткани с уменьшением объема деятельного костного мозга и с сужением его полостей, заполненных фиброзной тканью, жировыми клетками; костные балки утолщены, неправильной формы вследствие напластования атипичной костной ткани, остеоида
На рентгенограммах костей (таз, позвонки, ребра, череп, длинные трубчатые) кортикальный слой утолщен, утрачена нормальная трабекулярная структура, может выявляться облитерация костномозговых полостей
Лучевая терапия на область резко увеличенной селезенки вызывает кратковременный положительный эффект, купируя явления абдоминального дискомфорта, однако возможно развитие глубокой цитопении.
Спленэктомия показана в основном в случаях глубоких гемолитических кризов, не поддающихся медикаментозной терапии, при угрозе разрыва селезенки и рецидивирующих ее инфарктах, при выраженном геморрагическом тромбоцитопеническом синдроме. Спленэктомия противопоказана в терминальной стадии, при тромбоцитозе и гиперкоагуляции.
Глюкокортикоидные гормоны назначают при анемии гемолитического характера, цитопениях, длительной лихорадке неинфекционного происхождения, артралгиях. Анаболические гормоны (неробол, ретаболил) показаны при анемии, обусловленной недостаточностью эритропоэза, длительном лечении глюкокортикоидными гормонами. При глубокой анемии применяют трансфузии эритроцитной массы; тромбоцитопенический геморрагический синдром служит показанием для переливаний тромбоконцентрата. При железодефицитной анемии назначают препараты железа.
К каким докторам следует обращаться если у Вас Сублейкемический миелоз:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Сублейкемического миелоза, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору – клиника Euro lab всегда к Вашим услугам! Лучшие врачи осмотрят Вас, изучат внешние признаки и помогут определить болезнь по симптомам, проконсультируют Вас и окажут необходимую помощь и поставят диагноз. Вы также можете вызвать врача на дом. Клиника Euro lab открыта для Вас круглосуточно.
Как обратиться в клинику:
Телефон нашей клиники в Киеве: (+38 044) 206-20-00 (многоканальный). Секретарь клиники подберет Вам удобный день и час визита к врачу. Наши координаты и схема проезда указаны здесь. Посмотрите детальнее о всех услугах клиники на ее персональной странице.
Если Вами ранее были выполнены какие-либо исследования, обязательно возьмите их результаты на консультацию к врачу. Если исследования выполнены не были, мы сделаем все необходимое в нашей клинике или у наших коллег в других клиниках.
У Вас ? Необходимо очень тщательно подходить к состоянию Вашего здоровья в целом. Люди уделяют недостаточно внимания симптомам заболеваний и не осознают, что эти болезни могут быть жизненно опасными. Есть много болезней, которые по началу никак не проявляют себя в нашем организме, но в итоге оказывается, что, к сожалению, их уже лечить слишком поздно. Каждое заболевание имеет свои определенные признаки, характерные внешние проявления – так называемые симптомы болезни. Определение симптомов – первый шаг в диагностике заболеваний в целом. Для этого просто необходимо по несколько раз в год проходить обследование у врача, чтобы не только предотвратить страшную болезнь, но и поддерживать здоровый дух в теле и организме в целом.
Если Вы хотите задать вопрос врачу – воспользуйтесь разделом онлайн консультации, возможно Вы найдете там ответы на свои вопросы и прочитаете советы по уходу за собой. Если Вас интересуют отзывы о клиниках и врачах – попробуйте найти нужную Вам информацию в разделе Вся медицина. Также зарегистрируйтесь на медицинском портале Euro lab, чтобы быть постоянно в курсе последних новостей и обновлений информации на сайте, которые будут автоматически высылаться Вам на почту.
Фуникулярный миелоз — повреждение спинного мозга, которое может развиваться при дефиците витамина В12. Чаще всего сопровождается пернициозной анемией. Заболевание вызывает расстройства глубокой чувствительности, психическими расстройствами.
Диагноз устанавливается на основании данных об уровне В12 в крови, по данным неврологического, гематологического и гастроэнтерологического обследований. Лечение заключается в восстановлении оптимального уровня витамина В12, коррекция пищевого рациона с увеличением продуктов, содержащих В12. Прогноз заболевания благоприятный.
Общая информация
Развитие фуникулярного миелоза обусловлено процессами разрушения в задних и боковых канатиках спинного мозга с одновременным нарастанием дефицита цианокобаламина — авитаминоза В12. Недостаточность витамина В12 провоцирует появление злокачественной пернициозной анемии, которая зачастую сопровождает фуникулярный миелоз. Впервые дует двух заболеваний был описан Лихтгеймом в 1887 году.
Фуникулярный миелоз регистрируется у пациентов разных возрастных групп, однако большинство случаев приходятся на возраст после 40 лет — примерно 90% клинических случаев. Развитие патологии наступает в следствие, как экзогенного авитаминоза В12, вызываемого дефицитом цианокобаламина в продуктах питания, так и при эндогенной недостаточности В12, развивающейся при расстройстве всасывания в желудочно-кишечном тракте.
Практически в половине случаев заболевание фуникулярным миелозом вызывает у больного иммунные патологии, проявляющиеся развитием атрофического гастрита, формированием специфических антител к внутреннему фактору Касла. Учитывая развитие сопутствующих патологических состояний, изучением фуникулярного миелоза занимаются специалисты в области неврологии, гастроэнтерологии, иммунологии.
Факторы развития фуникулярного миелоза
Развитие эндогенной недостаточности витамина В12 наступает вследствие полного отсутствия в ежедневном питании продуктов, содержащих цианокобаламин: мяса, рыбы, молочных продуктов. Авитаминоз В12 является результатом анорексии, длительного голодания или неполноценного рациона, которые приводят и к развитию алиментарной дистрофии.
При эндогенной недостаточности витамина В12 происходит нарушение всасывания цианокобаламина. Нормальное всасывание требует преобразования витамина В12 в легкоусвояемую форму. Это становится возможным, если желудок обеспечивает синтез гастромукопротеид — внутренний фактор Касла.
Продуцирование внутреннего фактора Касла значительно снижается после перенесенных операциях на желудке — частичной резекции или гастрэктомии, при опухолях желудка, ахилии. Все перечисленные состояния вызывают расстройство всасывания цианокобаламина, а далее — фуникулярный миелоз.
Причиной нарушения всасывания витамина В12 наблюдается при патологических состояниях кишечника, которые сопровождаются синдромом мальабсорбции. К таким заболеваниям относятся болезнь Крона, энтерит туберкулезного происхождения, спру, болезнь Уиппла, целиакия, пострезекционный синдром короткой кишки.
При оперативном лечении дивертикулеза кишечника, дифиллоботриоза в ходе формирования энтероанастомоза образуется слепая петля кишечника, в которой с избытком накапливается кишечная флора. Она может усиленно поглощать цианокобаламин и препятствовать его всасыванию ворсинками кишечника.
Причины возникновения изменений в спинном мозге, которые влекут за собой развитие фуникулярного миелоза на сегодняшний день достаточно не изучены. Существует теория о нарушении выработки ферментов метионинсинтазы, метилмалонил-КоА-мутазы, которые принимают участие в синтезе миелина и образовании миелиновой оболочки нервных волокон.
При изучении фуникулярного миелоза выявляется демиелинизация волокон, находящихся в задних и боковых столбах спинного мозга. Следует заметить, что демиелинизирующие признаки ярче выражены в задних столбах в зонах чувствительности Голля и Бурдаха.
Проводящие пути пирамидальной, спинномозжечковой, спиноталамической активности, проходящие в боковых столбах, также подвергаются демиелинизации. При обследовании зрительных нервов у некоторых больных тоже могут выявляться участки демиелинизации.
Клиническая картина фуникулярного миелоза
Заболевание характеризуется появлением сенсорно-двигательных нарушений и психических отклонений. Первыми симптомами фуникулярного миелоза становятся парестезии, проявления общей слабости. Нарушения чувствительности могут выражаться ощущениями покалывания, периодического онемения, мурашек на коже, чувства жара в пальцах рук и ног, переходящего на плечи, грудь, живот.
Первой страдает мышечно-суставная чувствительность, а затем — вибрационная. Как результат, формируется сенситивная атаксия с проявлениями двигательной дискоординации, нестабильности, шаткости при ходьбе.
С дальнейшим развитием заболевания больные отмечают выраженную слабость в нижних конечностях. В начале нижний парапарез имеет спастические проявления, усиление сухожильных рефлексов, мышечный гипертонус и клонус стоп. Однако со временем мышцы слабеют, рефлексы становятся менее выраженными. Парез трансформируется в периферические отделы. Сохранность патологических рефлексов стоп указывает на патологию, протекающую в пирамидном пути.
При запущенном течении заболевания больной может лишиться способности ходить. К прочим нарушениям присоединяются расстройства тазовых органов, которые могут выражаться недержанием мочи, импотенцией, энкопрезом.
Со стороны психики наблюдаются разнообразные расстройства. Больные могут жаловаться на раздражительность, апатию, гиперсомнию, депрессию. Иногда наблюдаются острые психозы.
Нейропатия зрительного нерва проявляется в виде снижения качества зрения с выпадением центрального участка. Для фуникулярного миелоза характерны признаки развивающейся пернициозной анемии — бледность, малиновый язык, глоссит, стоматит, тахикардия, одышка.
Диагностика
Врач должен заподозрить дефицит витамина В12 при сочетании у больного неврологических признаков с явлениями, указывающими на анемию. Чтобы подтвердить диагноз, обязательно выполняют анализ на уровень В12 в крови. К диагностированию подключают гастроэнтеролога и гематолога. Больному предписывают сдачу обязательных анализов:
- клинический анализ крови;
- зондирование желудка с целью изучения секреции;
- гастроскопия;
- исследование на наличие антител к внутреннему фактору Касла;
- обзорная рентгенография кишечника;
- рентгенография для определения пассажа бария.
Назначение магнитно-резонансной томографии позвоночника проводится с целью выявления очагов демиелинизации в структурах спинного мозга. МРТ служит в качестве дифференциальной диагностики для отличия фуникулярного миелоза от компрессионной миелопатии, опухолей позвоночника, миелопатии вертеброгенного характера, образований спинного мозга (опухолей, кист).
Целесообразно выполнение люмбальной пункции для исследования спинномозговой жидкости на признаки инфекционного миелита, гематомиелии. При подозрении на нейросифилис проводится RPR-тестирование. Стернальная пункция необходима для изучения миелограммы при подозрении на гематологические расстройства. Консультация офтальмолога показана при появлении зрительных патологий. Целесообразно проведение визометрического, периметрического и офтальмоскопического обследований.
Лечение

Специфическое лечение направлено на восстановление дефицита цианокобаламина. На первом этапе терапии витамин В12 вводится внутримышечно ежедневно. Через 5-10 дней введение цианокобаламина назначается один раз в неделю. Спустя четыре недели препарат вводят один раз в месяц.
В некоторых случаях требуется выполнение ежемесячных внутримышечных инъекций в течение всей жизни. Обязательно пересматривается рацион больного. В диету вводятся натуральные продукты, богатые витаминами группы В — всевозможные сорта рыбы, говядина, творог, сыр, яйца кур, крабы. Следует отметить, что одновременно с введением витамина В12, выполняется курсовой прием препаратов, содержащих тиамин (В1), пиридоксин (В6).
При недостаточности витамина В12 наблюдается и дефицит фолиевой кислоты. Назначение лекарственных средств, содержащих фолиевую кислоту, рекомендовано после коррекции уровня цианокобаламина. Если пренебречь данным советом, можно усугубить неврологические проявления.
Рекомендованы лечебные мероприятия, направленные на восстановление оптимальной секреторной функции желудка, устранение расстройств кишечного всасывания. Обязательно уделяется внимание профилактике мочеполовых инфекций. Для реабилитации двигательных и сенсорных функций проводятся курсы массажа, физиотерапии, ЛФК.
Фуникулярный миелоз может протекать в острой или подострой форме. Если не устанавливается верный диагноз, смерть больного может наступить в течение двух лет с момента заболевания. При своевременном, адекватном лечении с использованием препаратов витамина В12 отмечается благоприятный прогноз для больного.
Если пациент начинает получать лечение спустя несколько месяцев с момента появления первых признаков заболевания, можно стабилизировать его состояние, однако нельзя прогнозировать полное восстановление неврологических функций.
Федоренко Д.А., Левчук А.Л.
В клинику гематологии поступил 67-летний пациент со следующими клиническими проявлениями: анемия, кашель с отделением слизисто-гнойной мокроты, синдром интоксикации, спленомегалия. В анализе крови отмечено снижение гемоглобина до 22 г/л, повышение количества тромбоцитов до 800х109/л, гипоальбуминемия.
При сборе анамнеза было установлено, что в 2005 году больному был поставлен диагноз сублейкемического миелоза, в верхней доле правого легкого выявлено образование неясного генеза. Морфологическая верификация образования не проводилась, изменения в легких трактовались как вероятное специфическое лейкемическое поражение.
Предшествующая терапия включала противоопухолевое лечение - гидреа, реаферон, заместительную гемотрансфузионную терапию.
Несмотря на проводимое лечение, заболевание прогрессировало: нарастала анемия, интоксикационный синдром, было отмечено увеличение образования в верхней доле правого легкого.
В клинике гематологии и клеточной терапии им. А.А. Максимова больному был поставлен предварительный диагноз:
Основное заболевание: сублейкемический миелоз, развернутая стадия.
Осложнения основного заболевания: анемия тяжелой степени, вторичный иммунодефицит, образование в S3 верхней доли правого легкого.
Дифференциальный диагноз по поводу образования в легком проводили между лейкемическим поражением, второй опухолью и локализованной инфекцией.
При выполнении компьютерной томографии были изучены топография и размеры (8,2х10,8х10,9 см) образования в верхней доле правого легкого. При 3-D реконструкции обследована пораженная область объемом 340 см3, не участвующая в акте дыхания.
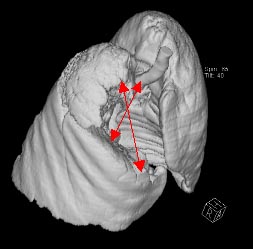
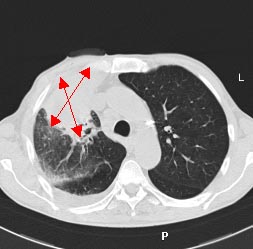
Рис. 1 а, б. КТ органов грудной клетки (максимальные размеры указаны стрелкой)
Этапы диагностики с целью верификации природы образования включали посев мокроты, бронхоальвеолярный лаваж – патологических изменений выявлено не было. Больному выполнена чрескожная пункционная биопсия с последующим цитологическим исследованием, выявившим клетки, похожие на простейшие. Для верификации диагноза материал был направлен в специализированную лабораторию ММА им. И.М. Сеченова, где после протозоологического исследования был выставлен диагноз амебного поражения легких.
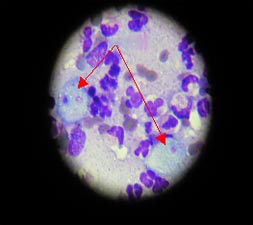
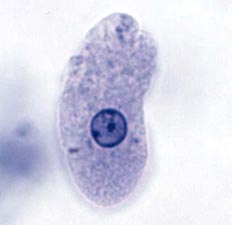
Рис. 2 а, б. Цитологическая картина биоптата из образования в верхней доле правого легкого Entamoeba histolytica (показана стрелкой)
Следует отметить отрицательный эпидемиологический анамнез больного и отсутствие поражений желудочно-кишечного тракта и печени.
В результате дообследования в клинике гематологии и клеточной терапии им. А.А.Максимова был поставлен окончательный диагноз:
Основное заболевание: сублейкемический миелоз, развернутая стадия.
Осложнения основного заболевания: анемия тяжелой степени, вторичный иммунодефицит, внекишечный амебиаз, амебная пневмония в S3 правого легкого.
План лечения больного включал 2 этапа:
I этап: терапия амебиаза - метронидазол (750 мг х 3 раза в день – 3 мес.); заместительная гемотрансфузионная терапия.
II этап: коррекция вторичных гематологических проявлений сублейкемического миелоза (на фоне химиорезистентности) – спленэктомия.
При контрольном обследовании после 3 мес. лечения с помощью компьютерной томографии зафиксировано значительное уменьшение размеров образования. При 3-D-реконструкции установлено уменьшения объема пораженной области в 5 раз.
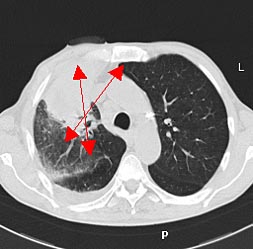
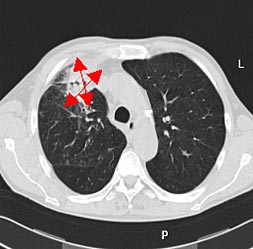
Рис. 3. КТ органов грудной клетки: А. До лечения (8,2х10,8х10,9 см); Б. После лечения (2,5 х 3,7 х 4,8 см).
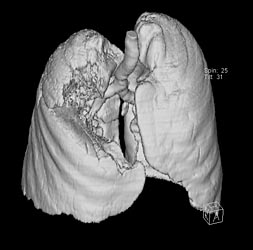
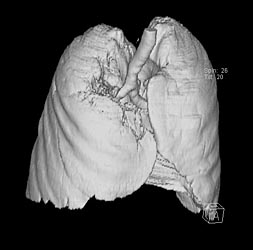
Рис. 4. 3-D-реконструкция: А - до лечения (V= 340 см³). Б. - после лечения (V= 70,3 см ³).
Разрешение амебной пневмонии и успешная заместительная гемотрансфузионная терапия позволили перейти к реализации задачи второго этапа лечения, в соответствии с которой, больному была выполнена спленэктомия на 2-м хирургическом отделении Пироговского Центра. Макропрепарат удаленной селезенки представлен на Рис. 5.
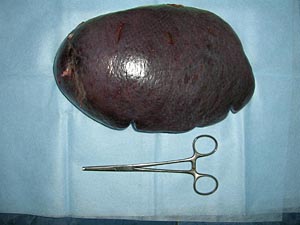
Рис. 5. Макропрепарат удаленной селезенки (21,0 х 9,2 см)
При обследовании через 3 мес. после спленэктомии зарегистрировано улучшение общесоматического статуса больного и положительная динамика ряда лабораторных показателей: повышение уровня гемоглобина до 98 г/л, снижение числа тромбоцитов до 532 х 109/л, нормализация уровня альбумина.
В большинстве случаев хронические лейкозы сопровождаются вторичным иммунодефицитом, локальными и системными инфекционными осложнениями. Однако внекишечный амебиаз относится к исключительным явлениям при данном виде патологии.
Читайте также:

