Ткани зуба мезенхимального происхождения
Опубликовано: 24.07.2024
Ткани зуба у взрослых практически не способны к самостоятельной регенерации, и дефект эмали, возникающий в результате действия повреждающих факторов, постепенно приводит к потере зуба. Без сомнения, современные технологии протезирования позволяют произвести реконструкцию даже при полном отсутствии зубов. Однако прогресс современной органотипической регенеративной медицины подвигает исследователей к поиску технологий замещения зубов естественными трансплантатами.
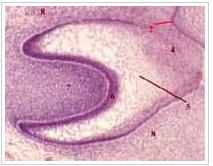
Для формирования полноценной структуры зуба в эмбриогенезе необходимы клетки (энамелобласты, одонтоб-ласты), образование которых возможно только при взаимодействии клеток эктодермальной и мезенхимальной природы. Ткани зуба закладываются на 6-7-й неделе внутриутробного развития. Закладка их начинается с погружения эпителия ротовой полости в подлежащую мезенхиму. На эпителиальной зубной пластинке появляются мелкие выпячивания, называемые зубными зачатками, из которых будет развиваться молочный зуб. Эта структура образует эмалевый орган, а нижележащая мезенхима, заполняющая полость чаши, называется зубным сосочком.
Дифференцировка зубных зачатков начинается с 3-го месяца внутриутробного развития, а к началу 5-го эмалевый орган утрачивает непосредственную связь с эпителием ротовой полости, хотя остатки зубной пластинки могут длительно сохраняться (иногда из них развиваются кисты). Незадолго до этого клетки зубной пластинки формируют второй эпителиальный зачаток, из которого будет развиваться постоянный зуб (рис. 1).
Рис. 1. Закладка зуба человека на стадии эмалевого органа.
1 - многослойный эпителий ротовой полости;
2 - зубная пластинка;
3 - эмалевый орган;
4 - внутренний эмалевый эпителий;
5 - наружный эмалевый эпителий;
6 - мезенхимальный зубной.
Окраска: гематоксилин и эозин. Из Sobotta J. Atlas und Grundriss der Histologie und Mikroskopischen Anatomie des Menschen. Мьпспеп, 1902, с изменениями.
Возможность существования малодифференцированных клеток пульпы впервые предположил Н. Taatz в 1965 году. Он обнаружил в пульпе зуба активные фибробластоподобные клетки, способные к культивированию in vitro. Уже в 1969 году в пульпе была обнаружена зона с активной клеточной пролиферацией. Эта область получила название зоны Уейла (zone of Weil). В ней были выявлены одонтобласты - клетки, активно синтезирующие внеклеточный матрикс с высоким уровнем щелочной фосфатазы в цитоплазме. Эти клетки, расположенные в виде трехмерной сети, также активно экспрессировали виментин. В дальнейшем было показано активное участие клеток пульпы этой области в регенерации зуба при кариозном процессе - вторичный (или репаративный) дентиногенез в самообновлении ткани зуба.
Основными клетками, поддерживающими вторичный дентиногенез, являются одонтобласты, которые, в свою очередь, происходят от проодонтобластов. Последние же возникают при взаимодействии мезенхимальных стволовых клеток (МСК) пульпы с прогениторными клетками ротового эпителия, активно экспрессирующего цитокератин 14 (СК-14). ДНК microarray-анализ МСК пульпы показал почти полное отсутствие различий между этими клетками и стромальными клетками костного мозга. Популяция пульпарных МСК неоднородна.
In vivo и in vitro только 2/3 из них способны к эктопическому образованию пульпы, а 1/3 имеют потенцию к дифференцировке в другие клетки мезенхимальных тканей и даже в нейральные клетки.
В настоящее время технологии создания артифициального зуба (дентогенез) методами тканевой инженерии развиваются двумя основными путями. Первый путь - так называемый прямой дентогенез. От плода получают закладки зуба (зубная пластинка, эмалевый орган, зубной сосочек). Клеточная масса, состоящая из энамелобластов, одонтобластов и малодифференцированных эпителиальных и мезенхимальных клеток, суспензируется и совместно культивируется. В качестве матрицы используют биодеградируемые полимеры на основе органических кислот (PGA, PGLA), которым придают трехмерную форму зуба. Культура клеток наносится на матрицу, и препарат пересаживается в альвеолу челюсти, где под воздействием факторов клеточного и тканевого микроокружения происходит дентогенез.
Второй путь - непрямой дентогенез, при котором развитие происходит внеальвеолярно. После выделения, кокультивирования и нанесения на матрицу клеток закладки зуба тканеинженерная конструкция пересаживается в мягкие ткани, не относящиеся к ротовой полости (сальник, околопочечная клетчатка, подкожная жировая клетчатка) на срок от 20 до 35 недель. По истечении указанного времени происходит образование ткани зуба за счет ближайших межклеточных взаимодействий (рис. 2, 3).
Рис. 2. Артифициальный зуб крысы, сформированный в подкапсульном пространстве почки из мезенхимальных
стволовых клеток и клеток эпителия ротовой полости через 12 недель после пересадки.
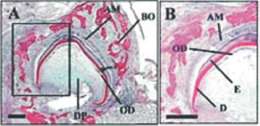
DP - пульпа зуба
(J Dent Res 2004; 83; 7: 523-528).
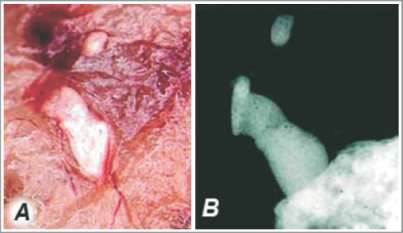
Рис. 3. Макропрепарат (А) и рентгенограмма (В) артифициального зуба крысы, сформированного в подкапсульном пространстве почки из мезенхимальных стволовых клеток и клеток эпителия ротовой полости
через 12 недель после пересадки. (J Dent Res 2004; 83; 7: 523-528).
Однако, у аллографтинга есть ряд известных недостатков. Поэтому дентогенез из аутогенных тканей имеет явные преимущества. Оказалось, что для формирования ткани зуба важны, прежде всего, низко дифференцированные эпителиальные клетки ротовой полости, а мезенхимальные клетки могут иметь отличное от мезенхимы краниальной части эмбриона происхождение. Так, в эксперименте при кокультивировании стромальных клеток костного мозга и эпителия эмалевого органа можно получить сформированную структуру зуба. Таким образом, имеются доступные клеточные источники для дентогенеза у взрослого организма, что позволяет отказаться от использования аллогенного клеточного материала.
Создание тканеинженерных конструкций для дентогенеза de novo - реальность сегодняшнего дня. Основной проблемой можно считать обеспечение кровоснабжения артифициального зуба после графтинга, так как технология прямого дентогенеза в клинической практике может вызвать ряд неудобств в течение как минимум 30-35 недель, связанных с созданием определенных условий микроокружения для развивающегося зуба. Нельзя не отметить, что создание зуба как органа de novo можно считать прорывом в реконструктивной стоматологии. Об этом свидетельствуют и поток публикаций, и внимание частных компаний (Odontis Ltd), формирующих «новый бизнес» в стоматологической имплантологии.
Зубы участвуют в механической обработке пищи: плоские резцы и клыки конической формы откусывают пищу, малые и большие коренные зубы с коронками кубической формы и жевательными буграми перетирают ее при еде. Зубы имеют важное значение для артикуляции.
Гисто- и органогенез зубов. У человека различают две смены зубов — выпадающие, или молочные (20), и постоянные (32). Развитие молочных зубов начинается в конце 2-го месяца эмбриогенеза. В это время эпителий ротовой полости врастает в виде зубной пластинки в подлежащую мезенхиму. На передней поверхности зубной пластинки возникают эпителиальные зубные почки по числу закладок зубов, вокруг которых возникает уплотнение мезенхимных клеток — зубные мешочки.
Взаимодействие двух эмбриональных зачатков приводит к изменению формы зубной пластинки — она постепенно трансформируется в структуру в виде бокала, внутри которого концентрируются мезенхимные клетки в форме сосочка. Последний оказывает индуктивное влияние на дифференцировку клеток эпителиального зубного бокала, в котором топографически выделяются внутренний и наружный эмалевый эпителий и клетки промежуточного слоя. Внутренний эмалевый эпителий обращен к мезенхимному сосочку, наружный образует "стенку" зубного бокала и тонкой клеточной ножкой остается некоторое время связанным с эпителием ротовой полости; клетки промежуточного слоя располагаются между двумя первыми, приобретают звездчатую форму и оттесняются друг от друга накапливающейся здесь жидкостью.
Внутренний эмалевый эпителий отделяется от мезенхимного сосочка базальной мембраной. Его клетки дифференцируются в энамелобласты (амелобласты) — клетки-образователи эмали. Образование базальной мембраны индуцирует дифференцировку расположенных рядом мезенхимных клеток в одонтобласты (дентинобласты). Последние, в свою очередь, влияют на развитие энамелобластов.
Энамелобласты имеют вытянутую цилиндрическую форму, в них постепенно происходит перемещение ядер из базальной части клеток в апикальную, поскольку в базальных частях клеток формируются эмалевые призмы, слой которых составляет эмаль зуба. Начинается кальцинация эмали. Каждый энамелобласт вырабатывает одну эмалевую призму.
Клетки, прилежащие к энамелобластам, — одонтобласты — начинают секретировать дентин во встречном с образованием эмали направлении. По мере развития зуба массы эмали и дентина увеличиваются, и ряды клеток удаляются друг от друга. Энамелобласты при этом отодвигаются наружу, а одонтобласты — внутрь развивающегося зуба. К моменту прорезывания молочных зубов ядросодержащие части энамелобластов редуцируются, остаются лишь тесно прилежащие друг к другу эмалевые призмы, покрытые кутикулой, образованной остатками промежуточных звездчатых клеток и наружного эмалевого эпителия. Последние постепенно уменьшаются в размерах и дегенерируют; клеточная ножка, связывающая зачаток зуба с эпителием полости рта, фрагментируется и полностью исчезает.
Зубной зачаток оказывается погруженным в костную ткань челюсти. Формирование эмали и дентина распространяется от вершины будущего зуба к боковым поверхностям. Клетки зубного мешочка дифференцируются в цементобласты, и незадолго до прорезывания зуба в области будущих корней формируют цемент. Клетки центральных участков мезенхимных сосочков образуют пульпу зуба — внутреннюю рыхлую соединительную ткань зуба, богатую сосудами. Из клеток наружного слоя мезенхимного зубного мешочка образуется зубная связка (периодонт), соединяющая зуб с альвеолой челюсти. Зубные альвеолы формируются из окружающей зубные зачатки мезенхимы параллельно с формированием зубов. Таким образом, в составе зуба эмаль имеет эпителиальную природу.
Все остальные части зуба (дентин, цемент, пульпа зуба), а также связочный аппарат — это производные мезенхимы.
Закладка постоянных зубов происходит на 4-5-м месяцах эмбриогенеза, когда от зубной пластинки начинают формироваться вторые эмалевые зачатки. Развитие их происходит принципиально так же, как и молочных зубов.
Препарат 33.
| Развитие зуба: стадия гистогенеза зуба (в препарате 6.Срез челюсти зародыша). Окраска гематоксилин-эозином. |
(Нижеследующее описание основывается на материале раздела 23.2.6.10.)
А. Общие сведения
из эпителия ротовой полости происходят
эмаль и
её кутикула,из мезенхимы - остальные ткани зуба:
дентин,
пульпа,
цемент.
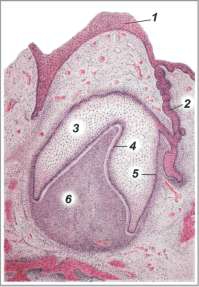
б) На этой стадии из образованных ранее компонентов зубного зачатка формируются ткани зуба:
из эмалевого органа (5-7) - эмаль (8) и кутикула,
а) (Малое увеличение)

из зубного сосочка (впячивания мезенхимы в эмалевый орган) - дентин (10) и пульпа зуба (11)
а из зубного мешочка (слоя мезенхимы вокруг зубного зачатка) - цемент зуба.
б) Но вначале укажем на окружающие образования:
многослойный эпителий (1) полости рта эмбриона;
идущий от него к эмалевому органу узкий эпителиальный тяж (4) ,
костные трабекулы (2) формирующейся челюсти и
мезенхиму (3) .
Теперь обратимся к гистогенезу зуба.
Б. Производные эпителия: э малевый орган ;
о бразование из него эмали и кутикулы
1. В ЭМАЛЕВОМ ОРГАНЕ имеются те же три компонента, что и на предыдущей стадии развития зуба:
наружный эмалевый эпителий ( 5 ),
эмалевая пульпа ( 6 ),
внутренний эмалевый эпителий ( 7 ).
поэтому в верхней части коронки наружный и внутренний эмалевые эпителии практически смыкаются друг с другом.
б ) А . Причём, внутренний эпителий теперь представлен зрелыми адамантобластами (7).
1. Продукт деятельности адамантобластов - эмаль.
2. Узкий слой образуемой эмали ( 8 на снимке а и 3 на снимке б ) виден в верхней части коронки зуба под адамантобластами (7 на снимке а и 2 на снимке б ) .
3. При этом вещества-предшественники эмали
вначале концентрируются в гранулах адамантобластов,
затем перемещаются в составе этих гранул в отростки клеток,
выделяются наружу и формируют предэмалевые призмы .
б) Большое увеличение 
С началом продукции эмали адамантобласты меняют свою полярность.
1. Так, вначале сторона клеток , обращённая к зубному сосочку, была базальной,
и, соответственно, отсюда происходило питание этих клеток.
2. Но когда сюда начинается выделение компонентов эмали,
данная сторона становится апикальной,
ядро перемещается на противоложную сторону,
и питание после этого идёт со стороны эмалевой пульпы ( 6 на снимке а ) .
наружного эмалевого эпителия (5 на снимке а и 1 на снимке б ) и
эмалевой пульпы ( 6 на снимке а).
В. Производные мезенхимы:
о бразование дентина , пульпы и цемента
1. Наружный слой клеток зубного сосочка на данной стадии представлен одонтобластами (или дентинобластами) (9 на снимке а и 5 на снимке б ).
2. Они (как и весь зубной сосочек) имеют мезенхимное происхождение .
3. Тем не менее, они во многом похожи на эпителиальные клетки адамантобласты (7 на снимке а и 2 на снимке б ):
тоже являются высокими и призматическими,
ориентированы перпендикулярно поверхности сосочка ,
б) Большое увеличение 
имеют на апикальной поверхности (обращённой к эмалевому органу ) отростки (не видимые на снимке).
4. Но , в отличие от адамантобластов, одонтобласты
не редуцируются впоследствии,
а сохраняются в качестве наружного слоя пульпы .
1. Продукт деятельности одонтобластов - ДЕНТИН (10 на снимке а и 4 на снимке б ).
2. Он формируется со стороны апикальной поверхности одонтобластов.-
Вначале одонтобласты выделяют (через свои отростки) органические компоненты будущего дентина,
которые образуют матрицу дентина - предентин .Затем секретируются минеральные вещества; они пропитывают матрицу.
При этом в округ самого длинного отростка остаётся дентинный каналец (чем обусловлена радиальная исчерченность дентина на препарате).
1. Под одонтобластами, в глубине зубного сосочка, мезенхимные клетки постепенно превращаются в соединительнотканные клетки ПУЛЬПЫ ЗУБА (11 на снимке а и 6 на снимке б ).
2. а) В определённое время эти клетки начинают с повышенной скоростью продуцировать аморфное вещество ткани.
б) Поэтому в пульпе возрастает давление, стимулирующее прорезывание зуба.
Ткани зуба у взрослых практически не способны к самостоятельной регенерации, и дефект эмали, возникающий в результате действия повреждающих факторов, постепенно приводит к потере зуба. Без сомнения, современные технологии протезирования позволяют произвести реконструкцию даже при полном отсутствии зубов. Однако прогресс современной органотипической регенеративной медицины подвигает исследователей к поиску технологий замещения зубов естественными трансплантатами.

Для формирования полноценной структуры зуба в эмбриогенезе необходимы клетки (энамелобласты, одонтоб-ласты), образование которых возможно только при взаимодействии клеток эктодермальной и мезенхимальной природы. Ткани зуба закладываются на 6-7-й неделе внутриутробного развития. Закладка их начинается с погружения эпителия ротовой полости в подлежащую мезенхиму. На эпителиальной зубной пластинке появляются мелкие выпячивания, называемые зубными зачатками, из которых будет развиваться молочный зуб. Эта структура образует эмалевый орган, а нижележащая мезенхима, заполняющая полость чаши, называется зубным сосочком.
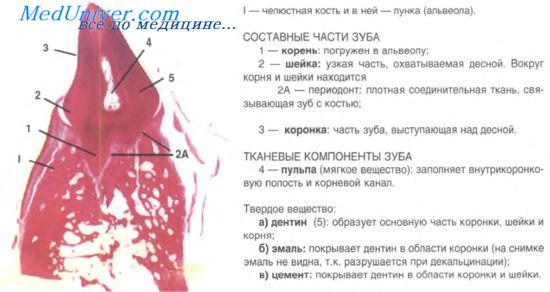
Дифференцировка зубных зачатков начинается с 3-го месяца внутриутробного развития, а к началу 5-го эмалевый орган утрачивает непосредственную связь с эпителием ротовой полости, хотя остатки зубной пластинки могут длительно сохраняться (иногда из них развиваются кисты). Незадолго до этого клетки зубной пластинки формируют второй эпителиальный зачаток, из которого будет развиваться постоянный зуб (рис. 1).
Рис. 1. Закладка зуба человека на стадии эмалевого органа.

1 - многослойный эпителий ротовой полости;
2 - зубная пластинка;
3 - эмалевый орган;
4 - внутренний эмалевый эпителий;
5 - наружный эмалевый эпителий;
6 - мезенхимальный зубной.
Окраска: гематоксилин и эозин. Из Sobotta J. Atlas und Grundriss der Histologie und Mikroskopischen Anatomie des Menschen. Мьпспеп, 1902, с изменениями.
Возможность существования малодифференцированных клеток пульпы впервые предположил Н. Taatz в 1965 году. Он обнаружил в пульпе зуба активные фибробластоподобные клетки, способные к культивированию in vitro. Уже в 1969 году в пульпе была обнаружена зона с активной клеточной пролиферацией. Эта область получила название зоны Уейла (zone of Weil). В ней были выявлены одонтобласты - клетки, активно синтезирующие внеклеточный матрикс с высоким уровнем щелочной фосфатазы в цитоплазме. Эти клетки, расположенные в виде трехмерной сети, также активно экспрессировали виментин. В дальнейшем было показано активное участие клеток пульпы этой области в регенерации зуба при кариозном процессе - вторичный (или репаративный) дентиногенез в самообновлении ткани зуба.
Основными клетками, поддерживающими вторичный дентиногенез, являются одонтобласты, которые, в свою очередь, происходят от проодонтобластов. Последние же возникают при взаимодействии мезенхимальных стволовых клеток (МСК) пульпы с прогениторными клетками ротового эпителия, активно экспрессирующего цитокератин 14 (СК-14). ДНК microarray-анализ МСК пульпы показал почти полное отсутствие различий между этими клетками и стромальными клетками костного мозга. Популяция пульпарных МСК неоднородна.
In vivo и in vitro только 2/3 из них способны к эктопическому образованию пульпы, а 1/3 имеют потенцию к дифференцировке в другие клетки мезенхимальных тканей и даже в нейральные клетки.
В настоящее время технологии создания артифициального зуба (дентогенез) методами тканевой инженерии развиваются двумя основными путями. Первый путь - так называемый прямой дентогенез. От плода получают закладки зуба (зубная пластинка, эмалевый орган, зубной сосочек). Клеточная масса, состоящая из энамелобластов, одонтобластов и малодифференцированных эпителиальных и мезенхимальных клеток, суспензируется и совместно культивируется. В качестве матрицы используют биодеградируемые полимеры на основе органических кислот (PGA, PGLA), которым придают трехмерную форму зуба. Культура клеток наносится на матрицу, и препарат пересаживается в альвеолу челюсти, где под воздействием факторов клеточного и тканевого микроокружения происходит дентогенез.
Второй путь - непрямой дентогенез, при котором развитие происходит внеальвеолярно. После выделения, кокультивирования и нанесения на матрицу клеток закладки зуба тканеинженерная конструкция пересаживается в мягкие ткани, не относящиеся к ротовой полости (сальник, околопочечная клетчатка, подкожная жировая клетчатка) на срок от 20 до 35 недель. По истечении указанного времени происходит образование ткани зуба за счет ближайших межклеточных взаимодействий (рис. 2, 3).
Рис. 2. Артифициальный зуб крысы, сформированный в подкапсульном пространстве почки из мезенхимальных
стволовых клеток и клеток эпителия ротовой полости через 12 недель после пересадки.

DP - пульпа зуба
(J Dent Res 2004; 83; 7: 523-528).
Рис. 3. Макропрепарат (А) и рентгенограмма (В) артифициального зуба крысы, сформированного в подкапсульном пространстве почки из мезенхимальных стволовых клеток и клеток эпителия ротовой полости
через 12 недель после пересадки. (J Dent Res 2004; 83; 7: 523-528).

Однако, у аллографтинга есть ряд известных недостатков. Поэтому дентогенез из аутогенных тканей имеет явные преимущества. Оказалось, что для формирования ткани зуба важны, прежде всего, низко дифференцированные эпителиальные клетки ротовой полости, а мезенхимальные клетки могут иметь отличное от мезенхимы краниальной части эмбриона происхождение. Так, в эксперименте при кокультивировании стромальных клеток костного мозга и эпителия эмалевого органа можно получить сформированную структуру зуба. Таким образом, имеются доступные клеточные источники для дентогенеза у взрослого организма, что позволяет отказаться от использования аллогенного клеточного материала.
Создание тканеинженерных конструкций для дентогенеза de novo - реальность сегодняшнего дня. Основной проблемой можно считать обеспечение кровоснабжения артифициального зуба после графтинга, так как технология прямого дентогенеза в клинической практике может вызвать ряд неудобств в течение как минимум 30-35 недель, связанных с созданием определенных условий микроокружения для развивающегося зуба. Нельзя не отметить, что создание зуба как органа de novo можно считать прорывом в реконструктивной стоматологии. Об этом свидетельствуют и поток публикаций, и внимание частных компаний (Odontis Ltd), формирующих «новый бизнес» в стоматологической имплантологии.

Сегодня около 150 миллионов взрослых в мире страдают от потери зубов, и, по прогнозам, в течение текущего десятилетия будет зарегистрировано более 10 миллионов новых случаев эдентулизма [1; 2]. В течение жизни большинство взрослых сталкивается с проблемами потери зуба(ов) вследствие генетических нарушений или заболеваний бактериального происхождения, воздействия ятрогенных, травматических или терапевтических факторов, а также недостаточной гигиены полости рта 1. В настоящее время в качестве методов лечения / замены зубов активно используются такие стоматологические клинические процедуры, как лечение корневых каналов и имплантация зубов, однако это со временем ведет к снижению чувствительности зубов и потере жизнеспособности, а также нарушениям распределения механической нагрузки при жевании и движению альвеолярных костей 7. Несомненно, эти недостатки обусловливают постоянный поиск альтернативных методов лечения и восстановления утраченных зубов. В последнее время все более активно обсуждаются возможности создания биоинженерных конструктов – зубов с применением биоинженерных скэффолдов, стимуляции формирования третичного дентина, клеточной терапии, гибридных тканеинженерных систем, генноопосредованной регенерации зуба [2; 7-9].
Несомненно, подходы тканевой инженерии и клеточных методов лечения способствуют регенерации более предсказуемым образом и позволяют расширить терапевтические границы регенеративной терапии. В последние годы получено достаточное количество данных о возможности выделения стволовых клеток из пульпы зубов как детей (молочные зубы), так и взрослых 11. Эти данные имеют существенное значение, поскольку возможность получения стволовых клеток из зубов не несет никаких этических противоречий в отличие от эмбриональных стволовых клеток, является неинвазивной и гораздо более экономически выгодной процедурой, возможной к выполнению в течение всей жизни человека [13; 14]. Также, по данным последних проведенных исследований, выживать и сохранять свой регенеративный потенциал могут даже стволовые клетки, выделенные из зубов с пульпитом [15]. Основная популяция клеток, которые могут быть получены из пульпы зуба, - мезенхимальные стволовые клетки (МСК). В качестве возможных источников взрослых МСК для регенерации зубов сегодня рассматриваются несколько типов клеток - это МСК зуба [10], а также МСК из незубных интраоральных источников, прежде всего – слизистой оболочки щеки, десны, надкостницы, и МСК из других источников: костного мозга, жировой ткани, пупочного канатика [11; 12]. Эти клетки способны к самообновлению и мультилинейной дифференцировке, характеризуются высокой способностью к пролиферации и сегодня рассматриваются как перспективные возможные источники для применения в регенеративной стоматологии.
Цель исследования: разработка протокола выделения МСК из пульпы удаленных по ортодонтическим показаниям третьих моляров, сравнение дифференцировочного потенциала и фенотипа поверхностных антигенов с характеристиками МСК, полученных из других источников и охарактеризованных согласно существующим паспортам клеточных линий (данные Российской коллекции клеточных культур (РККК)).
Материалы и методы
В исследовании были использованы удаленные по ортодонтическим показаниям третьи моляры (n=20) пациентов обоего пола в возрасте 16-35 лет, без видимых кариозных поражений и признаков воспаления. Получено информированное согласие пациентов в письменной форме на удаление зубов и последующее выделение из них МСК для исследовательских целей.
Удаленный хирургическим путем зуб помещался в стерильный пластиковый контейнер, содержащий 5 мл стерильного физиологического раствора с 0,02% антибиотика (пенициллин-стрептомицин). Контейнер осторожно запечатывался и помещался в транспортный сосуд с заданной температурой +2+4 °С. Время от забора до поступления образца в лабораторию не превышало 2 часов.
В лаборатории поверхность зуба трижды очищалась и промывалась стерильным физиологическим раствором комнатной температуры. Выделение клеток из пульпы зуба проводилось ферментативным способом. Для этого зуб помещался в чашку Петри диаметром 60 мм, где проводилось предварительное промывание пульпарной камеры зуба 2 мл 0,5%-ного раствора коллагеназы II типа, после чего зуб находился в 2 мл 0,5%-ного раствора коллагеназы II типа в течение 1 часа при 37 °C. Затем выделенные клетки в 2 мл раствора коллагеназы II типа были собраны в пробирку объемом 15 мл, куда для остановки процесса ферментации было добавлено 3 мл рабочей питательной среды - DMEM/F12 в соотношении 1:1 (ПанЭко). Полученная клеточная суспензия центрифугировалась в течение 5 мин на 1000 об/мин при комнатной температуре. Супернатант тщательно отбирался, после чего клеточный осадок был ресуспендирован в 1 мл полной питательной среды, содержащей DMEM/F12 в соотношении 1:1, 10% FBS, 100 мкМ L-аскорбиновой кислоты,2 mM L-глутамина, 100 U/мл пенициллина, 100 мг/мл стрептомицина и 0,25 мг/мл амфотерицина B 19. Полученная суспензия клеток пульпы зуба помещалась на культуральные планшеты 25 см 2 , содержащие полную питательную среду, и в дальнейшем инкубировалась при 37 °C и 5% CO2.
Замена культуральной среды проводилась 1 раз в 2-3 дня до достижения конфлюентности 80%. Пересев культур проводился согласно стандартному протоколу пересева монослойных культур в соотношении 1:3 1 раз в 7-8 дней. Для дальнейшего анализа использованы клетки на 2-3 пассажах.
Анализ характеристик клеточной популяции
Для определения соответствия выделенных клеток фенотипическим маркерам МСК оценивали ряд критериев: морфологический критерий, экспрессия типичных поверхностно-клеточных маркеров, способность к дифференцировке в определенные типы клеток. Оценка формы клеток выполнялась методом световой микроскопии. Анализ характерных для МСК маркеров (наличие CD73, CD90, CD105, отсутствие CD14, CD20, CD34, CD45) выполнен методом проточной цитофлуориметрии (проточный цитофлуориметр Beckman Coulter, FC500; набор для анализа MSC phenotyping kit, human, #130-095-198, Miltenyi Biotec) согласно инструкции производителя.
Проанализирована способность выделенных клеток дифференцироваться в остео- и хондрогенном направлении, а также способность дифференцироваться в специфические клетки – одонтобласты. С целью определения свойственной МСК способности дифференцироваться в остео- и хондрогенном направлении выделенные клетки в концентрации 1 × 10 4 клеток/см 2 внесены в два культуральных флакона 25 см 2 (Corning-Costar, #430372) с добавлением стандартных дифференцирующих сред (StemPrо, Chondrogenesis Differentiation Kit, #A1007101, Gibco; StemPro, Osteogenesis Differentiation Kit, #A1007201, Gibco) и помещены в СО2-инкубатор (37 °С, 5%СО2) в соответствии с инструкцией производителя и с заменой дифференцирующей среды каждые 3 дня, пересевом культуры 1 раз в 7-8 дней. Продолжительность культивирования клеток в данных условиях составляла 30 дней. По завершении периода дифференцировки анализировалась морфология дифференцированных клеток (световая микроскопия), проведена гистохимическая окраска (по Фон Коссу, с использованием железного гематоксилина и метахроматического красителя). Анализ экспрессии маркеров одонтобластов выполнен иммуноцитохимическим методом (стандартный протокол) с оценкой экспрессии характерного маркера – дентального сиалофосфопротеина (DSPP) [17; 20] в популяции МСК, дифференцированных используемой при остеогенной дифференцировке стандартной дифференцирующей средой (флуоресцентный имэджер ZOE, BioRad; первичные антитела anti-DSPP, Abcam, ab216892; вторичные антитела – антитела козы к IgG, IgA, IgM кролика с ФИТЦ (f-GAR Iss), Имтек).
Непрерывные переменные представлены в виде средних значений стандартного отклонения для числа наблюдений (среднее ± стандартное отклонение). Все данные проверены на нормальность распределения и равенства стандартного отклонения перед анализом. Сравнение непрерывных переменных выполнялось с использованием теста Стьюдента. Критерием достоверности является 95%-ный доверительный интервал (ДИ). Статистический анализ проводился с использованием программы Statistica, ver 11.0.
Результаты
Протокол выделения клеток составлен на основе собственного опыта работы с культурой МСК и разработан для источника – зуб человека с учетом современных данных [16-19; 21; 22]. Все процедуры выделения (n=20) клеток из удаленных зубов выполнены успешно. При динамическом наблюдении за культурами клеток к концу 1-х суток культивирования отмечено формирование колоний клеток. Большая часть клеток приобретала характерную для МСК [18; 22] фибробластоподобную форму (рис. 1А). При последующих заменах питательной среды все клетки имели характерную фибробластоподобную форму (рис. 1Б).
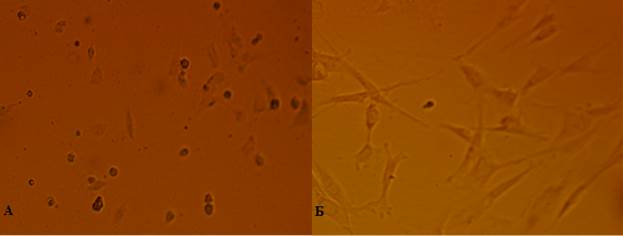
Рис. 1. А – клетки, выделенные из пульпы зуба через 24 часа культивирования. Б - клетки, выделенные из пульпы зуба, 10-е сутки культивирования
Анализ характеристик клеточной популяции
При определении принадлежности выделенных клеток к МСК проанализирована экспрессия характерных для МСК маркеров методом проточной цитофлуориметрии. Установлено, что выделенные из пульпы удаленных зубов культуры характеризуются высоким уровнем экспрессии характерных для МСК маркеров – CD90 и CD105, что составило 98,5 ± 3,8% и 96,8 ± 2,9% соответственно, и отсутствием экспрессии маркеров CD14, CD20, CD34 и CD45. Полученные результаты в сравнении с имеющимися паспортами клеток МСК из различных незубных источников (данные РККК, Российская коллекция клеточных культур позвоночных, Санкт-Петербург, ИНЦ РАН, 2016, составители Полянская Г.Г., Сакута Г.А., Еропкин М.Ю., Смирнова Т.Д., Подчерняева Р.Я., Михайлова Г.Р., Дьяконов Л.П., Гальнбек Т.В., Глинских Н.П., Бахарев А.А.) – костный мозг эмбриона, эмбриональные стволовые клетки, мышца конечности эмбриона, кожа век взрослого донора, позволяют достоверно отнести выделенные из пульпы зуба клетки к пулу МСК (таблица, рис. 2).

Рис. 2. Экспрессия маркеров CD90, CD105 МСК, выделенными из пульпы удаленных третьих моляров
Сравнительные характеристики МСК из различных источников (на основании данных паспортов клеточных линий РККК)
Читайте также:

