Биомодификация корней зубов это мероприятие направленное на
Опубликовано: 30.04.2024
Автор работы: Пользователь скрыл имя, 23 Октября 2011 в 16:48, курсовая работа
Краткое описание
Цель моей работы состоит в том, чтобы нагляднейшим образом показать слушателям (а кому-то напомнить), что происходит в полости рта при несоответствующем уходе и куда, а вернее к кому, это может привести.
Задачей же моего исследования было донести до слушателя, какие «нелицеприятные», а главное – пагубные для организма состояния несет в себе пародонтит и как эта проблема решается в хирургической практике.
Содержимое работы - 1 файл
хир методы лечения пародонтита.docx
Биомодификация корней зубов
Кроме остеопластических материалов и мембран при проведении лоскутных операций необходимо использовать биомодификацию (кондиционирование) корней зубов. Пародонтопатогенная микрофлора способствует возникновению заболевания несколькими способами. Первый заключается в продукции анаэробной флорой эндотоксинов, которые, накапливаясь в цементе зубов, активно поддерживают воспаление. Кроме того, эндотоксины угнетают рост фибробластов и не позволяют сформироваться надежному соединению периодонтальных структур с поверхностью корня. В принципе, при механическом удалении пораженного цемента возможен рост новых клеток и формирование зубодесневого соединения, однако в клинике полное удаление пораженного цемента и эндотоксинов невозможно. Более того: чрезмерно тщательная обработка влечет полное удаление цемента, и тогда либо регенерация периодонтальной связки не сопровождается приростом зубодесневого прикрепления, либо же формируется анкилоз. Поэтому в целях более полной детоксикации корней и последующего повышения регенеративных свойств поражённых пародонтальных структур корневые поверхности обрабатывают химическими препаратами.
ЛИМОННАЯ КИСЛОТА (ЛК) 18% концентрации обеспечивает (рН 1,0). Оптимальное время ее аппликации составляет 2-3 минуты. Сглаживание поверхности корня приводит к образованию “смазанного слоя”, но обработка ЛК устраняет этот слой. После этого формируется поверхность корня, покрытая коллагеном и расширенными дентинными канальцами. С ней более активно связываются все клеточные элементы, в первую очередь – из сгустка крови, которые, собственно, и формируют периодонтальную связку (ПДС). Существенно, что при этой методике, как и других, рассматриваемых нами, не происходит повреждения пульпы и мягких тканей.
ТЕТРАЦИКЛИНА ГИДРОХЛОРИД (ТГХ) также используют для удаления смазанного слоя поверхности корня после предварительной механической обработки. Его в виде кашицы накладывают на 3-5 минут, после этого обязательно следует обработанный участок промыть раствором фурациллина или перекиси водорода: сохранившиеся остатки препятствуют формированию кровяного сгустка. Кстати, зачастую требуется легкая травма внутренних поверхностей лоскута, чтобы получить необходимое количество крови. ТГХ обладает практически всеми теми же свойствами воздействия на поверхность корня, что и лимонная кислота, но сверх всего – антибактериальным эффектом на срок до 2 недель – особо необходимым для начала процессов репарации и регенерации.
Именно в связи с этим следует учитывать наличие у пациентов аллергии к препаратам группы тетрациклина, а также и чувствительности микрофлоры к нему.
Все перечисленное обеспечивает лучшее течение регенеративных и репаративных процессов в послеоперационном периоде. Следует учитывать, что эффект ЛК в отношении устранения загрязненного слоя и деминерализации, выше чем у ТГХ, однако длительный антимикробный эффект ТГХ – весьма привлекательная сторона этого препарата.
ФИБРОНЕКТИН, или ламинин, является высокомолекулярным гликопротеином. Одним из главных его свойств является клейкость, отсюда понятна и одна из главных особенностей: он не только стабилизирует кровяной сгусток, но и способствует адгезии клеток ко всем поверхностям внутри раневой поверхности, к коллагену и сглаженной поверхности. Его способность усиливать хемотаксис фибробластов и мезенхимальных клеток наряду с усилением их прикрепления к поверхности корня объясняет целесообразность его применения в пародонтальной хирургии в целях не только биомодификации, но и для улучшения условий процессов регенерации.
Консервативные методы лечения
Лечение воспалительных заболеваний пародонта преследует три задачи: воздействие на местный деструктивно-воспалительный очаг, патогенную микрофлору и реактивность организма.
До сих пор не потеряли своего значения механические методы обработки корней зуба с удалением различных видов зубных депозитов. Другая группа методов относится к хирургическому лечению заболеваний пародонта. В основе их лежит хирургическое удаление патологических десневых карманов с резекцией десны и формированием нормального десневого желобка, резекцией маргинальной кости с восстановлением ее нормальных контуров и другие резекционные методы.
В последние два десятилетия получило научное обоснование и практическое применение принципиально важное положение о том, что если удается справиться с патогенной пародонтальной инфекцией, то хирургическое вмешательство с удалением десневых карманов не является абсолютно неизбежным для успешного лечения пародонтита, ибо сочетание различных форм механической и противобактериаль-ной терапии позволяют не только приостановить деструктивно-воспалительный процесс, но и добиться регенерации мягких тканей пародонта (Page, 1993). Эти терапевтические методы оказались особенно эффективными, когда усиливались корригирующей и модифицирующей терапией выявленных дефектов общей реактивности организма пациентов и адекватным фармакологическим воздействием на локальный репаративно-регенеративный процесс в патологическом очаге.
Консервативные методы лечения воспалительных заболеваний пародонта А. П. Канканян и В. К. Леонтьев (1998) подразделяют на локальные и общие.
К основным локальным методам авторы относят:
- механическую терапию (обработка корней, удаление бляшек и другие);
- устранение факторов, приводящих к микротравматизации пародонта;
- соблюдение правил оральной гигиены и отказ от курения;
- местное применение антибактериальных средств;
- местное использование препаратов, подавляющих локальные деструктивно-воспалительные явления и способствующие регенерации.
Консервативные методы лечения воспалительных заболеваний пародонта направлены на восстановление гомеостаза его тканей. Они включают в себя использование лекарственных средств, купирующих патогенетические механизмы поражения пародонта. В арсенале этих препаратов часто используют нестероидные и стероидные противовоспалительные средства. Нестероидные препараты <аспирин, аклофенак, дифлузинал и др.) обладают противовоспалительным, жаропонижающим и болеутоляющим действием.
Стероидные лекарственные средства (глюкокортикоиды) Эффективно влияют на все фазы воспаления, способствуя их благоприятному завершению. Однако при их длительном применении может быть такое осложнение, как тканевая иммунодепрессия.
Другая группа включает в себя препараты, потенцирующие функцию циркулирующих лейкоцитов, которые препятствуют в очаге воспаления фиксации к тканям повреждающих агентов, увеличивают резистентность тканей пародонта (метронидазол).
Важное значение в лечении поражений пародонта имеет общеукрепляющая терапия, включающая в себя Седативные средства и Витаминотерапию В виде поливитаминных комплексов (комплевит, ген-девит, тетравит, ундевит и др.).
К средствам, обладающим выраженным регенераторным действием, относят производные гиалуроновой кислоты, на основе которой созданы остеотропные препараты направленной регенерации типа "Ги-алюк" (Безрукова А. П., Истранов Л. П., 1999).
Одним из важных компонентов комплексной терапии воспалительных заболеваний пародонта является антибактериальная терапия. Эффективность использования антимикробных средств при гингивите оценивается достаточно положительно. Менее выраженный клинический эффект отмечен при хроническом пародонтите, его прогрессирующих рефрактерных формах. Однако по мнению А. П. Канканяна и В. К. Леонтьева (1998), это обусловлено врачебными ошибками к определению показаний для локального или системного применения антибиотика, в адекватном применении препарата, при выборе схемы его назначения.
Проведение антибактериальной терапии предполагает выявление патогенных бактерий, содержащихся в зубных бляшках, и определение их чувствительности к антибактериальным препаратам. Однако в настоящее время повсеместное проведение этих микробиологических исследований из-за их сложности и дороговизны весьма затруднено. Поэтому основной принцип антибактериальной терапии сегодня состоит в использовании лекарств с широким спектром антимикробного направленного действия. При этом важно сохранить в ротовой полости присутствие нормальных сапрофитов, что является важной мерой профилактики рецидивов воспаления пародонта и возникновению кандидоза(Кравченко В. В., Решетникова В. П., 1999).
Антибактериальные средства подразделяют на Неспецифические антимикробные препараты и антибиотики.
Неспецифические антимикробные препараты Обеспечивают антибактериальный эффект при местном применении. Их назначают для профилактики образования или удаления бактериальных зубных бляшек. Наиболее популярные современные неспецифические препараты представлены в табл. 14.
К широко применяемым методам местного использования препаратов (орошение, полоскание, аппликация, ирригация) присоединились новые фармацевтические технологии.
Вопрос об энтеральном и парентеральном использовании антибиотиков при гингивите и пародонтите изучается постоянно, но не следует ожидать предложений по каким-то определенным фиксированным схемам их применения. Солидный материал отечественных и зарубежных исследователей по основным препаратам для лечения пародон-тальной инфекции представлен в работе А. П.Канканяна и В. К.Леонтьева (1998) (табл. 15).
Учитывая важную роль антибактериальных препаратов в лечении гингивита и пародонтита, а также их большой арсенал, стоматолог должен постоянно держать в поле зрения вопрос об их побочном действии, как при местном, так и неместном применении, педантично каждый раз обращаясь к аннотациям этих препаратов и фармакологическим справочникам. Это поможет избежать ряда серьезных осложнений: аллергических реакций, грибковой инвазии, подавления нормальной микрофлоры ротовой полости, псевдомембранозного колита и других.
А. П. Зузова, A. C. Забелин (2002) предлагают дифференцированный подход к антибактериальной терапии при воспалительных заболеваниях пародонта. Авторы установили, что при гингивите резиду-альная флора, как правило, замещается грамотрицательной анаэробной. При остром процессе обнаруживают Р. gingivalis, а при хроническом - Р. intermedia. У больных СПИДом частым возбудителем гингивита является С. rectum. Во всех случаях наиболее эффективным является Фенокиметилпенициллин. При необходимости второго курса лечения авторы рекомендуют Метронидазол, Или Сочетание метрони-дазола с бензилпенициллином. При пародонтите микробный профиль возбудителей более разнообразный. У взрослых при пародонтите наиболее часто выделяют пигментированные бактероиды (Р. gingivalis, P. intermedia, P. melaninogenica). В ювенильном возрасте очень быстро в процесс вовлекается костная ткань, где ведущую роль играет А. actinomycetemcomitans. Здесь препаратами выбора являются Доксициклин Или Тетрациклин в сочетании с амоксициллином (клавулана-том). При отсутствии этих антибиотиков можно назначить Спирамицин, спирамицин с метронидазолом, цефуроксим аксетил, цефаклор, метронидазол. Больным с нейтропенией или лейкопенией после химиотерапии назначают Пиперациллин (тазобактам, тикарциллин/кла-вуланат) с аминогликозидами, имепенем (Зузова А. П., Забелин A. C., 2002).
Филатовский стебель. При пластических операциях на поверхности тела широко пользуются перемещением кожных лоскутов на восстанавливаемый участок с прилежащих мест или других участков тела (см. Кожная пластика). Предложенная В. П. Филатовым методика формирования кожного лоскута на питающей ножке (рис. 4) значительно расширила сферу применения кожной пластики, позволила использовать кожные лоскуты для создания недостающих или утраченных органов (пальцы, половой член, нос, ушные раковины и т. д.)
Регенерация в пародонтологии- одно из ключевых направлений современной науки и клинической практики. В данном материале представлена вторая часть материала по этой важной теме.
Концепции регенерации
Один из первых методов, используемых в попытках получить новое прикреплением был скейлинг и обработка корней (т.е. удаление патологически измененного корневого цемента и эпителия кармана). Исследования с участием людей (например, McCall 1926; Orban 1948; Beube 1952; Waerhaug 1952; Schaffer & Zander 1953; Carranza 1954, 1960) и на животных (например, Beube 1947; Ramfjord 1951; Kon et al.1969) показали, что этот тип пародонтальной терапии привел не только к улучшению состояния десны, но и к снижению первоначальной глубины кармана.
Это уменьшение глубины пародонтального кармана считалось отчасти результатом усадки первоначально воспаленной десны, но частично также с эффектом формирования нового прикрепления соединительной ткани в апикальной части кармана.
Возможность получения нового прикрепления стала широко применяться после работ Prichard (1957), в которых формирование нового прикрепления во внутрикостных дефектах тканей пародонта были описаны как предсказуемый результат лечения. Были представлены 17 случаев, из которых 4 были подвергнуты повторной хирургической процедуре. В них было выявлено формирование новой костной ткани в области дефектов.
Техника Prichard (1957, 1960) была использована только для лечения трехстеночных внутрикостных дефектов, а полученные результаты предполагают что морфология дефектов была важна для создания предсказуемого прогноза. Goldman and Cohen (1958) представили классификацию внутрикостных дефектов тканей пародонта, которая была основана на количестве костных стенок, окружающих дефект, были выделены трех- двух или одностеночные дефекты или их комбинации (рис. ниже).
Техника Prichard (1957, 1960) включала откидывание лоскута , чтобы получить доступ к дефекту, удаление грануляционной ткани внутри дефекта, скейлинг и полировка корней. Для улучшения регенерации кости были сделаны небольшие перфорации с помощью бора в нескольких местах кости. Лоскут ушивают для достижения полного покрытия дефекта. Многие клинические исследователи утверждают, что недостаточно свидетельств успешного восстановления прикрепления (Patur &Glickmann 1962; Wade 1962, 1966; Ellegaard & Löe1971). Patur и Glickmann (1962) сообщили о клиническом исследовании, включающим 24 внутрикостных дефекта, обработанных по методике Prichard . Результат оценивали путем сравнения предоперационных и послеоперационных рентгенограмм, измерений уровня альвеолярного отростка, прилегающего к корню. Также изучали образцы, взятые во время операции и после операции после откидывания щечных и язычных лоскутов.
Авторы сообщили, что произошло восстановление прикрепления в двухстеночных и трехстеночных дефектах, в одностеночных дефектах такого эффекта не наблюдали. Результаты исследования Ellegaar и Löe (1971), включающие 191 дефект у 24 пациентов при заболеваниях пародонта указали, что регенерация, определенная рентгенологически и зондированием пародонта имела место примерно в 70% случаев в трехстеночных дефектах, в 40% в комбинированных дефектах и в 45% случаев при двухстеночных.
В более позднем исследовании Rosling et al. (1976) 124 внутрикостных дефекта у 12 пациентов были прооперированы с помощью модифицированого лоскута Widman (Ramfjord & Nissle 1974). После лечения пациентов вызывали два раза в месяц для профессиональной гигиены зубов. Повторное обследование, проведенное клинически и на рентгенограммах через 2 года после терапии, продемонстрировало заполнение костной тканью 2,3-стеночных дефектов. Авторы предположили, что этот рост кости также был связан с образованием нового прикрепления и приписывают успешное лечение в основном оптимальному уровню гигиены полости рта, который поддерживался у всех пациентов во время заживления. Клиническое исследование с почти идентичными результатами было представлено Polson and Heijl (1978). Результаты нескольких гистологических исследований на животных и людях, с другой стороны, указывают на то, что формирование нового пародонтального прикрепления отнюдь не предсказуемо после открытого кюретажа или лоскутной операции Listgarten & Rosenberg 1979;Caton & Nyman 1980; Caton et al. 1980; Steiner et al.1981; Stahl et al. 1983; Bowers et al. 1989a)
Прогрессирование пародонтита с разной скоростью на соседних поверхностях зубов приводит к развитию внутрикостных дефектов. В зависимости от количества окружающих костных стенок такие дефекты классифицируются как одностенные (а), двухстенные (b) или трехстенные дефекты (с).

Графтинг
В ряде клинических испытаний и экспериментах на животных, лоскутная операция комбинировалась с применением костных трансплантатов или материалов в предварительно обработанный костный дефект с целью стимуляции регенерации пародонта. Все материалы для трансплантации и имплантации можно разделить на четыре категории:
1. Аутогенные трансплантаты: трансплантаты, перенесенные из одного участка к другому внутри одно и того же индивидуума. Этот тип графтинга предполагает использование кортикальной и губчатой костной ткани и костного мозга. Материал получается из интро- или экстраоральных донорских участков.
2. Аллогенные трансплантаты: трансплантаты, полученные от генетически различных представителей одного вида. Например, замороженная губчатая костная ткань или костный мозг.
3. Ксеногенные трансплантаты: трансплантаты, полученные от донора другой вид.
4. Аллопластические материалы: синтетические или неорганические имплантаты, которые используются в качестве заменителей костной ткани.
Применение различных графтов обосновано тем, что при их применении с одной стороны стимулируется образование новой костной ткани, а с другой формирование нового прикрепления. Это связано с тем, что эти материалы (1) содержат остеообразующие клетки (остеогенез), (2) служат каркасом для формирования кости (остеокондукция), (3) матрица трансплантатов содержит костный вещества‐индукторы (остеоиндукция) (Urist 1980; Brunsvold & Mellonig 1993).
Регенерация прикрепления после графтинга основана на представлении о том, что клетки костной ткани способны формировать новый цемент со вставками коллагеновых волокон на поверхностях корней, ранее вовлеченных в пародонтит (Melcher et al. 1987). Это мнение вступает в противоречие с современными знаниями о биологии заживления в пародонтологии. Известно, что необходимым условием для формирования нового прикрепления является повторное заселение отделенной поверхности корня клетками периодонтальной связки. Это означает, что все лечебные процедуры, связанные с размещением костных трансплантатов или заменителей кости, основываясь на биологической концепции, не могут объяснить регенерацию пародонта.
Эффект от применения костных трансплантатов или аллопластических материалов для регенерации пародонта в большинстве отчетов основывался на данных осмотра, в то время как гистологических доказательств формирования прикрепления было очень мало.
Данные отчетов сильно различаются и представленные документы, как правило, состояли из данных пред и послеоперационного зондирования, уровня прикрепления (PAL), рентгенографических описаний.
Биомодификация поверхности корня
Многие исследования были направлены на изучение состояния поверхности корня, измененного пародонтитом. Воздействие на него должно быть таким, чтобы способствовать формированию новой соединительной ткани. Удаление бактериальных отложений, камней и эндотоксинов из цемента считается необходимым для формирования новой соединительной ткани (Garrett 1977). Тем не менее, было исследовано Stahl et al. (1972), что деминерализация поверхности корня с обнажением коллагена дентина, будет способствовать отложению цемента, индуцируя мезенхимальные клетки в соседних тканях, которые в свою очередь будут дифференцироваться в цементобласты.
Биологическая концепция заключается в том, что воздействие коллагеновых волокон матрицы дентина может способствовать адгезии сгустка крови к поверхности корня и тем самым способствует миграции фибробластов. Однако эта концепция сомнительно соответствует современным знаниям о заживлении пародонта, так как нет доказательства того, что воздействие коллагеновых волокон матрицы дентина облегчает репопуляцию поверхности корня клетками, происходящими из периодонтальной связки. Как упоминалось ранее, клетки периодонтальной связки необходимы для создания нового прикрепление соединительной ткани.
Несколько исследований с использованием различных моделей животных продемонстрировали улучшенные гистологические результаты после применения лимонной кислоты и тетрациклина для деминерализацииповерхности корня(Register & Burdick 1976; Crigger et al. 1978; Polson & Proye 1982; Claffey et al. 1987). Тем не менее, в исследовании на собаках, где естественно возникающие дефекты фуркации обрабатывали лимонной кислотой, несколько образцов продемонстрировали анкилоз и резорбцию корня (Bogle et al. 1981). Этот вывод подтверждает выводы Magnusson et al. (1985) у обезьян, где лимонная кислота наносилась на поверхность корня с последующим апикальным смещением лоскута. Результаты оценивали после 6 месяцев. Эти исследователи также обнаружили резорбцию корня на 28 из 40 исследованных поверхностей и 21 из них также показал анкилоз.
Новое соединение после обработки лимонной кислотой для деминерализация поверхности корней было продемонстрировано гистологически у людей (Cole et al. 1980; Frank et al. 1983; Stahl et al. 1983; Stahl & Froum 1991). Cole и соавт. (1980) показали гистологическое доказательство нового прикрепления соединительной ткани и образование содинительной ткани апикальней контрольной выемки на поверхности корня. Однако, несмотря на гистологические доказательства регенерации после биомодификации поверхности корня лимонной кислотой, в результате контролируемых клинических исследований не удалось показать каких-либо улучшений в клинических условиях по сравнению с контрольной группой, где не использовали кислоту (Moore et al. 1987; Fuentes et al. 1993).
Модификация корневой поверхности с использованием местно наносимых белков эмалевого матрикса (Emdogain®) во время операции и после деминерализации этилендиаминтетрауксусной кислотой (ЭДТА) были введены для усиления регенерации пародонта. Биологическая концепция заключается в том, что применение эмалево матричных белков (включая амелогенины) может способствовать регенерации пародонта, потому что они имитируют события, которые происходят во время синтеза тканей пародонта (Hammarström 1997; Gestreliusи другие. 2000). Это мнение основано на выводе о том, что клетки эпителиального Гертвиговского влагалища и белки эмалевого матрикса на поверхности корня являются клетками-предшественниками цемента, и что эти белки являются инициирующими факторами образования цемента.
Коммерчески доступный продукт Emdogain®, очищенный кислотный экстракт свиного происхождения, содержит производные матрицы эмали(EMD), которые должны способствовать регенерации пародонта. Тем не менее, не совсем ясно, как эта концепция сочетается с современными знаниями о заживлении пародонта, так как не было предоставлено никаких доказательств того, что клетки, полученные из периодонтальной связки необходимы для заселения поверхности корня после обработки. Тем не менее, исследование на собаках (Araùjo et al. 2003), где повторно имплантировали корни, которые были извлечены и лишены жизненно важных цементобластов и впоследствии обработаны EMD, показало, что не удалось предотвратить анкилоз и резорбции корня. Это указывает на то, поверхности не заселялись клетками способными образовывать цемент. В последующем исследовании in vitro также не удалось подтвердить, что EMD имеют какое-либо существенное влияние на пролиферацию клеток периодонтальной связки (Chong et al. 2006).
В отчетах, описывающих серии случаев, где отмечалось увеличение клинического прикрепления на 4–4,5 мм и 70% заполнения внутрикостных дефектов, были зарегистрированы после лечения с EMD (Heden et al. 1999; Heden 2000). В многоцентровом клиническом исследовании с участием 33 пациентов с 34 парными внутрикостными дефектами применение EMD привело к увеличению прироста PAL( прикрепленной десны) на 2,2 мм и статистически значимому приросту костной ткани (2,6 мм) по сравнению со случаями, когда только откидывался лоскут и проводилось удаление зубных отложений. Оценка проводилась через 36 месяцев клинически и рентгенографически (Heijl et al. 1997). Подобные результаты были зарегистрированы в другом клиническом испытании(23 пациента) (Froum et al. 2001). В этом исследовании уменьшение глубины зондирования (PPD) на 4,9 мм, PAL прирост на 4,3 мм и прирост кости на 3,8 мм (оценивается после повторной операции) наблюдались после применения EMD в 53 внутрикостных дефектов. Эти значения были статистически значимее, чем полученные после лоскутной операции (2,2 мм, 2,7 мм и 1,5 мм соответственно с 31 дефектом).
В проспективном многоцентровом рандомизированном контролируемом клиническом исследовании сравнивали клинические исходы лоскутной операции с сохранением сосочков (SPPF) с применением или без применения белков эмалевого матрикса (Tonetti et al.2002). Всего 83 тестовых и 83 контрольных пациентта с аналогичными исходными условиями тканей пародонта и характеристиками дефектов были прооперированы либо SPPF + Эмдогейн® либо только с SPPF. Изменения проявлялись значительно более высоким уровнем клинического прикрепления(CAL), чем в контрольной группе (3,1 ± 1,5 мм и 2,5 ± 1,5 мм соответственно).
Когда применение EMD сравнивалось с НТР техникой , были получены аналогичные клинические улучшения. В рандомизированном контролируемом клиническом исследовании Pontoriero et al. (1999) сравнил EMD с НТР, при этом использовались как резорбируемые (два вида: Guidor и Resolut), так и нерезорбируемые (e-PTFE) мембраны во внутрикостных дефектах. Через 12 месяцев не было никаких существенных различий между группами. Применение EMD привело к уменьшение глубины зондирования на 4,4 мм и увеличению PAL на 2,9 мм, в то время как соответствующие значения из участков, где применялись мембраны (обе группы НТР объединены)были 4,5 мм и 3,1 мм соответственно. Silvestri et al. (2000) сообщили о снижении PPD на 4,8 мм и увеличении PAL на 4,5 мм после применения EMD во внутрикостных дефектах против 5,9 мм и 4,8 мм соответственно после применения направленной тканевой регенерации с нерассасывающимися мембранами. Подобные результаты были сообщены другими исследователями (Sculean et al. 1999a, b; Silvestri et al.2000, 2003; Sanz et al. 2004). Существуют исследования, показывающие, что после применения EMD при внутрикостных дефектах, клинические улучшения могут достигаться путем дополнительного использования костных трансплантационных материалов (Zucchelli et al. 2003; Gurinsky et al. 2004; Trombelli et al. 2006), хотя другие не смогли продемонстрировать положительный эффект этого сочетания в лечении (Sculean et al. 2005).
Гистологическое подтверждение образования нового цемента с вплетение коллагеновых волокон на пораженной ранее пародонтитом поверхности корня и формирование новой альвеолярной кости в образцах человека были продемонстрированы после лечения EMD (Mellonig 1999; Sculean et al. 1999b). Однако в исследование Mellonig (1999) восстановление произошло бесклеточным цементом на поверхности корня, в то время как образовавшийся цемент в исследовании Sculean et al. (1999b) был преимущественно клеточный. Способность EMD к активации регенерации была подтверждены в контролируемых экспериментах на животных, после обработки внутрикостных и фуркационных дефектов(Hammarström et al.1997; Araùjo & Lindhe 1998; Sculean et al. 2000). В более позднем исследовании на обезьянах было показано, что совместное применение EMD и аутогенных костных трансплантатов может улучшить регенерацию пародонта по сравнению с одной только лоскутной операцией (Cochran et al. 2003).
а) Микрофотография дефекта фуркации III степени у собаки после биомодификации корневой поверхности эмалевым матричным протеином и покрытием рассасывающейся мембраной. Дефект был полностью восстановлен костной тканью (NB), периодонтальной связкой (P) и новым цементом (NC). Стрелки указывают на апикальное расширение поражения. b) цемент (NAC), образованный на поверхности корня в апикальной части дефекта, бесклеточный по структуре с включением внешних коллагеновых волокон (ECF), в то время как (c) новый клеточный цемент образовался в корональной части (NCC).

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Можно ли вылечить периодонтит? Вполне ожидаемый вопрос от многих пациентов, страдающих от хронического воспалений десен, периапикальных тканей. Ответ неоднозначен. Все зависит от формы процесса, вида воспаления, то есть от того как классифицируется периодонтит.
При условии своевременного обращения к стоматологу прогноз лечения может выглядеть таким образом:
Когда ожидается результат
Нужно ли дальнейшее наблюдение
Полная компенсация функции зуба - 55-60%
Сразу после окончания последнего этапа лечения
Если человек не обращается к врачу и пытается лечить периодонтит самостоятельно:
Когда ожидается результат
Нужно ли дальнейшее наблюдение
Полная компенсация функции зуба – 15-20%
Через 3-6 месяцев
Часто, возможны с осложнениями
Современная стоматология владеет множеством методик, способов и технологий в курации довольно сложных процессов, к которым относится и периодонтит. Однако вопрос – можно ли вылечить периодонтит, напрямую связан со степенью запущенности процесса и зоной его распространения.
Методы лечения периодонтита
Методика терапевтических действий, помогающих курировать и нейтрализовать последствия периодонтита, делится на две категории:
- Консервативная терапия.
- Хирургическое лечение.
Консервативная терапия может проводиться медикаментозно, в комплексе с физиотерапией, но также физиопроцедуры могут быть самостоятельным и единственным необходимым согласно показаниям лечением. Терапевтическое лечение предполагает вскрытие, санацию канала, а также дальнейшее его закрытие пломбой. Обычно первое посещение врача заканчивается установка временного пломбировочного материала, второй визит может завершить лечение. Следует отметить, что хронический периодонтит лечится долго, и одного-двух визитов недостаточно. Мероприятия по курированию состояния периодонта могут растянуться на месяцы, тем не менее, это необходимо, так как осложнения придется лечить уже хирургическим путем.
Физиотерапевтический метод очень эффективен в лечении фиброзного периодонтита или же как вспомогательный способ, ускоряющий процесс восстановления тканей периодонта. Что может быть назначено в качестве физиотерапии:
- Электрофорез с введением внутрь канала раствора йодистого калия.
- УВЧ на зону воспаления.
- Лазеротерапия.
- Магнитотерапия.
- МРТ.
- Парафиновые аппликации.
Хирургические методы лечения периодонтита – это крайняя мера, однако в запущенных процессах, при острых, угрожающих состояниях она бывает необходима:
- Резекция апекса корня зуба.
- Коронорадикулярная сепарация - рассечение многокорневого зуба, дальнейший кюретаж.
- Цистомия – иссечение поврежденной ткани (кисты).
- Цистоэктомия – иссечение пораженной ткани периодонта и части верхушки корня.
- Экстракция зуба.
Современная стоматология стремится к максимально щадящему лечению и направлена на сохранение целостности зубочелюстной системы, поэтому удаление зубов сегодня проводится лишь в крайних случаях. А если это неизбежно, то экстракция совершенно безболезненна, что обусловлено применением эффективных анестетиков и новых хирургических технологий.
Этапы лечения периодонтита
Лечение периодонтита зависит от его вида и формы, но есть один объединяющий критерий – оно практически всегда многоэтапно. Это связано со сложным течением заболевания, затрагивающего различные структуры – ткань периодонта, костную ткань, ткань десны.
Этапы лечения периодонтита в хронической форме:
Терапия хронического периодонтита также может быть разной. Все зависит от того, какой процесс – фиброзный, гранулирующий или гранулематозный. Как правило, фиброзное хроническое воспаление периодонта проводится в 2 этапа. Порой достаточно прочистить каналы, поставить пломбы, которые закрепляются как постоянные уже во время второго визита к врачу. Гранулирующая форма воспаления так же, как и гранулематозный периодонтит лечится намного дольше, порой до полугода. Минимальное количество визитов к стоматологу – четыре.
- Диагностика и рентген.
- Обезболивание.
- Удаление пораженных кариесом тканей.
- Создание доступа к каналам корня.
- Удаление пульпы.
- Обработка каналов инструментальным способом (расширение).
- Санация каналов с помощью антисептика.
- Введение временной пломбы.
- Назначение дополнительной терапии - антибиотики.
Второе посещение стоматолога:
- Извлечение временной пломбы.
- Извлечение лекарственного средства из канала.
- Санация канала антисептиками.
- Очередное пломбирование каналов более плотным материалом, помогающим восстановить костную ткань. Пломба ставится на 2-3 месяца.
Третий визит к врачу:
- Рентген.
- Удаление временной пломбы и очередная санация каналов.
- Закрытие зуба постоянной пломбой.
- Рекомендации по лечению и профилактике кариеса.
Четвертый визит (спустя 2-3 месяца)
- Контрольный рентгеновский снимок.
- Осмотр полости рта.
- Назначение профилактических мероприятий по предупреждению рецидива воспаления.
- Острый периодонтит лечится, как правило, ургентно, когда пациент обращается к врачу с острой, непереносимой болью.
Этапы лечения периодонтита в острой форме:
- Рентген cito.
- Анестезия, обезболивание.
- Высверливание, удаление пораженных кариесом тканей.
- Удаление омертвевшей пульпы.
- Санация каналов зуба.
- Возможен разрез и дренаж десны для обеспечения отхождения, оттока экссудата или гноя.
- Назначение антибиотиков, нестероидных противовоспалительных препаратов, реже – антигистаминных средств. При сохранении болевого симптома назначение обезболивающих препаратов.
- Второе посещение врача необходимо спустя 2 дня, когда вновь санируются каналы, в них закладывается лекарство и ставится временная пломба.
- Третий визит – это очередная обработка каналов, санация, рентген для контроля состояния периодонта, установка постоянной пломбы или экстракция несохранного зуба, что бывает крайне редко на этом этап.
Ошибки при лечении периодонтита
Главная причина, по которой возможны ошибки при лечении периодонтита, это неправильная диагностика, при которой неточно определяется первопричина, следовательно неверно классифицируется процесс, как следствие, терапевтические действия не приносят результата или сопровождаются осложнениями. Важным моментом в диагностике считается тщательное и комплексное обследование больного, большую роль в котором играет рентген зуба и альвеолярных отростков. Точно определяя состояние апикальных тканей, врач может выбрать действительно результативную терапевтическую стратегию. Если этого не происходит, зуб, как правило, удаляется, так как процесс воспаления заходит слишком далеко. Кроме того, очень важен контроль процесса лечения, который проводится также с помощью рентгенографии. Отслеживание результатов лечения и динамики восстановления апекса, периодонта помогает своевременно скорректировать лечение и добиться нужного результата.
Ошибки в лечении периодонтита могут быть связаны с такими неверными действиями:
- Недостаточно глубокая и тщательная обработка корневых каналов.
- Не до конца проведенное раскрытие верхушечного отверстия в лечении острого периодонтита. Если не обеспечен надлежащий отток экссудата, гноя, воспаление быстро распространяется на прилежащие к корню ткани.
- Некорректное проведение вскрытия канала верхушки, когда инфицированное содержимое проталкивается за апекс корня.
- Травматическое повреждение периодонта при проведении вскрытия гайморовой пазухи при лечении зубного ряда верхней челюсти.
- Недостаточная механическая обработка канала. Так бывает, когда врач полагается на действие сильнодействующих препаратов, пренебрегая ручной очисткой. В результате в канале остается дентин, надлежащая герметизация канала проводится некачественно.
- Медикаментозный периодонтит является редкой ошибкой на сегодняшний день, однако единичные случаи все еще встречаются. Слишком высокая доза препарата, или наоборот неразумно малая, может спровоцировать токсическое воспаление тканей периодонта. Кроме того, что некротизируется костные ткани, сильнодействующие химические препараты в периапикальных тканях могут вызвать остеомиелит лунки.
- Ошибкой считается лечение зуба в то время, когда есть все показания к его экстракции. Попытка вылечить уже неживой зуб приводит к обострению воспаления и трансформации его в генерализированную форму.
- Использование неверно подобранных инструментов в процессе лечения уже давно стало неприятным историческим фактом. Современные методы лечения зубов практически на 100% исключают такие погрешности, поскольку многие годы стоматологи пользуются в практике терапевтическими, инструментальными алгоритмами действий.
- Перфорация канала также стала редкостью, раньше такие случаи встречались, так как у стоматологов не было эффективных способов оценить топографию корневого канала. Сегодня рентгенография достигла таких высот, что позволяет «увидеть» практически все, что необходимо врачу для результативного лечения.
- Не до конца доведенный пломбировочный материал. Это случается, когда цемент не достигает верхушечного отверстия. Этой ошибки можно избежать, используя для контроля рентген.
- Неверная оценка состояния зуба и проведение напрасной экстракции. Хирургию используют в крайних случаях, когда действительно невозможно спасти пораженный зуб.
Лечение периодонтита представляет собой сложный и довольно длительный процесс, кроме того периодонтит имеет множественные варианты и не всегда они проявляются специфичными симптомами. Поэтому терапевтическая стратегия выстраивается комплексно, обязательным является мониторинг состояния периодонта и лечение должно быть многоэтапным.

[1], [2], [3], [4], [5], [6], [7], [8], [9]
Консервативное лечение периодонтита
Консервативная терапия периодонтита - это длительное комплексное лечение, которое проводится в несколько этапов. Задачи, которые решает консервативное лечение периодонтита:
- Воздействие на бактериальную флору в каналах корня зуба.
- Нейтрализация воспалительного процесса, купирование воспаления.
- Десенсибилизация всего организма пациента.
Основные этапы консервативного лечения:
- Вскрытие канала.
- Удаление некротизированной пульпы.
- Прохождение канала зуба.
- Расширение канала.
- Санация канала.
- Воздействие лекарственными средствами на периодонтальные ткани.
- Установка пломбы.
- Восстановительная симптоматическая терапия – устранение остаточных явлений кариесного процесса.
В первую очередь проводится очистка, обработка канала, в котором может содержаться ткань пульпы, дентина. Канал санируется и расширяется для обеспечения адекватного оттока гнойного содержимого из очага воспаления. Кроме того, назначается ультрафиолетовое облучение уже санированного канала, что помогает ускорить нейтрализацию воспалительного процесса. Считается, что кроме непосредственной терапии пораженного зуба, стимуляция защитных свойств организма, то есть иммунитета, повышает результативность лечения во много раз. Поэтому в терапевтическую стратегию, кроме антибиотиков, включаются иммуномодулирующие препараты. Антибиотики назначают с учетом резистентности микроорганизмов ротовой полости, поэтому наиболее эффективными считаются препараты группы линкомицина, а также антибиотики широкого спектра действия последнего поколения.
Обобщая, консервативное лечение периодонта можно разделить на такие этапы:
- Вскрытие и ирригация каналов.
- Стерилизация, санация каналов.
- Временное пломбирование зуба антисептическими препаратами, содержащими кальций.
- Установка постоянной пломбы.

[10], [11], [12], [13], [14]
Хирургическое лечение периодонтита
Периодонтальная хирургия – это крайняя мера в лечении воспаления периодонта. Хирургическое лечение периодонтита предполагает частичное либо полное удаление корня, зуба. Экстракция зуба практикуется все реже, так как на сегодняшний день хирургия обладает всеми средствами зубосохранной терапии. Чаще применяется резекция апекса корня, причем удаляется не вся верхушка, а только пораженная часть. Процедура удаления максимально обезболивается, операция проводится быстро, что позволяет не только сохранить зуб, но в дальнейшем и реставрировать его с помощью коронки или других способов. Резекция верхушки проводится с одновременным удалением гранулемы, кисты, при этом стоматологи пользуются высокоэффективным лазерным методом, который считается бескровным и результативным. Подобные лазерные технологии широко применяются в хирургии резцов, премоляров, клыков. Воспаление периодонта в молярах предполагает гемисекцию, когда зуб распиливают, удаляется пораженный корень, а здоровый сохраняется и восстанавливается ортопедическими способами.
Хирургическое лечение периодонтита можно представить в виде таблицы:
Хирургия, сохраняющая зуб и периодонт
Хирургия, частично сохраняющая коронку зуба
Хирургия, не предполагающая сохранение зуба
Максимальное сохранение собственных зубов является, по сути, манифестом для всех пародонтологов, и целью, за которой уже многие годы следуют все стоматологи. Технологические усовершенствования сделали данную цель уже более достигаемой, чем ранее, но даже несмотря на возможности пародонтальной регенерации и реконструкции периодонтальной связки, цемента, десен и альвеолярной кости, полностью решить проблему пародонтальных поражений так и не удалось.
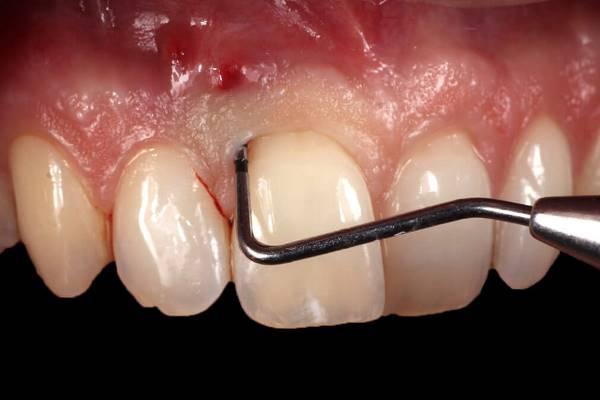
В июне 2014 года 52 международных представителя, среди которых были клиницисты, исследователи и ученые, собрались вместе в ходе семинара Американской академии пародонтологии (AAP), для того чтобы систематизировать все доступные данные по пародонтальной регенерации. В ходе семинара участникам удалось не только обговорить механизмы биологических реакций в структуре пародонта, и то, как данные аспекты могут быть использованы в практике, но и определить перспективы для дальнейших исследований. AAP инициировала работу данного конгресса совсем небезосновательно: в то время в США уровень распространенности пародонтальных патологий был критически высоким. Данные, полученные Центрами по контролю и профилактике заболеваний (CDC), которые удалось собрать за период 2009-2012 годов, указывают на то, что почти 50% всего населения США в возрасте старше 30 лет, имеют разные формы поражения тканей пародонта, а 70% американцев в возрасте 65 лет и старше страдают от деструктивных форм пародонтита. Пародонтит легкой и средней форм сложности был зарегистрирован среди 38% взрослого населения США. Сохранение целостности естественного зубного ряда при одновременном обеспечении ремиссии пародонтального заболевания является крайне сложной клинической задачей, которая выходит за рамки обычной коррекции параметров эстетики и функции структурных элементов ротовой полости.
Растущее количество фактических данных указывает на наличие связи между патологией пародонта и системными заболеваниями организма: например, была обнаружена зависимость между пародонтитом умеренно-тяжелой степени сложности и повышенным риском возможности развития диабета. Эпидемиологические данные также свидетельствуют о том, что пародонтит повышает риск развития сердечно-сосудистых заболеваний. Хотя имеющихся данных пока что недостаточно, однако ученые уже отметили возможность существования патофизиологической связи между пародонтитом и хронической обструктивной болезнью легких, пневмонией, хронической болезнью почек, ревматоидным артритом, когнитивными нарушениями, ожирением, метаболическим синдромом и раком. Регенеративные методы коррекции пародонтальных нарушения нацелены не на замедление процесса прогрессирования заболевания, но на восстановление сформировавшихся дефектов мягких и твердых тканей, защиту еще интактных единиц зубного ряда и подготовку пораженных участков для дальнейшей реабилитации с использованием имплантатов. Однако воспаление, ассоциированное с пародонтитом, все же может быть уменьшено в процессе повторного физиологического восстановления тканей за счет естественных биологических механизмов.
Типы регенеративных техник пародонтальных вмешательств
Многие новые появляющиеся методы регенераторных пародонтальных вмешательств, в том числе и те, которые предполагают использование систем доставки определенных клеток, матричных остовов, костных анаболических агентов и мезенхимальных стволовых клеток, находятся на ранней доклинической стадии апробации и требуют дополнительного научного исследования для их дальнейшей имплементации в клиническую стоматологическую практику. Процедуры твердотканной аугментации позволяют восстановить костную ткань, периодонтальную связку и корневой цемент, которые в своем комплексе обеспечивают стабилизацию зуба. Процедуры мягкотканой аугментации позволяют стимулировать рост новых десен в области рецессии, улучшая эстетической вид слизистой. Наиболее распространенными в клинической практике являются следующие три типа пародонтальных ятрогенных вмешательств: костная аугментация, использование биологических агентов и направленная тканевая регенерация (НТР).
Костная пластика
Костная пластика является одной из наиболее долго используемых техник регенеративных ятрогенных вмешательств, в ходе реализации которой может быть использована собственная костная ткань пациента (аутотрансплантат), костная ткань другого пациента (аллотрансплантат), костная ткань разных видов животных (ксенотранслпантат), или же искусственно синтезированная костная ткань (аллопластный трансплантат). Со временем используемый аугментат замещается костью пациента.
Направленная тканевая регенерация
Процедура направленной регенерация тканей предусматривает применение барьерной мембраны для защиты и стабилизации кровяного сгустка в ходе процесса заживления области костной аугментации. Любые вмешательства в структуру кровяного сгустка во время заживления раны могут вызвать нарушения и формирование рубцовой ткани вместо новой кости и связки. Используемые мембраны могут быть резорбируемыми и нерезорбируемыми. Первые идеально подходят при вмешательствах непосредственно на пародонте, другие – лучше всего работают в ходе реконструкции альвеолярного гребня и его подготовки под будущую установку имплантатов. Резорбируемые мембраны исключают потребность проведения повторных хирургических вмешательств с целью их удаления, что очень удобно для пациента. Но при этом они также должны характеризовать соответствующими параметрами деградации, которые позволят удержать достаточный объем пространства для его выполнения костной тканью. В случаях, когда основная барьерная функция мембраны может быть компрометирована анатомическими особенностями в области вмешательства, врач должен прибегнуть к альтернативному методу лечения. Так, вместо мембраны можно использовать костный графт, который характеризуется достаточно быстрой резорбцией. Мембраны, которые резорбируются слишком медленно, могут препятствовать притоку крови к регенерированным структурам, и более часто подвергаются инфицированию. Как и в любом клиническом случае, врач должен использовать НТР только в клинических условиях, оптимально подходящих для такого вида вмешательства. Кроме того, для обеспечения успешности НТР врач должен провести прецизионную деконтаминацию корня зуба в области реализации основного хирургического вмешательства. Следует отметить, что надлежащая дезинфекция корня зуба также требует специальных технических навыков и соответствующего опыта.
Биопрепараты
Биологические агенты продемонстрировали значительный потенциал в процессе восстановления пародонтальных ран. Такие препараты включают факторы роста, производные эмалевого матрикса и костные анаболические агенты, которые стимулируют клетки к пролиферации, миграции, биосинтезу или дифференцированию матрикса. Как правило, большинство техник использования биопрепаратов являются на ранних стадиях апробации, однако некоторые из них уже довольно широко применяются в клинической практике. В будущем планируется проводить индивидуализированные пародонтальные вмешательства с учетом генетического фона пациента, использованием биомаркеров с целью прогноза, трехмерных технологий с целью планирования и клеточных остовов в качестве основных материалов для трансплантации.
Регенеративные процедуры при дефектах в области фуркации и внутрикостных дефектах
Как правило, пациенты, требующие проведения регенеративных пародонтальных вмешательств, характеризуются наличием дефектов тканей в области фуркации и внутрикостных дефектов. Классификация дефектов в области фуркации осуществляется за счет оценки уровня потери пародонтального прикрепления на участках «раздвоения» корней зубов. Клиницисты часто стоят перед выбором: стоит ли удалять такие зубы, или все же попытаться восстановить ткани в области имеющегося дефекта.
Результаты, полученные Huynh-Ba и коллегами, указывают на то, что НТР области фуркационных дефектов обеспечивает высокую выживаемость пролеченных зубов на уровне 83,3-100% в ходе 5-12 летнего мониторинга. Внутрикостные дефекты развиваются при внутреннем пародонтальном поражении альвеолярного гребня. Lang и коллеги рекомендуют оценить морфологию внутрикостного дефекта по количеству пораженных костных стенок.
Классификация Goldman и Cohen (1958) предполагает наличие четырех классов дефектов:
- с поражением трех или четырёх костных стенок;
- с поражением двух костных стенок;
- с поражением одной костной стенки;
- комбинированные дефекты (например, с поражением 3 и 2 стенок и т.д.).
Цель пародонтальной терапии любых типов дефектов состоит в непосредственной регенерации тканей пародонта, включая аппозицию нового цемента с проникновением в него волокон пародонтальной связки. Reynolds и коллеги установили, что регенеративное лечение внутрикостных пародонтальных дефектов повышает уровень клинического прикрепления, способствует редукции пародонтальных карманов и улучшает общее состояние пародонта. Алгоритм восстановления внутрикостных дефектов, как правило, предусматривает костную аугментацию посредством разных типов трансплантатов, однако с той же целью можно использовать методы направленной регенерации тканей и принципы применения биологически активных агентов.
От теории к практике
Материалы семинара AAP по регенерации были опубликованы в Journal of Periodontology, и включали в себя консенсусные отчеты и систематические обзоры по восстановлению мягкотканного покрытия поверхности корней, дефектов в области фуркаций и реконструкции пародонта. Сопровождающие практические рекомендации были опубликованы в журналах Clinical Advances in Periodontics и Journal of Periodontology, которые сформировали, собственно, переход от теории к практике.
Методы лечения дефектов рецессии десны представляют собой ключевую проблему в возможностях регенерации пародонта. Рецессия десны является довольно распространённым состоянием, и участники семинара сошлись на том, что оценка результатов его коррекции должна проводиться с учетом уменьшения глубины дефекта, улучшения уровня клинического прикрепления и прироста кератинизированных мягких тканей. С целью восстановления покрытия обнаженной поверхности зуба можно использовать техники субэпителиального соединительнотканевого лоскута, коронально смещенного лоскута, свободного десневого графта и его аналогов, по типу бесклеточного дермального матрикса, кетогенного коллагенового мактрикса и биоактивных агентов (рекомбинантного фактора роста, полученного из тромбоцитов или производных эмалевой матрицы).
Richardson и коллеги отметили: «Вариативность выбора вышеупомянутых методов вертится вокруг возможности или невозможности забора мягкотканного трансплантата с неба. Выбор метода лечения должен базироваться на возможности формирования максимального ассоциированного с формой рецессии графта, учитывая при этом все цели хирургического вмешательства и индивидуальные условия клинической ситуации. Результаты проведенного систематичного обзора указывают на то, что применение субэпителиального соединительнотканевого трансплантата обеспечивает наилучший исход лечения с точки зрения восстановления покрытия поверхности корня и прироста кератинизированных десен».
Что же касается ситуаций, не требующих восстановления мягкотканного покрытия корня, John и коллеги установили, что процедура аугментации области десен обязательно должна сопровождаться обучением пациента гигиеническому уходу за полостью рта и редукцией влияния потенциальных факторов риска: «Понимание того, что минимальное количество прикрепленной десны и неоптимальный уровень гигиены полости рта, являются определяющими клиническими условиями – это первый шаг на пути к объективной диагностике. Анализ пациент-специфических факторов помогает адекватно подойти к выбору хирургической процедуры, направленной на увеличение параметров кератинизированных тканей/прикрепленных десен.»
Reynolds и коллеги резюмировали, что выбор наиболее эффективного метода лечения внутрикостных дефектов зависит от проведенной полноценной диагностики и учета пациент-ассоциированных факторов риска. При этом авторы также резюмировали, что терапевтические подходы, предусматривающие использование комбинированных техник лечения, также являются достаточно успешными. Так, например, бесклеточные трансплантаты для замещения дефектов, которые используются в протоколе направленной регенерации тканей, способствуют достижению надлежащей стабильности области аугментации, защите кровяного сгустка и формированию новой ткани. При этом данный подход, по сути, не предусматривает использование биологически-активных агентов. Выбор метода лечения внутрикостных дефектов должен предполагать анализ таких параметров, как количество резидуальных интактных стенок, потерю высоты ткани, близость дефекта к другим структурам, возможность достижения надлежащей васкуляризации в будущем.
Aichelmann-Reidy при лечении патологии в области фуркации рекомендуют учитывать системные пациент-ассоциированные факторы, локализированные анатомические возможности и характеристики самой области фуркации. Дефекты фуркации по II классу, как правило, подлежат прогнозированному лечению с применением методов регенераторного лечения, а дефекты по I классу можно восстановить посредством комбинации костной аугментации и изолирующих мембран. Lin и коллеги указывают на то, что современные технологии прогрессивно способствуют развитию новых пародонтально-регенеративных методов лечения, и публикующиеся клинические отчеты свидетельствуют о еще большей вариативности актуальных методов вмешательства на тканях пародонта. Однако, остается еще одна проблема – дефицит доказательной базы, но данный аспект зависит лишь от времени и результатов имплементации различных подходов.
Систематизированный консенсусный доклад Cochran и коллег о приоритетах будущих исследований в области новых пародонтальных технологий можно представить в виде последующих тезисов:
- Необходимо разработать неинвазивные методы оценки клинических результатов регенераторных вмешательств на пародонте. Такой подход должен также позволить оценить эффективность новых методов лечения.
- Необходимо провести валидацию тех методов лечения, которые используются не по прямому назначению, ведь некоторые пародонтальные техники вмешательства были оригинально разработаны для совсем других целей.
- Для персонализации лечения необходимо обеспечить анализ генетического и эпигенетического профилей пациента.
- Для выбора определенного метода лечения необходимо оценить влияние патогенеза, этиологии и потенциала к регенерации при разных формах поражений пародонта.
- Для более прогнозированного лечения и восстановления структуры и функции пародонта врач должен систематизировать все потенциальные факторы риска, связанные с ятрогенным вмешательством.
- Необходимо определить молекулярные и клеточные механизмы каждого из методов лечения с использованием моделей in vitro и in vivo.
- Необходимо определить пути развития пародонтальных поражений для оптимизации применения различных методов регенеративной терапии.
- Исследователи должны сосредоточиться на разработке минимально инвазивных технологий для минимизации постоперационных болевых ощущений и дискомфорта без ущерба для результатов реабилитации.
- Необходима разработка критериев, определяющих клинический успех вмешательств.
- Необходима оценка влияния выбранного метода регенераторной пародонтальной терапии на качество жизни пациента.
Заключение
Регенеративная терапия с использованием трансплантатов мягких и твердых тканей, биологических агентов или направленной тканевой регенерации имеет многообещающее будущее в отрасли пародонтологии. Ряд дополнительных регенеративных методов, включая новые системы доставки клеток, является весьма перспективным, но требует дальнейшего научного исследования для определения их эффективности. Результаты консенсусных семинаров по регенерации пародонта указывают на наличие сильной доказательной базы, подтверждающей эффективность реконструктивной терапии пародонтальных дефектов, позволяющей восстановить не только структуру мягких и твердых тканей, но и их полноценную функцию. Использование регенеративных вмешательств в области пародонта также способствует сохранению собственных зубов пациента, что является одной из наиболее важных целей в пародонтологии.
Авторы:
William V. Giannobile, DDS, DMSc
Pamela K. McClain, DDS
Регенерация в пародонтологии- одно из ключевых направлений современной науки и клинической практики. В данном материале представлена вторая часть материала по этой важной теме.
Концепции регенерации
Один из первых методов, используемых в попытках получить новое прикреплением был скейлинг и обработка корней (т.е. удаление патологически измененного корневого цемента и эпителия кармана). Исследования с участием людей (например, McCall 1926; Orban 1948; Beube 1952; Waerhaug 1952; Schaffer & Zander 1953; Carranza 1954, 1960) и на животных (например, Beube 1947; Ramfjord 1951; Kon et al.1969) показали, что этот тип пародонтальной терапии привел не только к улучшению состояния десны, но и к снижению первоначальной глубины кармана.
Это уменьшение глубины пародонтального кармана считалось отчасти результатом усадки первоначально воспаленной десны, но частично также с эффектом формирования нового прикрепления соединительной ткани в апикальной части кармана.
Возможность получения нового прикрепления стала широко применяться после работ Prichard (1957), в которых формирование нового прикрепления во внутрикостных дефектах тканей пародонта были описаны как предсказуемый результат лечения. Были представлены 17 случаев, из которых 4 были подвергнуты повторной хирургической процедуре. В них было выявлено формирование новой костной ткани в области дефектов.
Техника Prichard (1957, 1960) была использована только для лечения трехстеночных внутрикостных дефектов, а полученные результаты предполагают что морфология дефектов была важна для создания предсказуемого прогноза. Goldman and Cohen (1958) представили классификацию внутрикостных дефектов тканей пародонта, которая была основана на количестве костных стенок, окружающих дефект, были выделены трех- двух или одностеночные дефекты или их комбинации (рис. ниже).
Техника Prichard (1957, 1960) включала откидывание лоскута , чтобы получить доступ к дефекту, удаление грануляционной ткани внутри дефекта, скейлинг и полировка корней. Для улучшения регенерации кости были сделаны небольшие перфорации с помощью бора в нескольких местах кости. Лоскут ушивают для достижения полного покрытия дефекта. Многие клинические исследователи утверждают, что недостаточно свидетельств успешного восстановления прикрепления (Patur &Glickmann 1962; Wade 1962, 1966; Ellegaard & Löe1971). Patur и Glickmann (1962) сообщили о клиническом исследовании, включающим 24 внутрикостных дефекта, обработанных по методике Prichard . Результат оценивали путем сравнения предоперационных и послеоперационных рентгенограмм, измерений уровня альвеолярного отростка, прилегающего к корню. Также изучали образцы, взятые во время операции и после операции после откидывания щечных и язычных лоскутов.
Авторы сообщили, что произошло восстановление прикрепления в двухстеночных и трехстеночных дефектах, в одностеночных дефектах такого эффекта не наблюдали. Результаты исследования Ellegaar и Löe (1971), включающие 191 дефект у 24 пациентов при заболеваниях пародонта указали, что регенерация, определенная рентгенологически и зондированием пародонта имела место примерно в 70% случаев в трехстеночных дефектах, в 40% в комбинированных дефектах и в 45% случаев при двухстеночных.
В более позднем исследовании Rosling et al. (1976) 124 внутрикостных дефекта у 12 пациентов были прооперированы с помощью модифицированого лоскута Widman (Ramfjord & Nissle 1974). После лечения пациентов вызывали два раза в месяц для профессиональной гигиены зубов. Повторное обследование, проведенное клинически и на рентгенограммах через 2 года после терапии, продемонстрировало заполнение костной тканью 2,3-стеночных дефектов. Авторы предположили, что этот рост кости также был связан с образованием нового прикрепления и приписывают успешное лечение в основном оптимальному уровню гигиены полости рта, который поддерживался у всех пациентов во время заживления. Клиническое исследование с почти идентичными результатами было представлено Polson and Heijl (1978). Результаты нескольких гистологических исследований на животных и людях, с другой стороны, указывают на то, что формирование нового пародонтального прикрепления отнюдь не предсказуемо после открытого кюретажа или лоскутной операции Listgarten & Rosenberg 1979;Caton & Nyman 1980; Caton et al. 1980; Steiner et al.1981; Stahl et al. 1983; Bowers et al. 1989a)
Прогрессирование пародонтита с разной скоростью на соседних поверхностях зубов приводит к развитию внутрикостных дефектов. В зависимости от количества окружающих костных стенок такие дефекты классифицируются как одностенные (а), двухстенные (b) или трехстенные дефекты (с).

Графтинг
В ряде клинических испытаний и экспериментах на животных, лоскутная операция комбинировалась с применением костных трансплантатов или материалов в предварительно обработанный костный дефект с целью стимуляции регенерации пародонта. Все материалы для трансплантации и имплантации можно разделить на четыре категории:
1. Аутогенные трансплантаты: трансплантаты, перенесенные из одного участка к другому внутри одно и того же индивидуума. Этот тип графтинга предполагает использование кортикальной и губчатой костной ткани и костного мозга. Материал получается из интро- или экстраоральных донорских участков.
2. Аллогенные трансплантаты: трансплантаты, полученные от генетически различных представителей одного вида. Например, замороженная губчатая костная ткань или костный мозг.
3. Ксеногенные трансплантаты: трансплантаты, полученные от донора другой вид.
4. Аллопластические материалы: синтетические или неорганические имплантаты, которые используются в качестве заменителей костной ткани.
Применение различных графтов обосновано тем, что при их применении с одной стороны стимулируется образование новой костной ткани, а с другой формирование нового прикрепления. Это связано с тем, что эти материалы (1) содержат остеообразующие клетки (остеогенез), (2) служат каркасом для формирования кости (остеокондукция), (3) матрица трансплантатов содержит костный вещества‐индукторы (остеоиндукция) (Urist 1980; Brunsvold & Mellonig 1993).
Регенерация прикрепления после графтинга основана на представлении о том, что клетки костной ткани способны формировать новый цемент со вставками коллагеновых волокон на поверхностях корней, ранее вовлеченных в пародонтит (Melcher et al. 1987). Это мнение вступает в противоречие с современными знаниями о биологии заживления в пародонтологии. Известно, что необходимым условием для формирования нового прикрепления является повторное заселение отделенной поверхности корня клетками периодонтальной связки. Это означает, что все лечебные процедуры, связанные с размещением костных трансплантатов или заменителей кости, основываясь на биологической концепции, не могут объяснить регенерацию пародонта.
Эффект от применения костных трансплантатов или аллопластических материалов для регенерации пародонта в большинстве отчетов основывался на данных осмотра, в то время как гистологических доказательств формирования прикрепления было очень мало.
Данные отчетов сильно различаются и представленные документы, как правило, состояли из данных пред и послеоперационного зондирования, уровня прикрепления (PAL), рентгенографических описаний.
Биомодификация поверхности корня
Многие исследования были направлены на изучение состояния поверхности корня, измененного пародонтитом. Воздействие на него должно быть таким, чтобы способствовать формированию новой соединительной ткани. Удаление бактериальных отложений, камней и эндотоксинов из цемента считается необходимым для формирования новой соединительной ткани (Garrett 1977). Тем не менее, было исследовано Stahl et al. (1972), что деминерализация поверхности корня с обнажением коллагена дентина, будет способствовать отложению цемента, индуцируя мезенхимальные клетки в соседних тканях, которые в свою очередь будут дифференцироваться в цементобласты.
Биологическая концепция заключается в том, что воздействие коллагеновых волокон матрицы дентина может способствовать адгезии сгустка крови к поверхности корня и тем самым способствует миграции фибробластов. Однако эта концепция сомнительно соответствует современным знаниям о заживлении пародонта, так как нет доказательства того, что воздействие коллагеновых волокон матрицы дентина облегчает репопуляцию поверхности корня клетками, происходящими из периодонтальной связки. Как упоминалось ранее, клетки периодонтальной связки необходимы для создания нового прикрепление соединительной ткани.
Несколько исследований с использованием различных моделей животных продемонстрировали улучшенные гистологические результаты после применения лимонной кислоты и тетрациклина для деминерализацииповерхности корня(Register & Burdick 1976; Crigger et al. 1978; Polson & Proye 1982; Claffey et al. 1987). Тем не менее, в исследовании на собаках, где естественно возникающие дефекты фуркации обрабатывали лимонной кислотой, несколько образцов продемонстрировали анкилоз и резорбцию корня (Bogle et al. 1981). Этот вывод подтверждает выводы Magnusson et al. (1985) у обезьян, где лимонная кислота наносилась на поверхность корня с последующим апикальным смещением лоскута. Результаты оценивали после 6 месяцев. Эти исследователи также обнаружили резорбцию корня на 28 из 40 исследованных поверхностей и 21 из них также показал анкилоз.
Новое соединение после обработки лимонной кислотой для деминерализация поверхности корней было продемонстрировано гистологически у людей (Cole et al. 1980; Frank et al. 1983; Stahl et al. 1983; Stahl & Froum 1991). Cole и соавт. (1980) показали гистологическое доказательство нового прикрепления соединительной ткани и образование содинительной ткани апикальней контрольной выемки на поверхности корня. Однако, несмотря на гистологические доказательства регенерации после биомодификации поверхности корня лимонной кислотой, в результате контролируемых клинических исследований не удалось показать каких-либо улучшений в клинических условиях по сравнению с контрольной группой, где не использовали кислоту (Moore et al. 1987; Fuentes et al. 1993).
Модификация корневой поверхности с использованием местно наносимых белков эмалевого матрикса (Emdogain®) во время операции и после деминерализации этилендиаминтетрауксусной кислотой (ЭДТА) были введены для усиления регенерации пародонта. Биологическая концепция заключается в том, что применение эмалево матричных белков (включая амелогенины) может способствовать регенерации пародонта, потому что они имитируют события, которые происходят во время синтеза тканей пародонта (Hammarström 1997; Gestreliusи другие. 2000). Это мнение основано на выводе о том, что клетки эпителиального Гертвиговского влагалища и белки эмалевого матрикса на поверхности корня являются клетками-предшественниками цемента, и что эти белки являются инициирующими факторами образования цемента.
Коммерчески доступный продукт Emdogain®, очищенный кислотный экстракт свиного происхождения, содержит производные матрицы эмали(EMD), которые должны способствовать регенерации пародонта. Тем не менее, не совсем ясно, как эта концепция сочетается с современными знаниями о заживлении пародонта, так как не было предоставлено никаких доказательств того, что клетки, полученные из периодонтальной связки необходимы для заселения поверхности корня после обработки. Тем не менее, исследование на собаках (Araùjo et al. 2003), где повторно имплантировали корни, которые были извлечены и лишены жизненно важных цементобластов и впоследствии обработаны EMD, показало, что не удалось предотвратить анкилоз и резорбции корня. Это указывает на то, поверхности не заселялись клетками способными образовывать цемент. В последующем исследовании in vitro также не удалось подтвердить, что EMD имеют какое-либо существенное влияние на пролиферацию клеток периодонтальной связки (Chong et al. 2006).
В отчетах, описывающих серии случаев, где отмечалось увеличение клинического прикрепления на 4–4,5 мм и 70% заполнения внутрикостных дефектов, были зарегистрированы после лечения с EMD (Heden et al. 1999; Heden 2000). В многоцентровом клиническом исследовании с участием 33 пациентов с 34 парными внутрикостными дефектами применение EMD привело к увеличению прироста PAL( прикрепленной десны) на 2,2 мм и статистически значимому приросту костной ткани (2,6 мм) по сравнению со случаями, когда только откидывался лоскут и проводилось удаление зубных отложений. Оценка проводилась через 36 месяцев клинически и рентгенографически (Heijl et al. 1997). Подобные результаты были зарегистрированы в другом клиническом испытании(23 пациента) (Froum et al. 2001). В этом исследовании уменьшение глубины зондирования (PPD) на 4,9 мм, PAL прирост на 4,3 мм и прирост кости на 3,8 мм (оценивается после повторной операции) наблюдались после применения EMD в 53 внутрикостных дефектов. Эти значения были статистически значимее, чем полученные после лоскутной операции (2,2 мм, 2,7 мм и 1,5 мм соответственно с 31 дефектом).
В проспективном многоцентровом рандомизированном контролируемом клиническом исследовании сравнивали клинические исходы лоскутной операции с сохранением сосочков (SPPF) с применением или без применения белков эмалевого матрикса (Tonetti et al.2002). Всего 83 тестовых и 83 контрольных пациентта с аналогичными исходными условиями тканей пародонта и характеристиками дефектов были прооперированы либо SPPF + Эмдогейн® либо только с SPPF. Изменения проявлялись значительно более высоким уровнем клинического прикрепления(CAL), чем в контрольной группе (3,1 ± 1,5 мм и 2,5 ± 1,5 мм соответственно).
Когда применение EMD сравнивалось с НТР техникой , были получены аналогичные клинические улучшения. В рандомизированном контролируемом клиническом исследовании Pontoriero et al. (1999) сравнил EMD с НТР, при этом использовались как резорбируемые (два вида: Guidor и Resolut), так и нерезорбируемые (e-PTFE) мембраны во внутрикостных дефектах. Через 12 месяцев не было никаких существенных различий между группами. Применение EMD привело к уменьшение глубины зондирования на 4,4 мм и увеличению PAL на 2,9 мм, в то время как соответствующие значения из участков, где применялись мембраны (обе группы НТР объединены)были 4,5 мм и 3,1 мм соответственно. Silvestri et al. (2000) сообщили о снижении PPD на 4,8 мм и увеличении PAL на 4,5 мм после применения EMD во внутрикостных дефектах против 5,9 мм и 4,8 мм соответственно после применения направленной тканевой регенерации с нерассасывающимися мембранами. Подобные результаты были сообщены другими исследователями (Sculean et al. 1999a, b; Silvestri et al.2000, 2003; Sanz et al. 2004). Существуют исследования, показывающие, что после применения EMD при внутрикостных дефектах, клинические улучшения могут достигаться путем дополнительного использования костных трансплантационных материалов (Zucchelli et al. 2003; Gurinsky et al. 2004; Trombelli et al. 2006), хотя другие не смогли продемонстрировать положительный эффект этого сочетания в лечении (Sculean et al. 2005).
Гистологическое подтверждение образования нового цемента с вплетение коллагеновых волокон на пораженной ранее пародонтитом поверхности корня и формирование новой альвеолярной кости в образцах человека были продемонстрированы после лечения EMD (Mellonig 1999; Sculean et al. 1999b). Однако в исследование Mellonig (1999) восстановление произошло бесклеточным цементом на поверхности корня, в то время как образовавшийся цемент в исследовании Sculean et al. (1999b) был преимущественно клеточный. Способность EMD к активации регенерации была подтверждены в контролируемых экспериментах на животных, после обработки внутрикостных и фуркационных дефектов(Hammarström et al.1997; Araùjo & Lindhe 1998; Sculean et al. 2000). В более позднем исследовании на обезьянах было показано, что совместное применение EMD и аутогенных костных трансплантатов может улучшить регенерацию пародонта по сравнению с одной только лоскутной операцией (Cochran et al. 2003).
а) Микрофотография дефекта фуркации III степени у собаки после биомодификации корневой поверхности эмалевым матричным протеином и покрытием рассасывающейся мембраной. Дефект был полностью восстановлен костной тканью (NB), периодонтальной связкой (P) и новым цементом (NC). Стрелки указывают на апикальное расширение поражения. b) цемент (NAC), образованный на поверхности корня в апикальной части дефекта, бесклеточный по структуре с включением внешних коллагеновых волокон (ECF), в то время как (c) новый клеточный цемент образовался в корональной части (NCC).
Читайте также:

